- +1
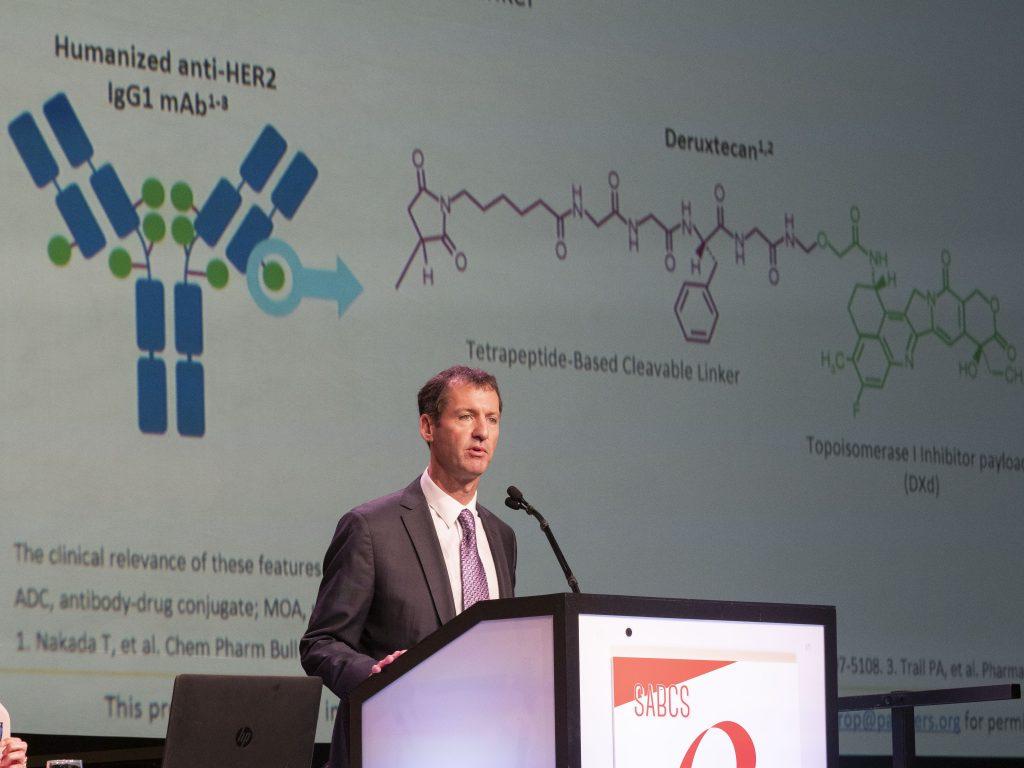
从DB01到DB02和DB03——HER2阳性晚期乳腺癌的治疗突破和格局确立
*仅供医学专业人士阅读参考
胡夕春教授解读DB02和DB03研究新数据,T-DXd再次突破疗效,确立治疗格局
第45届SABCS大会第二天,Ian Krop和Sara Hurvitz两位教授在同一环节前后作报告,发布了DESTINY-Breast03研究更新的PFS和OS数据,以及DESTINY-Breast02研究的主要疗效数据。T-DXd不仅再次刷新HER2阳性晚期乳腺癌的PFS高度,而且随着这两项III期研究的数据公布T-DXd作为二线治疗标准方案的地位也得到更有力的证据支持,很多此前的疑问可以因此得到解答。ADC Academy特邀著名乳腺癌专家,复旦大学附属肿瘤医院胡夕春教授,为我们解读和点评从最初的DB01研究到最新的DB02和DB03对HER2阳性乳腺癌治疗的影响。
专家简介

DESTINY-Breast01
初露锋芒的惊艳亮相
2019年12月,第42届圣安东尼奥乳腺癌大会(SABCS)的主角还是正冉冉升起的CDK4/6抑制剂,HR阳性乳腺癌进入全新的靶向治疗时代;而HER2阳性乳腺癌自T-DM1之后,还没有新的药物显示出明确潜力能挑战双靶和T-DM1的地位。抗HER2治疗作为最为成功的靶向治疗之一,将HER2阳性作为乳腺癌的不良预后因素,转变为可靶向治疗且可取得良好预后的标志,这三款药物居功至伟。彼时,HER2阳性晚期乳腺癌从曲妥珠单抗单靶治疗,发展到曲妥珠单抗+帕妥珠单抗的双靶一线治疗,再到ADC药物T-DM1取代TKI成为二线标准,历经20年的历程之后,似乎未来一段时间内,抗HER2治疗的发展可能会以不同抗HER2药物的排列组合以及不同疾病场景下的细分人群探索为主要方向。结果乳腺癌专家并不陌生的ADC药物,在抗HER2治疗领域投下一枚深水炸弹,并在日后迅速掀起新一代的变革浪潮,这就是DESTINY-Breast01研究(DB01)。
2019年SABCS大会
Ian Krop教授报道DB01研究的初步数据
哈佛大学Dana-Farber癌症研究所的Ian Krop教授当时在现场报告了DB01的疗效数据。尽管在此之前已有I期研究DS-8021-A-J101显示新一代ADC药物T-DXd在严重经治(中位治疗7.5线)的HER2阳性晚期乳腺癌中显示出极佳的疗效,并在2017年因此获得FDA突破性疗法认证,但作为样本量更大的II期研究,DB01完美重复出了T-DXd的高度有效性,当显示客观缓解率的瀑布图出现后,被称是为前所未有的惊艳疗效。根据当时发布的数据,在既往中位治疗6线的患者中,T-DXd治疗的ORR达到60.9%,DCR达到97.3%,几乎所有患者的肿瘤都有所缩小。中位PFS也达到16.4个月。当时该研究数据同步发表在《新英格兰医学杂志》,很快就成为各地乳腺癌讨论和关注的热点。
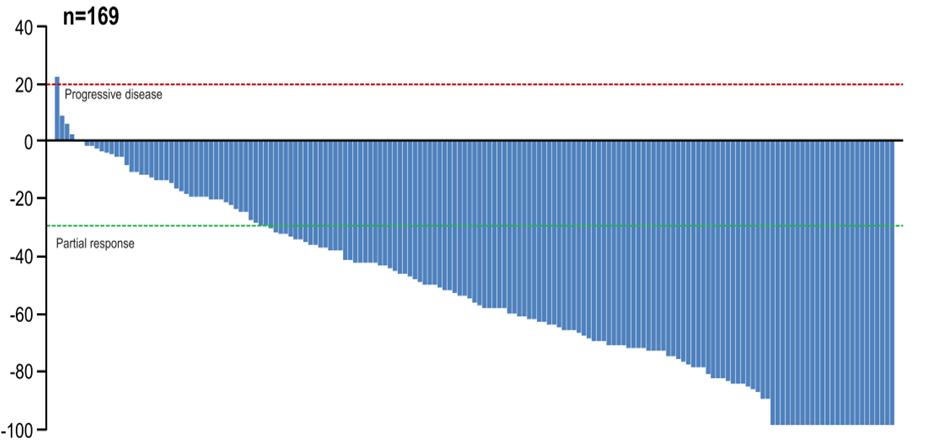
DB01研究显示肿瘤体积大小变化的瀑布图
T-DXd治疗的ORR达到60.9%
随后在2021年ESMO年会披露的DB01更新数据中,T-DXd治疗的ORR最终达到62%,其中6%的患者达到完全缓解;除了有效率非常高之外,疾病控制也显示出非常好的持久性,中位PFS达到19.4个月,中位持续缓解时间(DoR)达到20.8个月,在如此后线的情况下最终的中位OS也达到29.1个月。
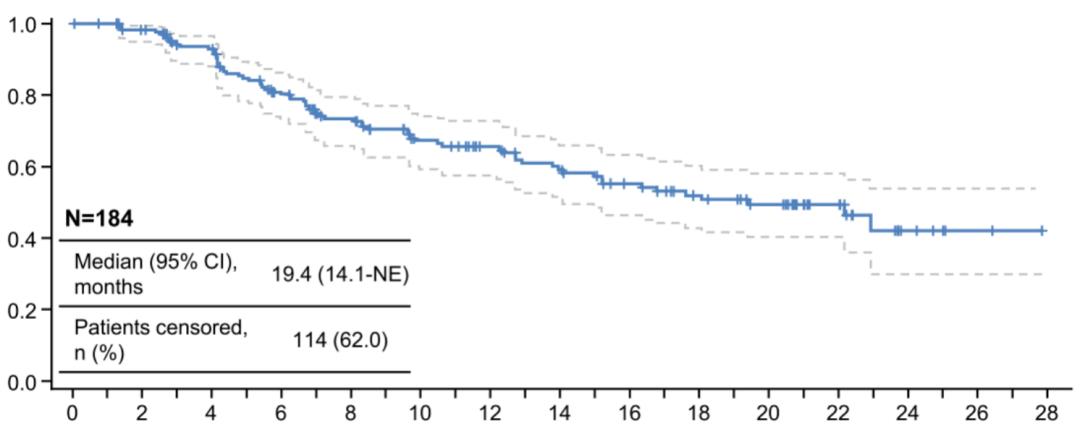
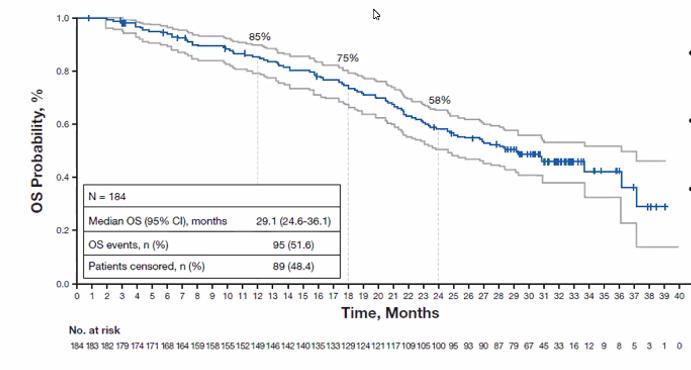
DB01研究中T-DXd治疗后线患者的PFS和OS
2019年12月,FDA加速批准了T-DXd用于转移阶段既往已接受过≥2线抗HER2治疗的HER2阳性晚期乳腺癌患者。鉴于该项适应症的批准,主要依据的DB01研究为单臂的II期临床,因此有附加条件,需进行随机对照的III期临床研究对该适应症人群的疗效进行验证。DESTINY-Breast02(DB02)研究即为该确证性III期临床。与此同时,基于在后线的惊艳疗效,T-DXd往前应用到二线治疗,与T-DM1头对头比较的研究也相应开展,即DESTINY-Breast03研究。
DESTINY-Breast02
三线治疗的确证性III期研究
DB02研究作为DB01研究的确证性随机对照的多中心、开放性III期试验,入组接受过T-DM1治疗的HER2阳性晚期乳腺癌患者,按照2:1随机分配至T-DXd组和医师选择方案(TPC)组,其中TPC组接受曲妥珠单抗联合卡培他滨或拉帕替尼联合卡培他滨的治疗,研究开始时图卡替尼等药物尚未上市,曲妥珠单抗跨线治疗和拉帕替尼联合卡培他滨是临床三线治疗常用方案(实际上后线治疗尚没有确定的标准方案)。主要研究终点为BICR评估的PFS,关键次要终点为OS,其他次要终点包括ORR、DoR、研究者评估的PFS等,还设置CBR和PFS2为探索性终点。研究的分层因素为患者HR状态、既往帕妥珠单抗经治与否和内脏转移病史。
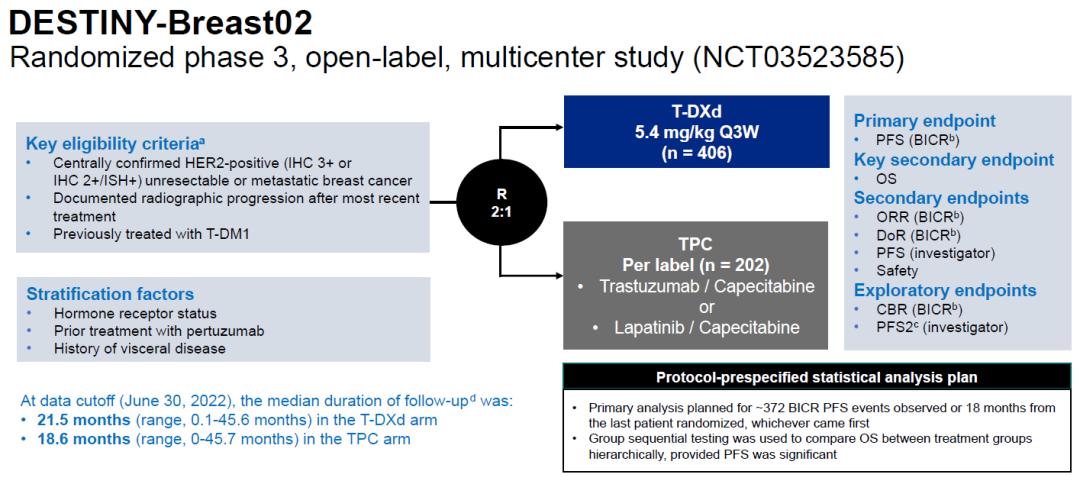
DB02研究的试验方案
该研究共入组406位患者至T-DXd组,202位患者至TPC组,到2022年6月30日的数据截止日期,两组的中位随访时间分别为21.5个月和18.6个月。入组患者既往中位治疗线数为三线,基本上所有患者都接受过曲妥珠单抗和T-DM1的治疗,近80%的患者接受过帕妥珠单抗治疗,这是非常典型的≥3线治疗人群的既往经治情况。
在12月7日SABCS公布的数据中,DB02毫无悬念的达到主要研究终点,BICR的中位PFS显著延长(17.8 vs 6.9个月),T-DXd组相比TPC组降低疾病进展或死亡风险64%。T-DXd组在24个月时有42.2%的患者仍未发生疾病进展,而TPC组仅13.9%。
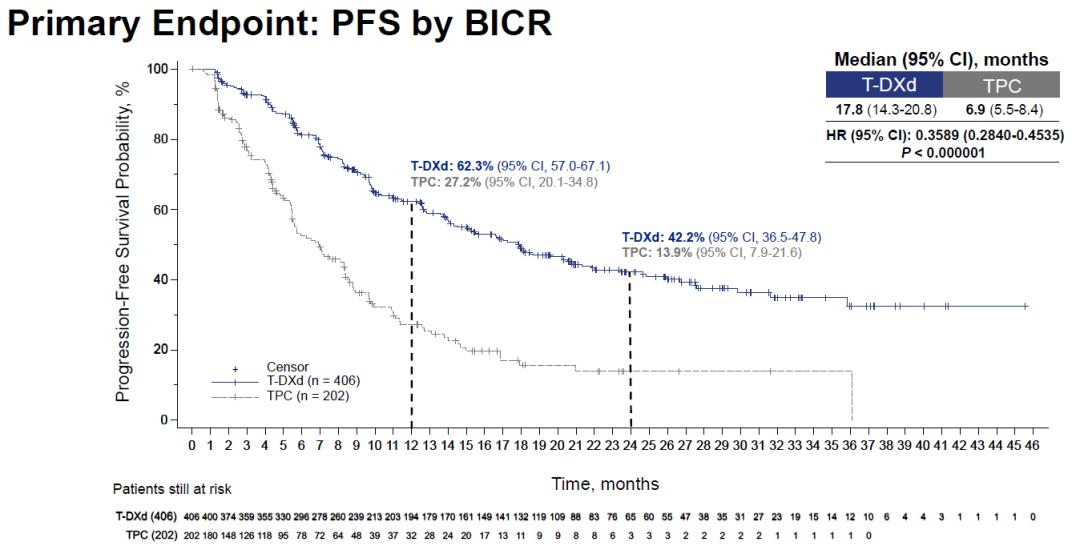
DB02研究的主要研究终点BICR PFS
关键次要终点OS方面,两组中位OS分别为39.2个月和26.5个月,T-DXd组相比TPC组显著延长12.7个月,降低患者死亡风险34%,差异达到统计学显著性。值得一提的是,TPC组在试验治疗发生进展后,有25.7%的患者在后续治疗中接受了T-DXd的治疗,这可能使两组的差异有所影响,在此情况下取得12.7个月的OS显著延长是压倒性优效的结果。
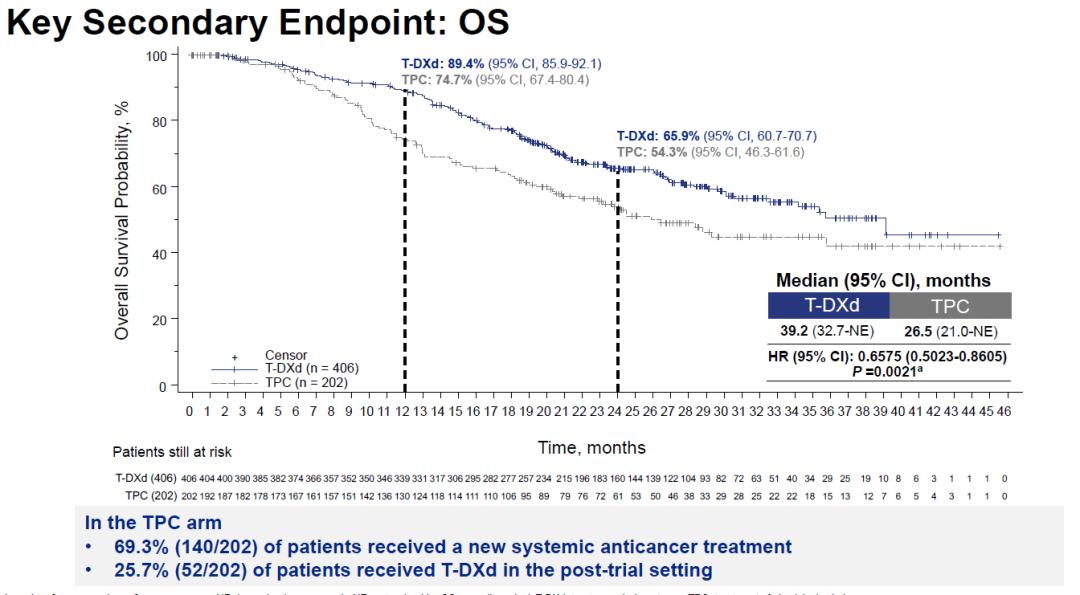
DB02研究的关键次要终点OS
其他次要终点和探索性终点方面,T-DXd组相比TPC组也都显示出优效性。T-DXd组的ORR和中位DoR均与DB01研究接近,为69.7%和19.6个月(DB01研究中为62%和20.8个月),而TPC组的ORR仅为29.2%。此外,为观察T-DXd治疗进展后后续用药的疗效,研究对PFS2也进行了分析,PFS2被定义为随机入组至第二次疾病进展的时间,可以看到T-DXd组的PFS2也显著长于TPC组(35.8 vs 15.8个月)。T-DXd治疗带来的PFS获益并未影响到后续治疗,并最终体现到OS的显著获益。
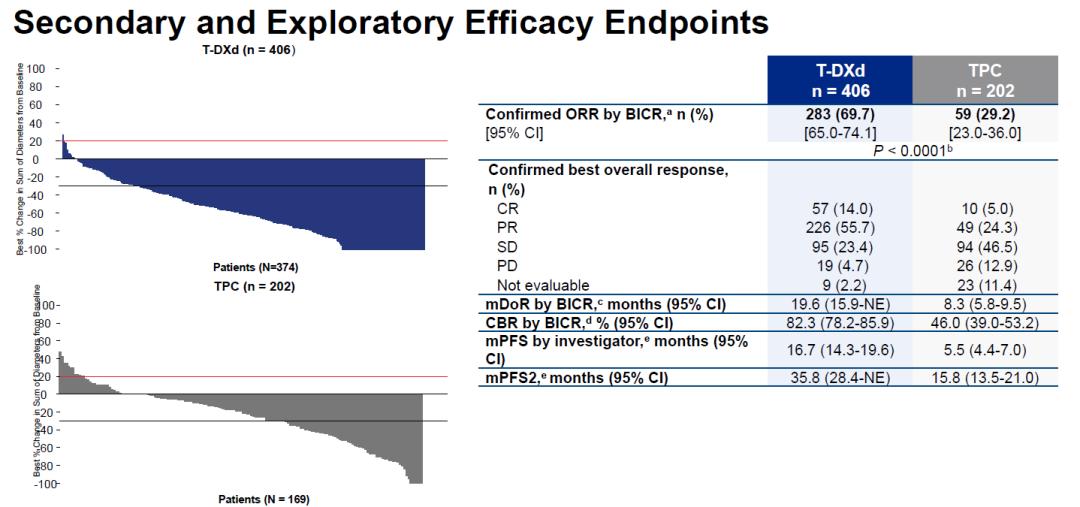
DB02研究的关键次要终点ORR以及探索性终点PFS2
在DB02研究中,T-DXd的安全性和既往研究基本一致,不良反应以1-2级的消化道、血液学以及乏力、脱发等一般性不良反应为主,TPC组以腹泻、恶心和手足综合征等为主。T-DXd组药物相关的间质性肺炎发生率为10.4%,绝大部分为1-2级,3-5级发生率为1.2%,与DB03和DB04研究基本一致。

DB02研究中ILD的发生率
因此,DB02研究重复出了DB01研究的疗效,在III期研究中验证了T-DXd作为三线及三线以上治疗方案的有效性,证明T-DXd相比曲妥珠单抗或拉帕替尼联合卡培他滨的优效性,可以显著延长PFS和OS。
DESTINY-Breast03
重塑二线治疗新标准,PFS和OS双突破
DB03研究的中期分析疗效数据此前就已经在2021年ESMO年会上进行过首次披露。当时DB03研究被选为ESMO的头号LBA,在全体大会环节第一个发布,来自西班牙的Javier Cortés教授作为PI作报告,泪洒现场以缅怀年初去世的导师José Baselga,认为该研究结果应该可以让被称为“肿瘤学界最后的大师”的Baselga教授感到欣慰。研究结果不负众望,T-DXd再一次刷新乳腺癌治疗领域的疗效数据,相比T-DM1降低疾病进展或死亡风险达到72%,两组差异P值达到10的负22次方,真正的前所未有。
DB03研究中期分析数据的全文也发表于《新英格兰医学杂志》,FDA基于大幅度的疗效获益授予T-DXd二线治疗的突破性疗法认证,并在2022年5月快速批准该适应症,同时ESMO、ABC6、NCCN和ASCO等国际权威指南也相继更新,推荐T-DXd 作为HER2阳性晚期乳腺癌的二线治疗的优选方案,从而替代T-DM1成为全球二线治疗新的标准。
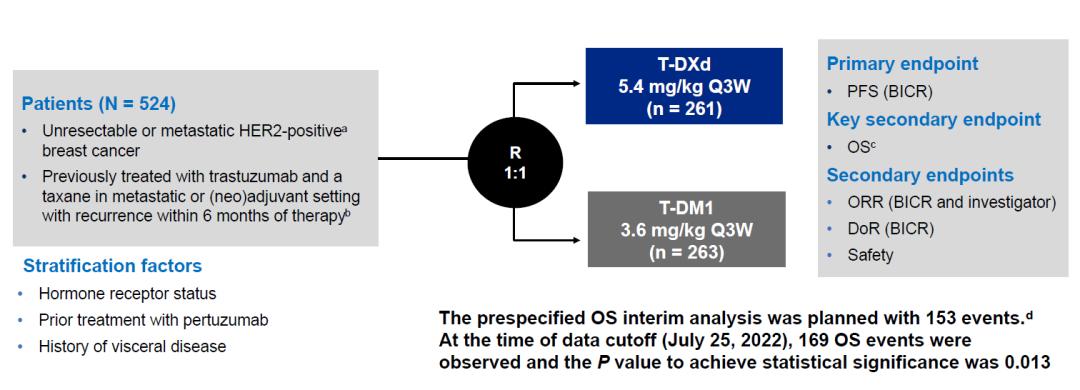
DB03研究的试验方案
DB03研究是一项全球多中心的开放性随机对照III期临床试验,首次头对头比较两个ADC药物的疗效,研究共入组524名患者,按照1:1随机分配至T-DXd组和T-DM1组接受相应药物治疗。主要的研究终点为BICR的PFS,关键次要研究终点为OS,其他次要研究终点包括ORR、DoR和安全性等。入组患者既往治疗的中位线数为二线,几乎100%的患者都接受过曲妥珠单抗和帕妥珠单抗的治疗。
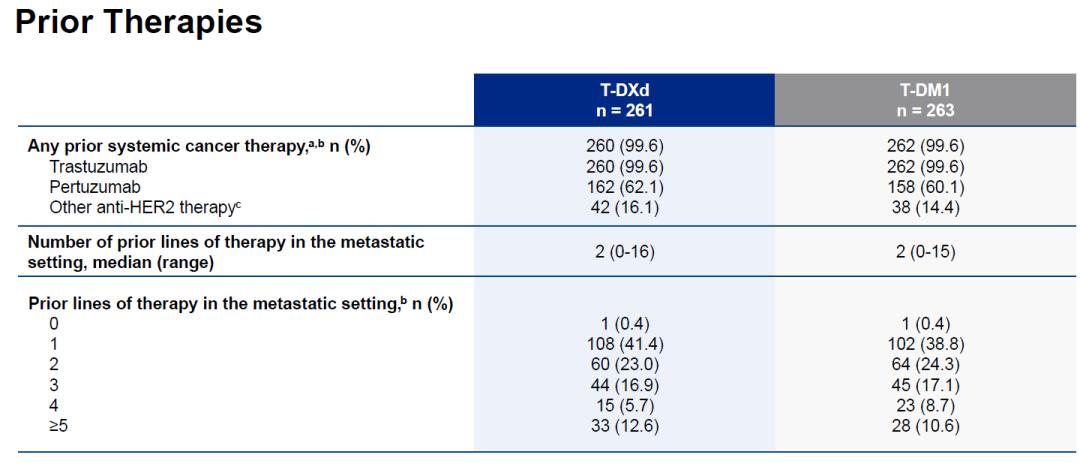
DB03研究入组患者的既往经治情况
2021年ESMO年会公布数据的截止日期为2021年5月20日,当时T-DXd组和T-DM1组中位随访时间分别为16.2和15.3个月,尽管研究的主要终点BICR PFS已经达到显著性差异,但彼时T-DXd组的中位PFS尚未达到。此次SABCS公布的更新数据,截止日期为2022年7月25日,两组的中位随访时间为28.4个月和26.5个月。这时,T-DXd组还有29.2%的患者仍在接受T-DXd治疗,T-DM1组仅6.9%的患者在继续接受T-DM1治疗。
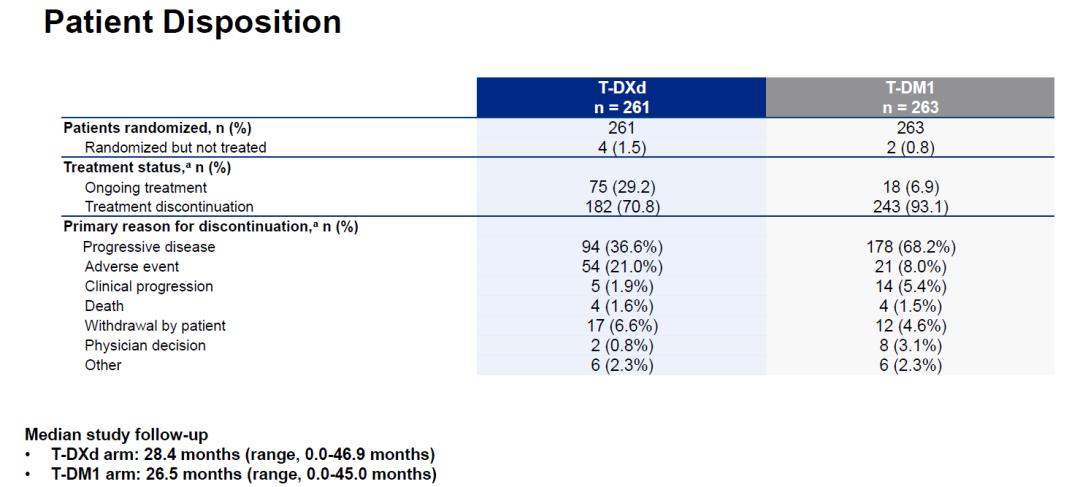
此次更新数据截止日期时
DB03研究中患者接受试验治疗的状况
更新的数据显示,DB03研究主要研究终点BICR PFS,T-DXd组中位PFS达到28.8个月,T-DM1组为6.8个月,T-DXd组是T-DM1组的4.2倍,延长达22个月之多。疾病进展或死亡风险下降67%。T-DXd再次刷新HER2阳性晚期乳腺癌治疗的PFS长度。
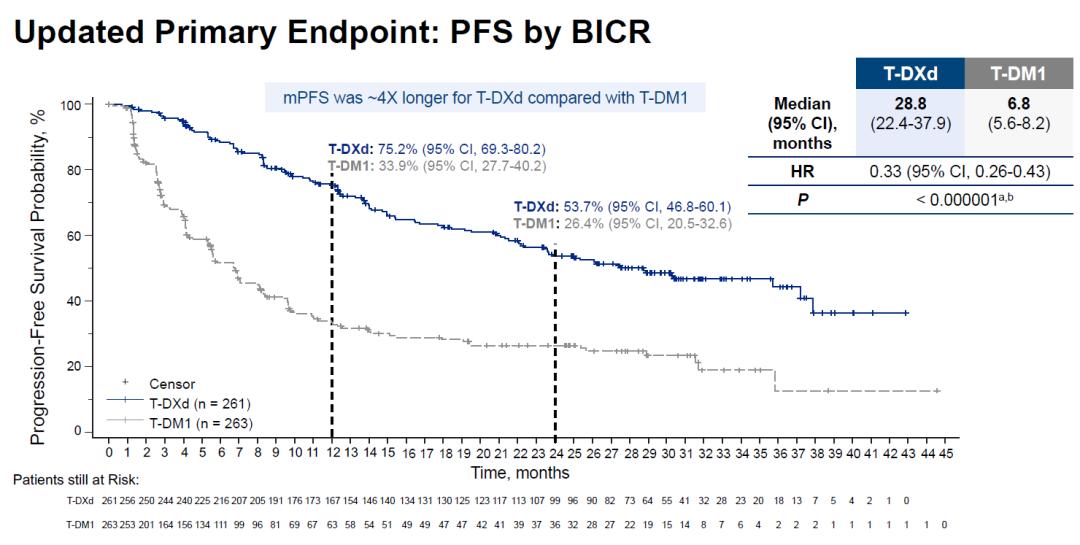
DB03研究主要终点 BICR PFS,T-DXd组是T-DM1组的4倍
同时,此次更新的数据显示,T-DXd组相比T-DM1组可显著延长OS,降低患者死亡风险36% [HR 0.64 (95% CI, 0.47-0.87), P=0.0037],达到统计学显著。由于随访时间较短,两组OS事件数均未过半(共观察到169例),两组中位OS均未达到。24个月的总生存率分别为77.4%和69.9%,绝对差异为7.5%。但从公布的总生存KM曲线来看,后续两组的差异可能会随着随访时间延长而越来越明显。
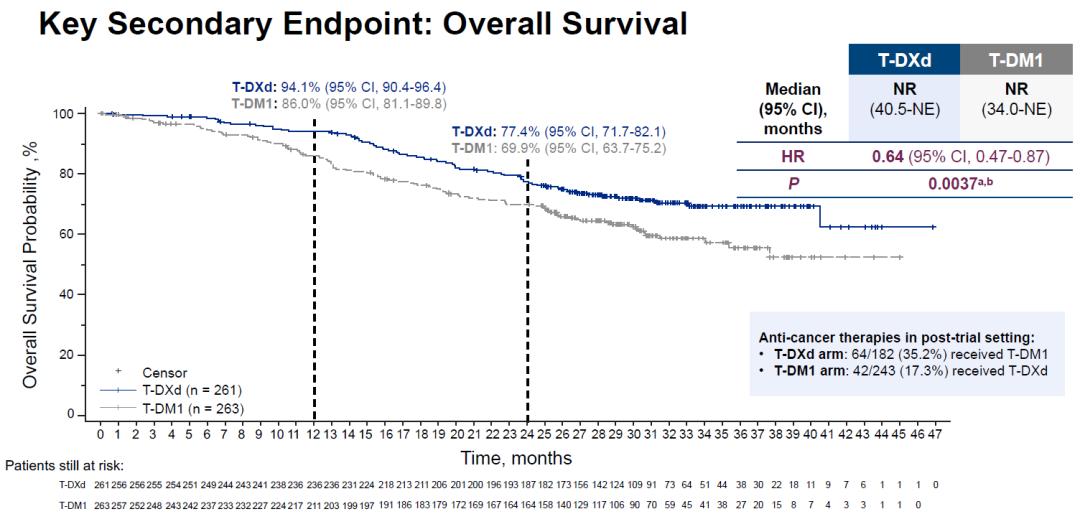
DB03研究的关键次要终点OS,T-DXd组相比T-DM1组显著延长
此外,现有数据显示两组后续治疗有交叉,T-DXd组后续治疗中有35.2%的患者接受了T-DM1治疗,而T-DM1组有17.3%的患者后续接受T-DXd治疗,这可能和不同国家地区两个药物的获批情况和可及性不同有关,T-DM1已在全球范围主要地区都已获批,而T-DXd在一些地区尚未获批(比如中国大陆)。
更新的ORR数据与此前报道基本一致,两组分别为78.5%和35%,其中T-DXd组的完全缓解率达到21.1%,超过1/5的患者达到RECIST1.1标准的肿瘤完全消失,而T-DXd的中位DoR达到36.6个月,这意味着有相当一部分患者可以获得深度缓解并可能长期维持疾病不进展。
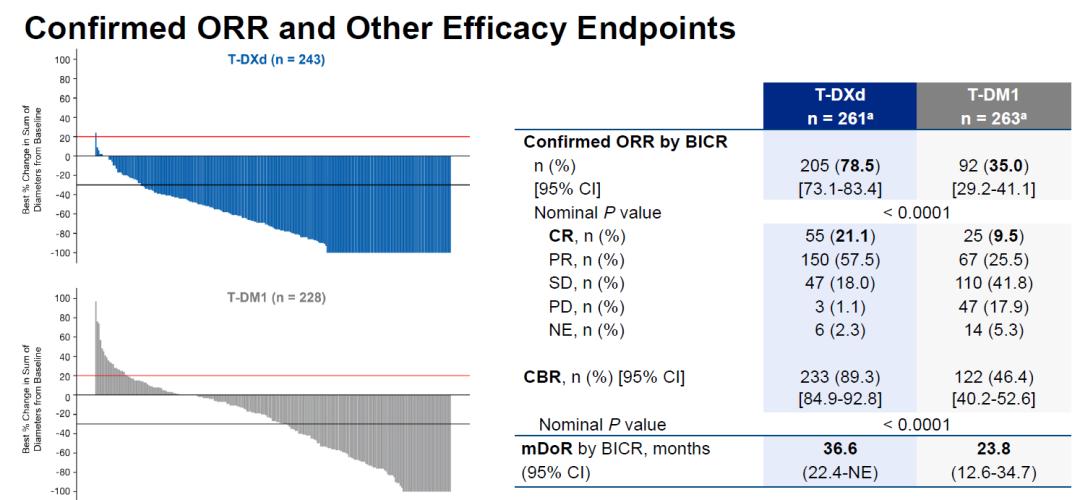
DB03研究更新的ORR和DoR等疗效数据
DB03研究此次也公布了研究中评估的中位PFS2,为40.5 vs 25.7个月,可以看出T-DXd组的PFS获益可以延续至后续治疗。在试验方案治疗发生疾病进展后,T-DXd组患者后续治疗以T-DM1(35.2%)、曲妥珠单抗(23.6%)和TKI(20.9%)为主,T-DM1组主要为曲妥珠单抗(37.0%)、TKI(35.8%)和T-DXd(17.3%),两组均有12-13%的患者接受内分泌治疗。
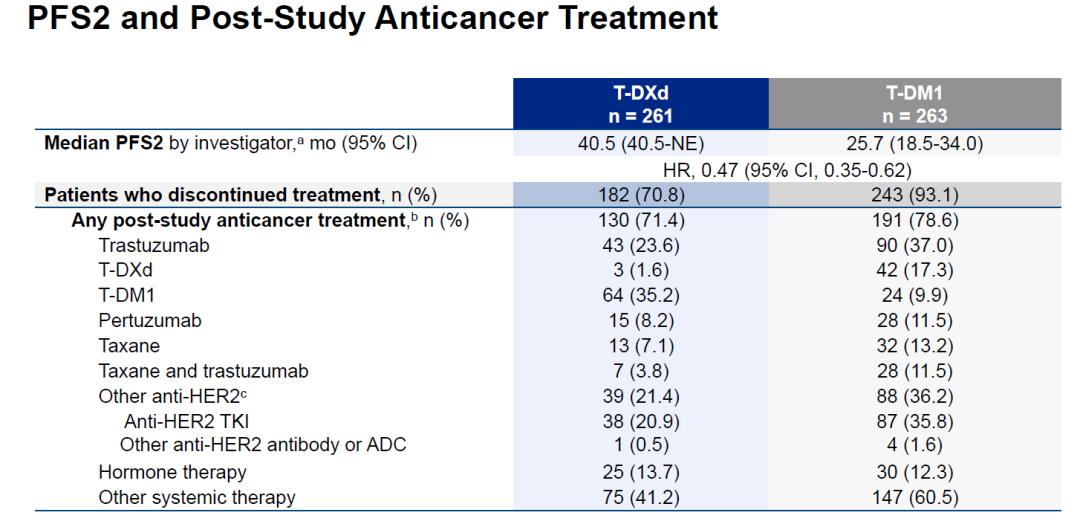
DB03研究中,接受T-DXd或T-DM1治疗发生疾病进展后的后续治疗以及PFS2
随着随访时间的延长,两组的安全性与此前数据基本一致,未出现新的不良反应。T-DXd组的常见不良反应仍旧是1-2级的消化道、血液学和乏力等一般性不良反应为主;两组的≥3级不良反应主要表现在血液学,其中T-DXd组为中性粒细胞下降比较明显,而T-DM1组为血小板下降更明显。
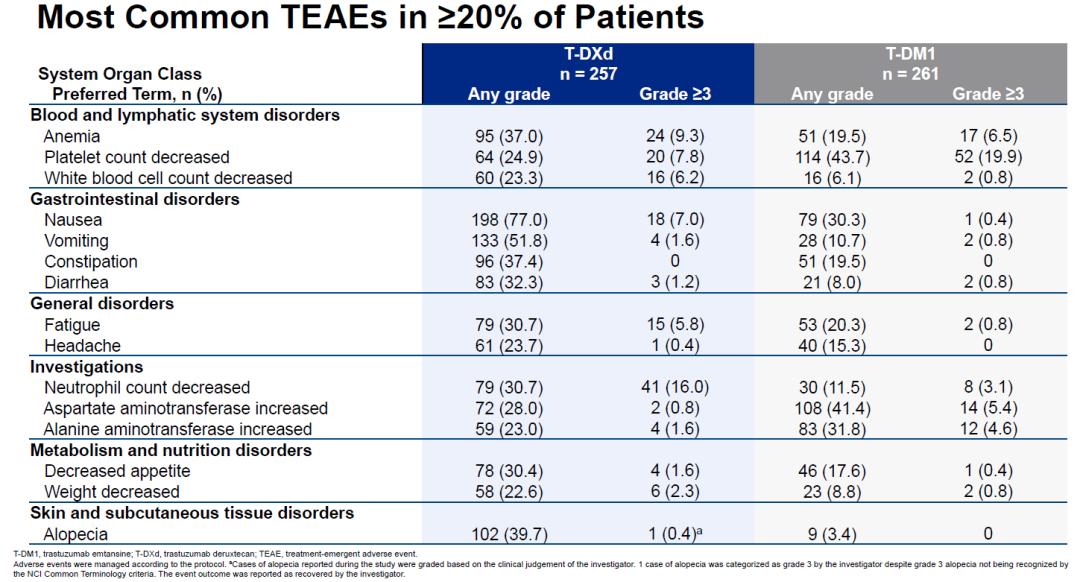
DB03研究中,两组最常见的治疗相关性不良反应(发生率≥20%)
此次DB03更新数据中,随着随访时间的延长,ILD的发生率由此前的10.5%增加至15.2%,但新增ILD事件中均为1-2级,仍然只有2位患者发生3级ILD(发生率为0.8%),没有4级或5级ILD事件发生。
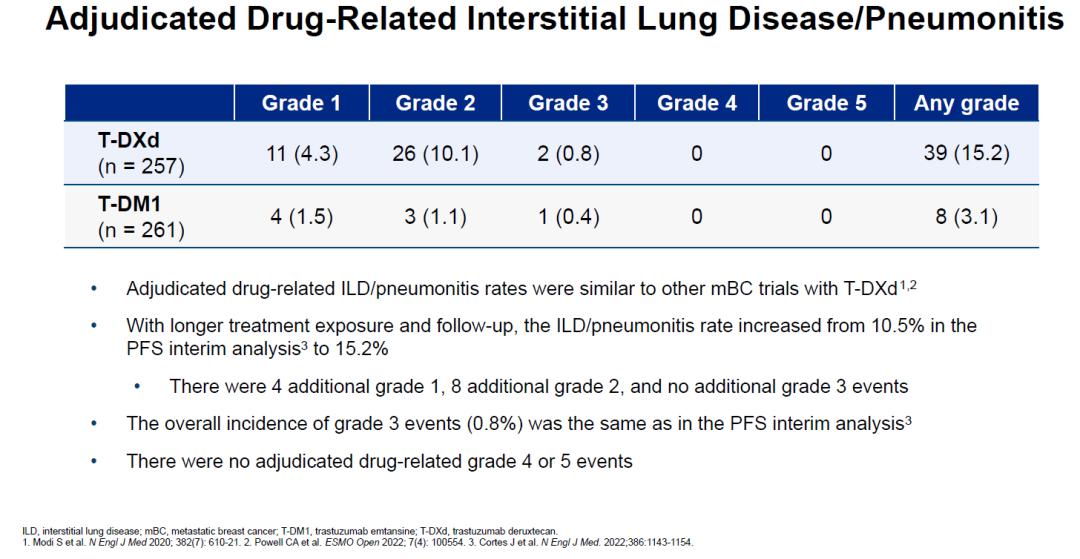
随访时间延长后的ILD发生率,3级以上未增加,无4-5级事件
DB03的更新数据不仅显示T-DXd在二线治疗的超长PFS(28.8个月),而且OS获益也已达到显著性,证明T-DXd不仅可以高效持久的控制疾病,而且可以带来总生存的获益。高达21%的患者达到CR,有极大潜力为这部分患者带来长期疾病缓解。同时,更长的随访时间进一步证明了T-DXd的安全性。
对临床治疗格局的影响和展望
T-DXd的DESTINY-Breast系列研究是当今抗肿瘤新药开发的一个缩影,尤其是在已有多款靶向药物的领域,新的药物从后线开始,一步步与前线的标准治疗方案头对头比较,逐渐前移改变治疗标准,树立新的治疗格局。这次公布的DB02和DB03丰富数据,填补了很多数据空白,可以解答多个关于T-DXd和HER2阳性晚期乳腺癌治疗新格局的问题。
T-DXd是当前二线治疗优选药物,中位PFS达到28.8个月,OS也获得显著延长
DB03研究T-DXd组的中位PFS达到28.8个月,远超当前的二线标准治疗方案,是T-DM1的4倍,毫无疑问会成为二线治疗的标准方案。此前首次公布DB03后,尽管各大指南都已更新推荐其作为二线治疗优选方案,但不少专家对T-DXd治疗后是否会影响后续抗HER2治疗有所疑虑,这次更新中T-DXd相比T-DM1的OS延长达到显著差异,证明了其对长期生存的获益。此外,PFS2的显著延长也显示T-DXd的PFS获益可以在后线治疗中延续,并未显著影响后续治疗药物的疗效。
对比DB02和DB03研究数据,支持T-DXd更早应用,疗效更佳
DB01数据公布后不久,FDA即批准了T-DXd用于HER2阳性晚期乳腺癌≥3线治疗的适应症,随后DB03发布数据后又批准其用于≥2线治疗。由于T-DXd在DB01的后线治疗中也取得19.4个月的PFS和62%的ORR,临床上有很多专家在思考T-DXd究竟应该用于二线还是留到后线使用。这次更新的数据显示,T-DXd用于二线治疗的中位PFS长达28.8个月,而DB02中用于三线治疗的中位PFS为17.8个月,ORR分别为78.5%和69.7%,2年的总生存率分别为77.4%和65.9%,可以看出T-DXd用于二线和三线治疗的疗效差异明显,二线疗效显著优于三线。从获得最佳疗效的角度,提供了T-DXd应该用于更早的二线而不是三线治疗的依据。
1/5患者达到RECIST1.1标准的完全缓解,T-DXd带来更多的NED(无病灶证据)状态
随访时间延长后,DB03更新数据显示T-DXd组有高达21.1%的患者达到肿瘤完全缓解,意味着超过1/5的患者在影像学上检测不到病灶。在CLEOPATRA研究中,双靶联合化疗的完全缓解率仅5.5%。尽管目前仍认为晚期乳腺癌不可治愈,但临床上有少部分患者接受治疗后可以长期保持NED(No evidence of disease,无病灶证据),达到类似于临床治愈的状态。近年来有不少回顾性研究,分析这部分患者的特征,其中接受抗HER2治疗获得完全缓解是可能获得长期肿瘤不复发的因素之一。T-DXd在二线取得21%的完全缓解率,并且表现出相当长的中位DoR(36.6个月),是否会为这部分患者带来NED状态的长期维持,后续的相关数据分析值得期待。如果数据积极,此后在一线治疗中的表现将让人充满希望,这部分患者也许可以被筛选出来以NED状态甚至临床治愈为目标。
关注T-DXd的不良反应管理,≥3级ILD可防可控
没有任何药物是完美药物,T-DXd毋庸置疑是当前乳腺癌治疗的巨大突破,但也有一些不良反应需要在临床应用中注意预防和管理。比如恶心呕吐是最常见的不良反应,NCCN指南将其归类为中度致吐风险药物,这需要在每个用药周期前采取5-HT3受体拮抗剂+地塞米松的两联方案进行预防。另外,ILD是T-DXd比较危险的不良反应,需要引起重视,在DB01研究中所有级别ILD的发生率为15.8%,DB02研究则为10.4%,DB03更新数据为15.2%;但≥3级ILD事件发生率,DB01研究为3.2%(5级事件2.7%),DB02研究为1.2%(5级事件0.5%),DB03则为0.8%(无5级事件发生)。三项研究所有级别ILD的发生率大体一致,但≥3级的严重事件发生率逐步下降,尤其是DB03中没有发生4-5级事件,这可能与更早线应用可降低严重程度有关,也可能与后续研究中ILD随访管理的意识提升有关。
T-DXd可能成为乳腺癌抗HER2治疗的Backbone,引领后续抗HER2药物的发展
最后,DB01、DB02和DB03这三项研究,一致性的表明T-DXd是一个高度有效的药物,作为新一代ADC药物相比现有治疗药物可大幅改善疗效,无论是ORR、PFS还是OS,均突破性的提升。随着这三项研究数据的出炉,晚期二线及二线以上可以确定T-DXd的最佳疗效地位,也为后续挑战一线和早期治疗标准树立信心。T-DXd突破性的疗效,为HER2阳性晚期乳腺癌的治疗树立了一个非常高的标准,新的药物可能很难超越。因此T-DXd很可能会成为乳腺癌抗HER2治疗的backbone,可以预见,此后一段时间内T-DXd一定程度上会代表抗HER2治疗的发展方向,一方面会有很多研究验证T-DXd在不同背景人群中的疗效,另一方面会出现很多以T-DXd为核心探索不同联合方案的试验。
*此文仅用于向医学人士提供科学信息,不代表本平台观点
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




