- +1
大脑如何区分不同的疼痛?胡理团队揭示疼痛分辨力稳定且特异的神经指标
原创 Cell Press CellPress细胞科学

医学
Medicine
近日,中国科学院心理健康重点实验室胡理研究组利用脑电和功能磁共振技术揭示了疼痛分辨力稳定且特异的神经指标。相关成果已在线发表于Cell Press细胞出版社期刊Cell Reports Medicine,题为“Selective and Replicable Neuroimaging-based Indicators of Pain Discriminability”。
疼痛是人类无法忽略的一个健康难题。对于个人而言,疼痛带来的无尽痛苦可能引发抑郁症乃至自杀[1,2];对于整个社会而言,慢性疼痛患病率高达20%~50%[3,4],每年给我国造成超过数千亿人民币的经济损失[5,6]。为了有效消除疼痛,深入理解疼痛的神经加工机制、开发疼痛的客观神经指标必不可少。以往研究发现,疼痛刺激可诱发N1、N2、P2等脑电响应,也可激活初级体感皮层(S1)、次级体感皮层(S2)、脑岛、前扣带回(ACC)、丘脑等脑区[7–10],这些脑响应也与疼痛强度存在正相关关系[11,12]。然而,进一步的研究发现,大多数疼痛诱发的脑响应都无法编码个体间的疼痛敏感性[11,13],且可被非痛的触觉、听觉、视觉刺激诱发[14,15]。这些发现意味着疼痛诱发脑响应不具有疼痛特异性,因而无法在临床应用中作为疼痛的特异性神经指标,客观量化疼痛,辅助镇痛药物开发。
为了解决这一问题,胡理研究员另辟蹊径,将疼痛敏感性区分为了绝对敏感性和差异敏感性两个层面。绝对疼痛敏感性描述了个体对相同疼痛刺激感知的差异,而差异疼痛敏感性(或称为疼痛分辨力)则代表了个体区分不同疼痛刺激的能力。绝大多数以往研究只探究了疼痛诱发脑响应和绝对疼痛敏感性的关系,而忽视了哪些神经响应能够反映差异疼痛敏感性——即便已有研究证实了差异疼痛敏感性和慢性疼痛有着密切关联[16,17]。为弥补这一不足,胡理研究员开展了一项脑电研究和一项功能磁共振研究,利用信号检测论量化了感觉分辨力,并考察了哪些神经指标反映了差异疼痛分辨力,还在五个大数据集中检验了这些神经指标的可重复性和疼痛特异性。
脑电研究纳入了三个大数据集(数据集1~3,总N = 366)。每个数据集都采用了相同的实验任务:向被试施加痛觉、触觉、听觉和视觉四种不同感觉模态的刺激,每种感觉模态均有高、低两种强度,最后要求被试对刺激做出0~10的主观强度评分。结果显示,在数据集1中,高强度疼痛刺激诱发的N1、N2和P2成分幅值大于低强度疼痛刺激诱发的幅值,而高、低强度疼痛刺激诱发N1、N2和P2幅值差异(高-低)与基于信号检测论的疼痛分辨力指标(AUC)存在显著相关(图1)。这一发现在数据集2和3中得到很好的重复。另一方面,虽然不同强度触觉、听觉、视觉刺激诱发的N2、P2幅值也存在差异,但高、低强度下的幅值差异(高-低)却与相应的触觉、听觉、视觉分辨力不存在稳定的相关关系(图2)。深入分析排除了可能的混淆因素:换用不同的分辨力指标(AUC、d′、高低刺激强度下的评分差异)、匹配不同模态间的主观评分差异、匹配不同模态的AUC指标均不改变主要结果,依然只有疼痛模态下的脑电响应与分辨力有稳定的相关关系。进一步的分析显示,利用疼痛诱发的脑电响应可以建立疼痛分辨力的机器学习预测模型,该模型可有效预测疼痛分辨力,但无法预测触觉、听觉和视觉分辨力。
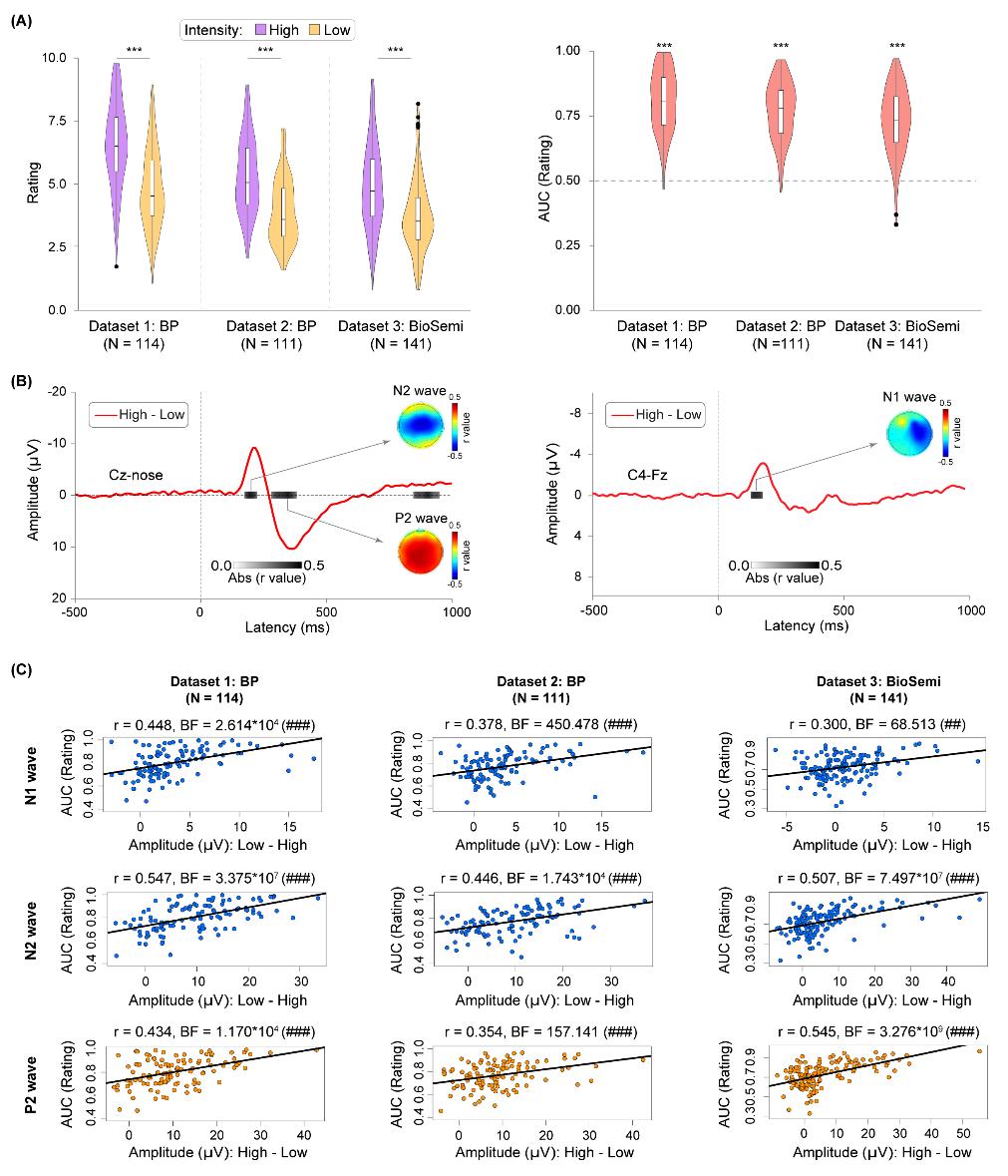
图1 疼痛诱发脑电响应与分辨力稳定相关
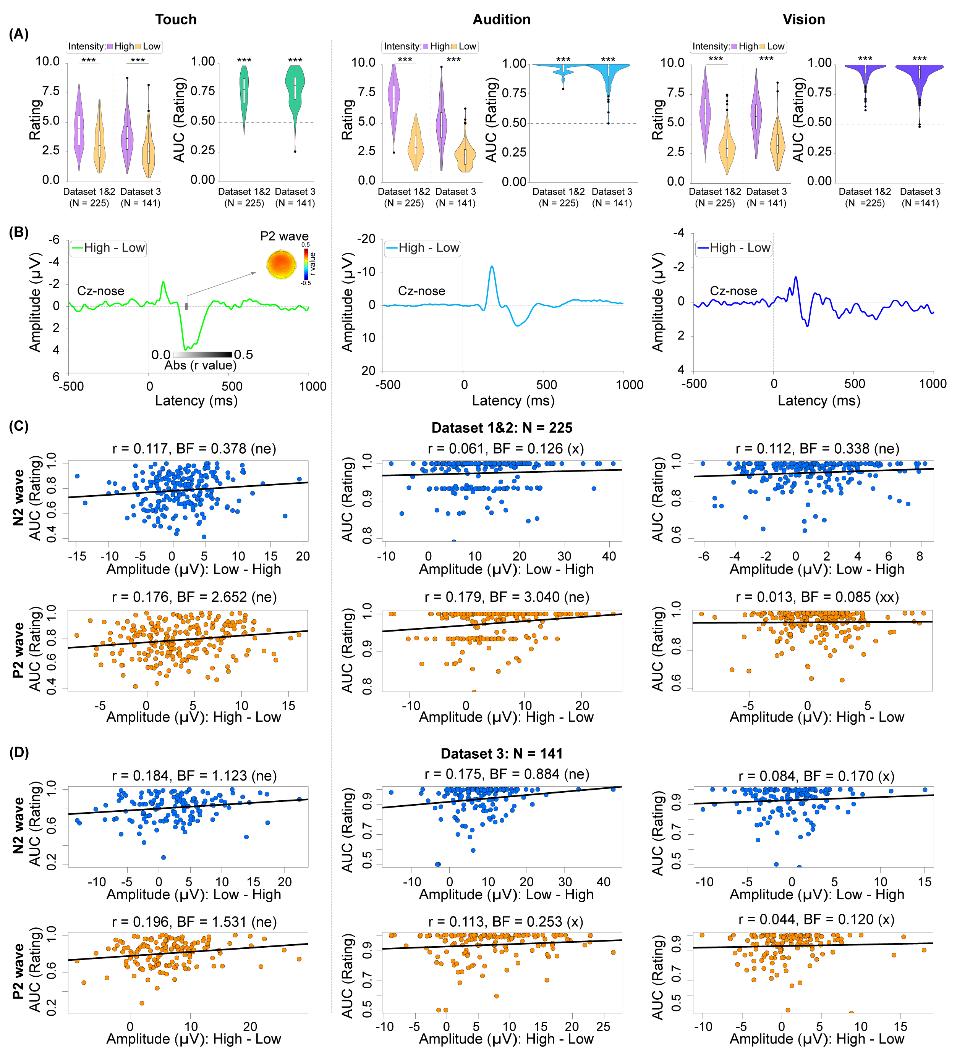
图2 非痛刺激诱发脑电响应与分辨力无稳定相关
功能磁共振研究得到了和脑电研究一致的结果。该研究包含两个大数据集(数据集4和5,总N = 399),试验任务也是要求被试者对不同模态、强度的感觉刺激做出主观评分。对数据集4的分析结果显示,S1、S2、脑岛、ACC、丘脑等一系列脑区在高强度疼痛刺激下的激活水平都高于低强度疼痛刺激下的激活,而且这些脑区在高、低强度下的激活差异(高-低)与疼痛分辨力存在显著相关(图3)。为评估这一结果的可重复性,胡理研究员以数据集4中S1、S2、脑岛、ACC、丘脑区域内与疼痛分辨力相关的体素为ROI,提取了数据集5中这些ROI内的脑激活,并与数据集5中的疼痛分辨力做相关分析。结果显示,S1、丘脑、脑岛、ACC内ROI的激活差异(高-低)与疼痛分辨力存在显著相关。与疼痛模态不同,虽然大量脑区在不同强度的触觉、听觉、视觉刺激下都存在激活差异,但却几乎没有体素与触觉、听觉和视觉分辨力有相关关系(图4)。换用不同的分辨力指标和匹配不同模态间的主观评分依然得到了一致的结果。可见,疼痛刺激诱发的脑区激活也可特异地反映疼痛分辨力。与脑电研究相同,以疼痛诱发脑区激活为特征的机器学习预测模型也可以有效预测疼痛分辨力,但不能预测触觉、听觉、视觉分辨力。
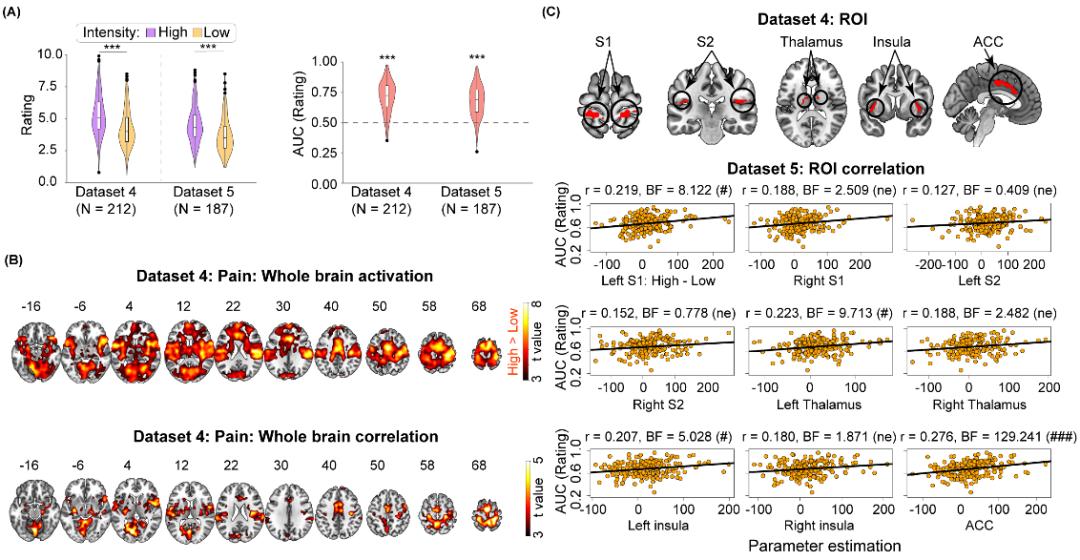
图3 疼痛诱发脑区激活与分辨力稳定相关
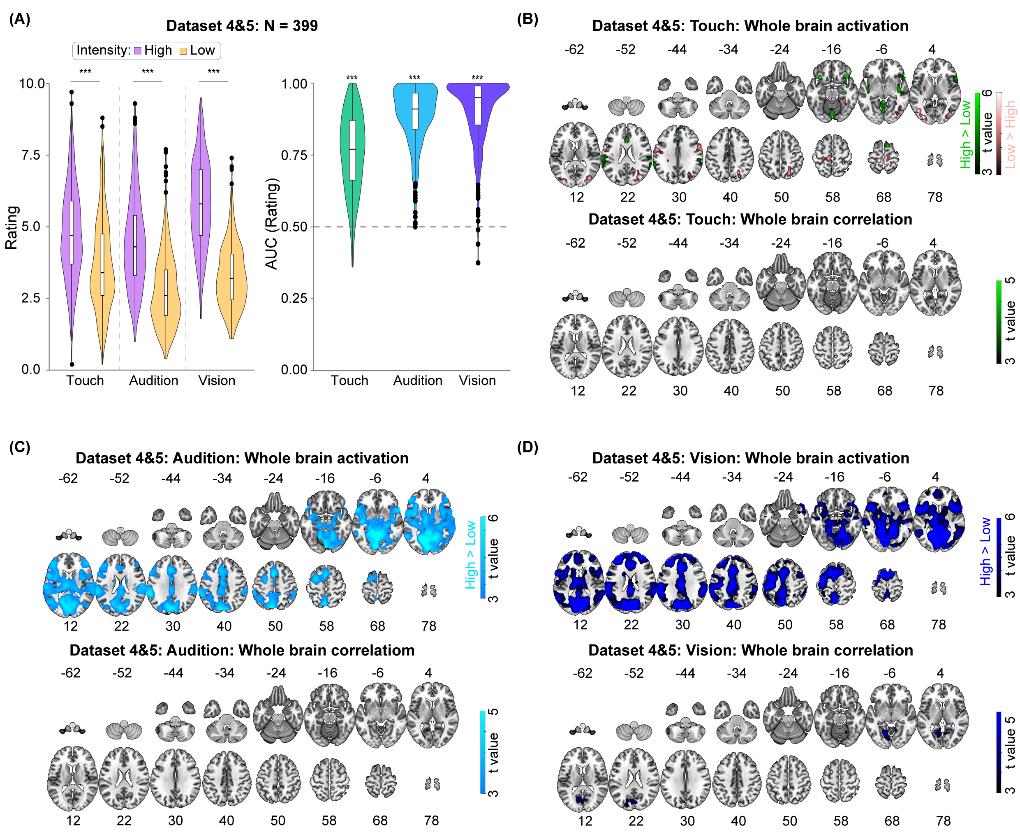
图4 非痛刺激诱发脑区激活与分辨力无稳定相关
以上发现揭示了疼痛分辨力稳定且特异的神经指标,为经典的疼痛诱发脑响应功能意义提供了新的解释,加深了人们对疼痛感知及其内在机制的理解。以往研究已证实,慢性疼痛病人的疼痛分辨力存在异常,且治疗前的疼痛分辨力可以预测慢性疼痛的预后情况[16,17]。因此,本研究揭示的疼痛分辨力神经指标也对临床实践中的慢性疼痛诊治和个体化疼痛评估提供了重要启示。
这项研究获得国家自然科学基金 (32071061、31822025、32171077)、北京市自然科学基金(JQ22018)、科技部科技创新2030-“脑科学与类脑研究”青年科学家项目(2022ZD0206400)、中国科学院心理研究所科学基金(E2CX4015)等的资助。
本文参考文献(可划动查看)
1. Bair, M. J., Robinson, R. L., Katon, W., & Kroenke, K. (2003). Depression and pain comorbidity: A literature review. Archives of Internal Medicine, 163(20), 2433–2445. https://doi.org/10.1001/archinte.163.20.2433
2. Ratcliffe, G. E., Enns, M. W., Belik, S.-L., & Sareen, J. (2008). Chronic pain conditions and suicidal ideation and suicide attempts: An epidemiologic perspective. The Clinical Journal of Pain, 24(3), 204. https://doi.org/10.1097/AJP.0b013e31815ca2a3
3. Chen, B., Li, L., Donovan, C., Gao, Y., Ali, G., Jiang, Y., Xu, T., Shan, G., & Sun, W. (2016). Prevalence and characteristics of chronic body pain in China: A national study. SpringerPlus, 5(1), 938. https://doi.org/10.1186/s40064-016-2581-y
4. Johannes, C. B., Le, T. K., Zhou, X., Johnston, J. A., & Dworkin, R. H. (2010). The prevalence of chronic pain in United States adults: Results of an internet-based survey. The Journal of Pain, 11(11), 1230–1239. https://doi.org/10.1016/j.jpain.2010.07.002
5. Yu, S., Liu, R., Zhao, G., Yang, X., Qiao, X., Feng, J., Fang, Y., Cao, X., He, M., & Steiner, T. (2011). The prevalence and burden of primary headaches in China: A population-based door-to-door survey. Headache: The Journal of Head and Face Pain, 52(4), 582–591. https://doi.org/10.1111/j.1526-4610.2011.02061.x
6. Zhang, F., Xiang, W., Li, C., & Li, S. (2016). Economic burden of irritable bowel syndrome in China. World Journal of Gastroenterology, 22(47), 10450–10460. https://doi.org/10.3748/wjg.v22.i47.10450
7. Bromm, B., Jahnke, M. T., & Treede, R.-D. (1984). Responses of human cutaneous afferents to CO2 laser stimuli causing pain. Experimental Brain Research, 55(1), 158–166.
8. Carmon, A., Mor, J., & Goldberg, J. (1976). Evoked cerebral responses to noxious thermal stimuli in humans. Experimental Brain Research, 25(1), 103–107. https://doi.org/10.1007/BF00237330
9. Jones, A. K. P., Brown, W. D., Friston, K. J., Qi, L. Y., & Frackowiak, R. S. J. (1991). Cortical and subcortical localization of response to pain in man using positron emission tomography. Proceedings of the Royal Society of London. Series B: Biological Sciences, 244(1309), 39–44. https://doi.org/10.1098/rspb.1991.0048
10. Talbot, J. D., Marrett, S., Evans, A. C., Meyer, E., Bushnell, M. C., & Duncan, G. H. (1991). Multiple Representations of Pain in Human Cerebral Cortex. Science, 251(4999), 1355–1358. https://doi.org/10.1126/science.2003220
11. Hu, L., & Iannetti, G. D. (2019). Neural indicators of perceptual variability of pain across species. Proceedings of the National Academy of Sciences, 116(5), 1782–1791. https://doi.org/10.1073/pnas.1812499116
12. Coghill, R. C., Sang, C. N., Maisog, J. Ma., & Iadarola, M. J. (1999). Pain Intensity Processing Within the Human Brain: A Bilateral, Distributed Mechanism. Journal of Neurophysiology, 82(4), 1934–1943. https://doi.org/10.1152/jn.1999.82.4.1934
13. Hoeppli, M. E., Nahman-Averbuch, H., Hinkle, W. A., Leon, E., Peugh, J., Lopez-Sola, M., King, C. D., Goldschneider, K. R., & Coghill, R. C. (2022). Dissociation between individual differences in self-reported pain intensity and underlying fMRI brain activation. Nature Communications, 13(1), Article 1. https://doi.org/10.1038/s41467-022-31039-3
14. Mouraux, A., & Iannetti, G. D. (2009). Nociceptive laser-evoked brain potentials do not reflect nociceptive-specific neural activity. Journal of Neurophysiology, 101(6), 3258–3269.
15. Mouraux, A., Diukova, A., Lee, M. C., Wise, R. G., & Iannetti, G. D. (2011). A multisensory investigation of the functional significance of the “pain matrix.” NeuroImage, 54(3), 2237–2249.
16. Naliboff, B. D., Cohen, M. J., Schandler, S. L., & Heinrich, R. L. (1981). Signal detection and threshold measures for chronic back pain patients, chronic illness patients, and cohort controls to radiant heat stimuli. Journal of Abnormal Psychology, 90(3), 271–274.
17. Malow, R. M., & Olson, R. E. (1981). Changes in pain perception after treatment for chronic pain. Pain, 11(1), 65–72. https://doi.org/10.1016/0304-3959(81)90139-1
作者专访
Cell Press细胞出版社公众号特别邀请胡理研究员代表研究团队接受了专访,请他为大家进一步详细解读。
CellPress:
为什么要研究疼痛的客观神经指标?
胡理研究员:
疼痛客观神经指标的研究基于两个根本原因:一是过度的疼痛有着极大的危害;二是有些情况下疼痛的主观报告不可信或难以获取。过度的疼痛对个人和社会都会造成很大的危害。从个体的角度看,过度疼痛可能导致抑郁乃至自杀。从社会的角度看,疼痛是一个无法忽略的公共卫生议题。据统计,我国有超过三亿的慢性疼痛患者,而疼痛造成的直接和间接经济损失每年都高达数千亿元。为此,对疼痛和镇痛的研究就必不可少的。由于疼痛是一种主观的体验,疼痛研究和临床实践上通常将疼痛体验者的主观疼痛报告作为衡量疼痛的黄金标准。但是,主观报告并不是任何时候都可靠的,也不是任何时候都能获得的。例如,不同人有着不同的主观疼痛报告风格。有的人倾向于报告比真实感受更低的疼痛,也有的人倾向于报告比真实感受更高的疼痛。另一方面,诸如婴儿、认知能力退化的老人、植物人等语言能力受损群体,无法提供主观疼痛报告。因此,在主观疼痛报告之外,开发基于神经响应的疼痛客观评估方法就非常必要。对疼痛感知高度敏感且特异的客观神经指标不仅有助于克服主观报告不可信或难以获取的缺陷,真实高效地测量个体的疼痛感知,还有利于理解疼痛信息加工的神经机制,进而辅助开发有效的镇痛靶点和镇痛方法,缓解疼痛患者的痛苦。
CellPress:
疼痛分辨力的神经指标研究有怎样的科学意义?
胡理研究员:
我们的发现有两方面的科学意义。一是揭示了疼痛分辨力稳定且特异的神经指标。不同个体甚至同一个体不同情况下的疼痛感知都有很大的变异性。大多数相关研究主要考察了哪些神经响应可以反映疼痛敏感性,即在神经层面上解释为什么同一个疼痛刺激会引发不同的疼痛感受。然而,疼痛感知能力的变异性还体现在另一个方面:不同个体区分两个或多个不同强度疼痛刺激能力的差异。这种区分能力(疼痛分辨力)和疼痛敏感性在理论上是相互独立的两个概念,但以往研究很少考虑疼痛分辨力的神经指标。我们研究的就是这种疼痛分辨力个体间差异的神经指标,并首次证明了这些神经指标的高度可重复性和疼痛特异性。第二个科学意义是为疼痛诱发神经响应的功能意义提供了新的解释。从上个世纪后半叶起,研究者就发现了疼痛刺激可以引起一系列稳定的脑电响应和脑区激活。不过,近十几年来的研究却发现,这些脑响应和疼痛的关系并不是特异的,它们也能被非痛的触觉、听觉、视觉等刺激所诱发。从疼痛分辨力这个新视角出发,我们的研究则显示,疼痛诱发脑响应能够特异地表征疼痛分辨力。这就为这些脑响应的功能意义提供了一种新的解释:它们虽然不反映疼痛敏感性,但反映疼痛分辨力。
CellPress:
发现的疼痛分辨力神经指标可以在临床上应用吗?
胡理研究员:
我们的研究主要是一项基础研究,得到的疼痛分辨力神经指标能在临床上得到多大的应用仍需要开展进一步的临床研究。不过,现有的研究结果和前人研究仍然支持了这些神经指标可能存在重要的临床应用价值。首先,我们发现的疼痛分辨力神经指标具有很好的可重复性和疼痛特异性,这为它们的临床应用打下了理论基础;其次,这些神经指标——如脑电上的N2、P2波——具有较好的信噪比,无需借助过于复杂的数据分析技术就能提取出来,因而实际应用起来也较为便捷;最后,一些早期研究显示,某些种类慢性疼痛的患者具有较差的疼痛分辨力,疼痛分辨力强的患者接收治疗的预后较好,而且治疗过程也伴随着疼痛分辨力的恢复,这意味着疼痛分辨力本身就可能和慢性疼痛存在很密切的关联。综合这些因素,我们认为疼痛分辨力的神经指标是存在潜在临床应用价值的,而且也适合开展应用。
CellPress:
下一步的研究会怎么开展?
胡理研究员:
我们希望接下来从基础研究和临床研究两个方面开展进一步的研究。从基础研究的角度看,现有的疼痛分辨力神经指标研究还很少,因此也有很多问题亟待解决。我们希望开展的研究包括:利用神经调控技术,深入考察已发现的神经指标和疼痛分辨力的因果关系;探究生理、心理、社会等因素如何影响疼痛分辨力和相应神经指标之间的关系;挖掘和疼痛分辨力相关的静息态脑活动或脑结构特征;等。
我们也希望未来能够开展临床试验,检验发现的疼痛分辨力神经指标的临床应用价值。前面已经谈到,我们发现的疼痛分辨力神经指标具有较好的临床应用前景,但它们的应用价值毕竟还是需要进行检验的。未来希望能够和医院开展合作研究,在临床实践中把发现的疼痛分辨力神经指标应用起来,最终缓解疼痛患者的病痛。

作者介绍

胡理
研究员
胡理,研究员,博士生导师,心理所重点支持的青年科技领军人才,中国科学院大学岗位教授, 伦敦大学学院名誉高级研究员,国家自然科学基金优秀青年科学基金获得者和北京市杰出青年科学基金获得者;曾获中国科学院朱李月华优秀教师奖、中国科学院教育教学成果奖二等奖、中国科学院大学领雁银奖(振翅奖)。相关研究成果发表在Cell Reports Medicine、Molecular Psychiatry、Trends in Neurosciences、PNAS、Nature Communications 和Journal of Neuroscience 等重要期刊。此外,主编EEG signal processing and feature extraction 、《脑电信号处理与特征提取》(入选中国科学院大学教材)、《疼痛认知神经科学》(受国家科学技术学术著作出版基金资助)等专著。
▌论文标题:
Selective and replicable neuroimaging-based indicators of pain discriminability
▌论文网址:
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(22)00410-4
▌DOI:
https://doi.org/10.1016/j.xcrm.2022.100846
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




