- +1
【学术前沿】血管新生新的调控机制:先锋模型:俞立团队报道单核细胞充当领路人,通过在其运行轨迹中放置…
胚胎发育过程中,各类复杂模式的精确调控依赖于大量信号分子的表达、分泌和时空调控【1】,尤其是血管系统,扩张的血管网络必须经常出芽、分支,以确保胚胎发育中的所有组织都能获得足够的血液供应,但同时,它们必须遵守严格的结构模式,以匹配特定的组织结构,肺脏和肾脏就是很好的例子,血流分支与肺泡或肾小管分布之间的匹配关系对其组织功能至关重要,但目前对机体如何实现对血管系统结构模式的特定形态调控知之甚少【2】。血管系统是在胚胎中发育的第一个功能器官, 对机体的营养供应、氧气供应等至关重要【3,4】。血管新生是在原来存在的血管结构上长出新血管的生物学过程,在生理(例如组织再生)和病理过程(例如肿瘤生长)中起着至关重要的作用,具有很高的临床相关性,是医学领域一直以来关注的热点。血管新生由一组血管新生蛋白驱动,包括血管新生生长因子、趋化因子和细胞外基质蛋白,其中促血管新生因子(VEGF)是血管新生的关键调节因子【5-7】。传统认为这些因子通常由发育中的血管附近的细胞通过自分泌或旁分泌,与胞外基质相互结合,从而保持较高的局部浓度,形成利于血管新生的微环境,继而激活一系列信号通路,使得血管胞外基质降解,内皮细胞出芽、增殖、迁移、成管,新基底膜的形成、周皮细胞的招募、管状结构之间的吻合、血流形成,至此,形成新的血管【8】。由上可知,血管新生因子浓度梯度的建立是促发血管新生的关键,也是使得新生的血管网络得以匹配对应组织结构模式的关键。但目前对于如何形成并有效维持这样一个浓度梯度、如何实现这些信号分子的时空组合调控,知之甚少。
迁移体(migrasome)是清华大学俞立实验室发现并命名,于2014年10月在Cell Research在线发表的一种新型细胞器【9】。细胞迁移时,许多称为收缩丝的结构从细胞的后缘拉出,名为迁移体的大囊泡生长在收缩丝上。迁移体与收缩丝相连,并包含许多腔内囊泡,这使迁移体具有特征性的形态特征。迁移体的形成依赖于四次跨膜蛋白tetraspanin(TSPAN4),这些蛋白质形成富含tetraspanin的微结构域,然后组装成迁移体。最近的研究报道整合素在迁移体底部高度富集,并通过与细胞外基质配对影响迁移体产生【10】。TSPAN4与胆固醇在收缩丝上聚集成微米级的宏结构域TEMA,从而介导了迁移体的形成【11】。功能方面,迁移体含有mRNA和蛋白质,可以横向转移到受体细胞中并发挥功能,继而在功能上改变受体细胞【12】,因此,迁移体被认为是细胞间交流通讯的细胞器。在斑马鱼中,迁移体在原肠胚形成过程中形成,并通过建立区域性信号梯度而影响器官形态发生【13】。最近一篇报道显示:细胞通过迁移体将受损线粒体释放出去,作为一种全新的线粒体质量控制机制,参与调控细胞内线粒体的稳态维持(Cell亮点 | 俞立团队发现一种全新的线粒体质量控制机制-Mitocytosis)。这项工作也第一次揭示了migrasome的细胞自主性的功能【14】。
2022年11月28日,俞立(中国细胞生物学学会细胞器生物学分会会长)教授团队在Nature Cell Biology上发表文章Monocytes deposit migrasomes to promote embryonic angiogenesis,在这项研究中,研究者观察到鸡胚绒毛尿囊膜(CAM)上存在一群高度迁移的细胞,并大量形成迁移体(图一)。通过单细胞测序和抗体染色,发现这群高度迁移的细胞是单核细胞。去除单核细胞导致毛细血管形成受损,这表明这些细胞在血管新生中起重要作用。进一步的机制研究表明单核细胞产生的迁移体能够在体内、外模型中诱导血管新生。在鸡胚绒毛尿囊膜中敲低或敲除TSPAN4可阻断单核细胞迁移体的形成, 并导致毛细血管新生的抑制。有意思的是,单核细胞产生的迁移体可以在体外和体内募集单核细胞,敲低或敲除TSPAN4显著减少了毛细血管形成区域中的单核细胞数量。研究者进一步发现迁移体促进血管新生的机制是迁移体高度富集VEGFA和CXCL12。迁移体分别通过释放CXCL12和VEGFA来募集单核细胞和促进血管新生。

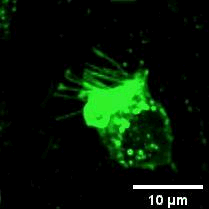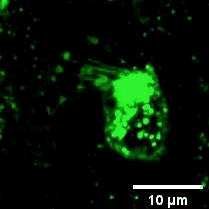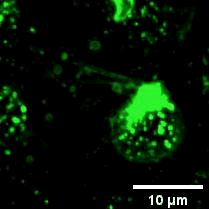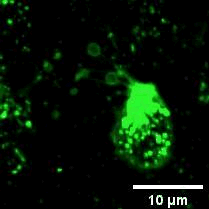
图一:CAM单核细胞迁移时产生迁移体。
众所周知,VEGF特定梯度分布和浓度分布实现对血管形态模式的调控,而其特定浓度梯度的形成,除了高度本地化的基因表达模式外,还依赖于对糖胺聚糖肝素(glycosaminoglycan heparin)的高亲和力,结合肝素的能力被认为是VEGF等这些分泌分子沉积在细胞外基质或细胞表面能力的体现【15】。而本文这项工作显示迁移体以一种全新机制产生了VEGF信号模式和信号梯度。使用迁移体作为信号源来指导血管新生具有多种优势。首先,迁移体为VEGF等血管新生因子提供了一个有时空特异性的信号载体,从而创造出一个由单核细胞迁移路径决定的信号结构模式。其次,多种不同种类的血管新生因子可以包装到同一个迁移体中。这些因素可能通过不同血管生长因子之间的同步释放,确保血管新生不同调节机制的空间和时间协调。最后,从迁移体释放血管新生因子需要迁移体破裂或渗漏。这会产生延迟效应,并提供更多机会来微调信号模式的形成。该项工作强调了单核细胞在胚胎发育过程中血管新生中的重要性。基于这些发现,作者提出了血管新生的“先锋”模型,其中单核细胞作为先行者和领路人,通过沉积富含血管新生因子的迁移体,在毛细血管形成之前为血管新生准备有利的微环境(图二,图三)。

图二:In vivo水平,单核细胞引导血管新生方向和路径(黄色:血管;蓝色:单核细胞;红色:单核细胞运行轨迹)。

图三:单核细胞作为血管新生“先锋模型”的模式图。
这项工作首次报告了单核细胞在鸡胚绒毛尿囊膜(CAM)上作为designer规划路径,在其迁移轨迹上沉积大量富含促血管新生因子的迁移体,建立了血管新生因子VEGF等的浓度梯度,并实现时空调控,进而促进CAM的血管新生和毛细血管网的建立。单核细胞作为血管新生领路人和路径规划者的这一“先锋模型”为生命过程中信号模式的形成机制提供了全新的思路。
清华大学生命科学学院俞立教授为该论文的通讯作者。博士后张翠芳为该论文的第一作者。
原文链接:
https://doi.org/10.1038/s41556-022-01026-3
参考文献
1. Lawrence, P.A. & Struhl, G. Morphogens, compartments, and pattern: lessons from drosophila? Cell 85, 951-961 (1996).
2. Ruhrberg, C. et al. Spatially restricted patterning cues provided by heparin-binding VEGF-A control blood vessel branching morphogenesis. Genes Dev 16, 2684-2698 (2002).
3. Chung, A.S. & Ferrara, N. Developmental and pathological angiogenesis. Annu Rev Cell Dev Biol 27, 563-584 (2011).
4. Majesky, M.W. Vascular Development. Arterioscler Thromb Vasc Biol 38, e17-e24 (2018).
5. Distler, J.H. et al. Angiogenic and angiostatic factors in the molecular control of angiogenesis. Q J Nucl Med 47, 149-161 (2003).
6. Karamysheva, A.F. Mechanisms of angiogenesis. Biochemistry (Mosc) 73, 751-762 (2008).
7. Risau, W. & Flamme, I. Vasculogenesis. Annu Rev Cell Dev Biol 11, 73-91 (1995).
8. Vempati, P., Popel, A.S. & Mac Gabhann, F. Extracellular regulation of VEGF: isoforms, proteolysis, and vascular patterning. Cytokine Growth Factor Rev 25, 1-19 (2014).
9. Ma, L. et al. Discovery of the migrasome, an organelle mediating release of cytoplasmic contents during cell migration. Cell Res 25, 24-38 (2015).
10. Wu, D. et al. Pairing of integrins with ECM proteins determines migrasome formation. Cell Res 27, 1397-1400 (2017).
11. Huang, Y. et al. Migrasome formation is mediated by assembly of micron-scale tetraspanin macrodomains. Nat Cell Biol 21, 991-1002 (2019).
12. Zhu, M. et al. Lateral transfer of mRNA and protein by migrasomes modifies the recipient cells. Cell Res 31, 237-240 (2021).
13. Jiang, D. et al. Migrasomes provide regional cues for organ morphogenesis during zebrafish gastrulation. Nat Cell Biol 21, 966-977 (2019).
14. Jiao, H. et al. Mitocytosis, a migrasome-mediated mitochondrial quality-control process. Cell 184, 2896-2910 e2813 (2021).
15. Esko, J.D. & Lindahl, U. Molecular diversity of heparan sulfate. J Clin Invest 108, 169-173 (2001).
(可上下滑动阅览)
原标题:《【学术前沿】血管新生新的调控机制:先锋模型:俞立团队报道单核细胞充当领路人,通过在其运行轨迹中放置迁移体引导和促进鸡胚血管新生》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




