- +1
刘泉课题组:神经-上皮-ILC2交互网络与屏障组织微环境稳态
原创 Cell Press CellPress细胞科学

生命科学
Life science
屏障组织(如皮肤、呼吸道及消化道等)是机体抵御外界侵扰的第一道防线,是哺乳动物维护自身完整性的关键结构组织。而当屏障组织受到损伤时,炎症通过清除病原体、促进组织修复来维持屏障组织的稳态。2型固有免疫淋巴样细胞(ILC2)在这个过程中发挥独特且核心功能:整合上皮信号(如IL-33、IL-25、TSLP等)和神经信号(神经递质与神经肽),从而调节组织微环境和炎症进程。来自南方科技大学医学院的刘泉副教授团队在Cell Press细胞出版社旗下Trends in Immunology期刊发表综述,全面系统地回顾了免疫学前沿领域上皮-免疫、神经-免疫相互作用的研究成果;重点探讨了屏障组织疾病时,2型固有淋巴细胞(2 innate lymphoid cells,ILC2)在上述相互作用中发挥的核心作用;进而提出了神经-上皮-ILC2交互单位的新概念。
诱导炎症以回归稳态:ILC2的核心地位
在局部组织微环境中,稳态维持受到由感应器、信号分子与效应器组成的环路调控。在传统观点中,炎症是一种“有害的”病理反应,而正是这种看似有害的反应能够发挥清除病原体或促进组织损伤修复的重要作用。在哺乳动物的屏障组织中存在两大类重要细胞:基础上皮细胞与支持细胞(如免疫细胞、神经细胞或微生物群落),二者之间的相互协作对激发炎症、维持稳态至关重要。在应激条件下,上皮细胞释放相应的上皮细胞因子(包括IL-33,IL-25及TSLP)作为信号,启动相应的免疫反应;而在外界刺激下产生的神经信号不仅能够对免疫反应发挥调节作用,亦可直接作用于上皮细胞。这些基于神经-免疫、上皮-免疫、神经-上皮相互作用的研究,为神经-上皮-免疫三者之间的关系织成了一张大网。
ILC2在这样一个网络中发挥了至关重要的作用。ILC2在屏障组织中有着广泛的分布,而与ILC家族其他成员相比,ILC2不仅能够调节炎症、促进组织修复,还能够同时接收来自神经和上皮的信号——因此ILC2能够在屏障组织神经-上皮-免疫交互网络中发挥整合信息的核心作用。
ILC2在皮肤稳态中的作用
作为抵抗外界刺激的物理和生物屏障,皮肤由表皮、真皮和皮下组织组成。目前,结合单细胞RNA测序数据对小鼠ILC家族在皮肤上空间分布差异性进行分析,提示ILC2主要分布在IL-7丰度较高的皮下组织中。作为人体最大的器官,皮肤接收来自背根神经节(DRG)和三叉神经节神经纤维的广泛分布,这无疑为其神经-上皮-免疫网络提供了解剖基础。
尽管在传统的认知中,由上皮信号因子所激发的2型免疫反应是特应性皮炎发病的主要机制,但神经-上皮-免疫互作失调仍然是重要的致病因素。小鼠TRPV1+受体能够直接接收炎症信号因子刺激以产生神经信号,而人类和小鼠组织中分离的DRG均表达IL-33受体,且IL-33能够直接刺激DRG神经元——这是皮肤干痒的发生机制之一。此外,角质细胞释放的TSLP也能够直接刺激TRPA1+的神经元以产生痒觉。上述研究为皮肤中的神经-上皮相互作用提供有力支撑,而TRPV1–Ai32光遗传学小鼠模型则提示纯神经信号(不依赖于上皮细胞的警报作用)也能够通过释放神经肽如CGRP以激活免疫反应,以清除病原体。CD301b+ 树突状细胞(DC)迁移受到皮肤中TRPV1+神经元调控,而Langerhans细胞通过MRGPRD+神经元来影响皮肤中的肥大细胞脱颗粒;GINIP+ C神经纤维释放TAFA4以维持CD206+TIM4+巨噬细胞的数量并促进其产生IL-10。目前针对皮肤中神经-免疫-上皮相互作用的研究主要以T细胞、DC、Langerhans细胞等细胞类群为中心,尚未见神经-ILC2二者间的相互作用研究。ILC2是否能够发挥整合上述细胞功能,并发挥其在皮肤中接收上皮信号及神经信号的核心功能有待进一步探究。
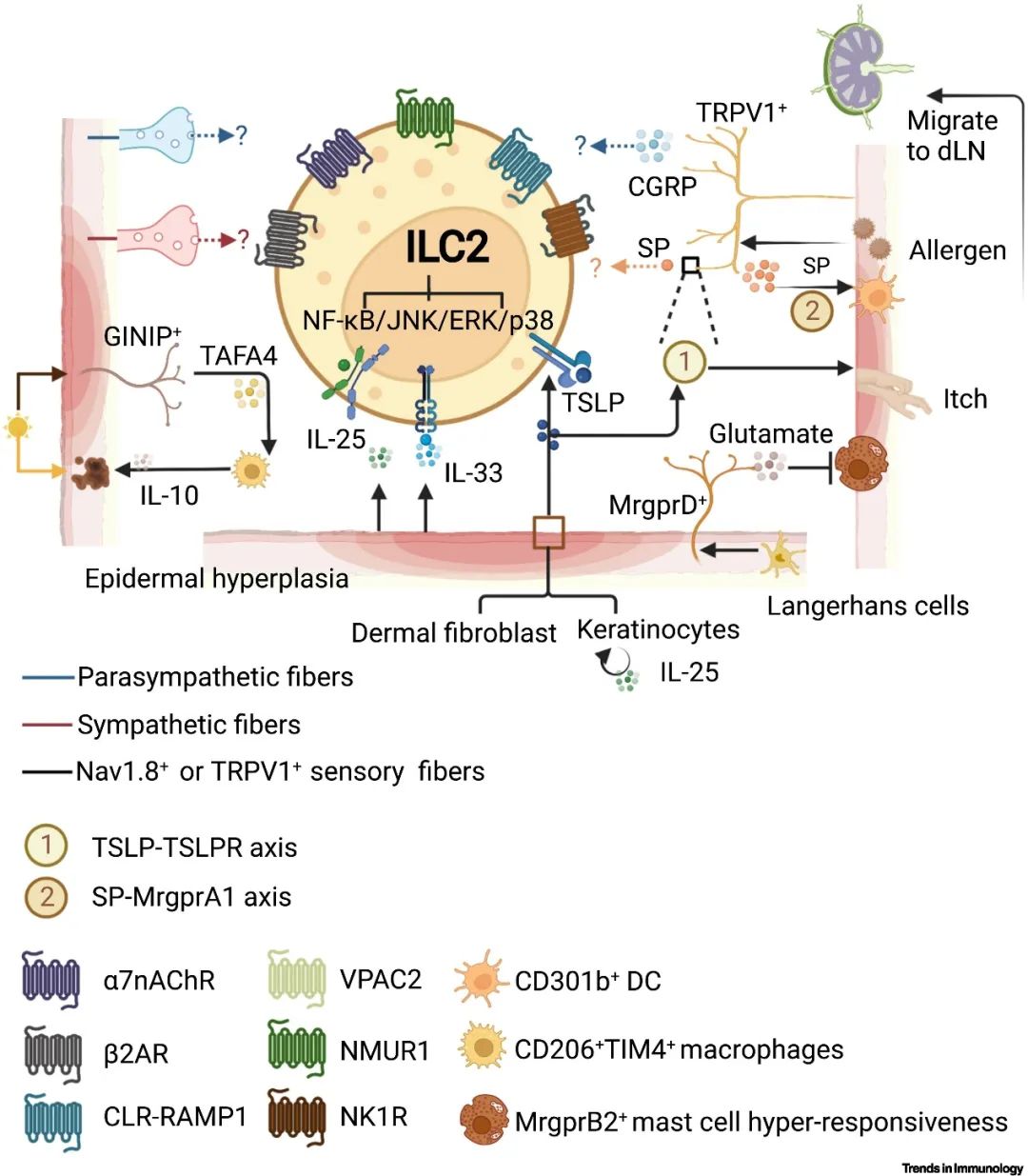
▲图1: 小鼠神经-上皮-ILC2网络对皮肤稳态和炎症的调节
呼吸系统中的神经-上皮-ILC2单元
呼吸系统是针对环境毒素和病原体防御的重要屏障,其功能的实现不仅依赖于物理结构,更需要呼吸道免疫系统、定植微生物群落与相关的神经纤维。在解剖学上,有三种部的神经纤维分布于肺:交感神经、副交感神经,以及来自迷走神经节(或结神经节)和胸腔DRG的感觉纤维。肺部病理反应受到神经调节的作用在小鼠呼吸机诱导的肺损伤模型中已有报道:双侧迷走神经切断术能够加剧组织损伤,而semapimod药物刺激、迷走神经电刺激,直接激活α7乙酰胆碱受体(α7nAChR)均可减轻肺损伤。除了这三种类型的神经外,肺神经内分泌细胞(PNEC)是呼吸道中一类特殊细胞群,在空间上与ILC2接近并可分泌如CGRP等神经肽;PNEC的清除能够诱发哮喘样反应,该反应能够被经气管给予CGRP后缓解。神经-上皮-ILC2单元在呼吸道相关疾病,尤其是肺损伤和哮喘中发挥重要作用。其中,ILC2受ACh-α7nAChR轴的负向调控——乙酰胆碱通过该受体能够减缓由ILC2引发的气道高反应性,但另一类M型AChR能够直接激活ILC2,从而对维持稳态发挥重要作用。
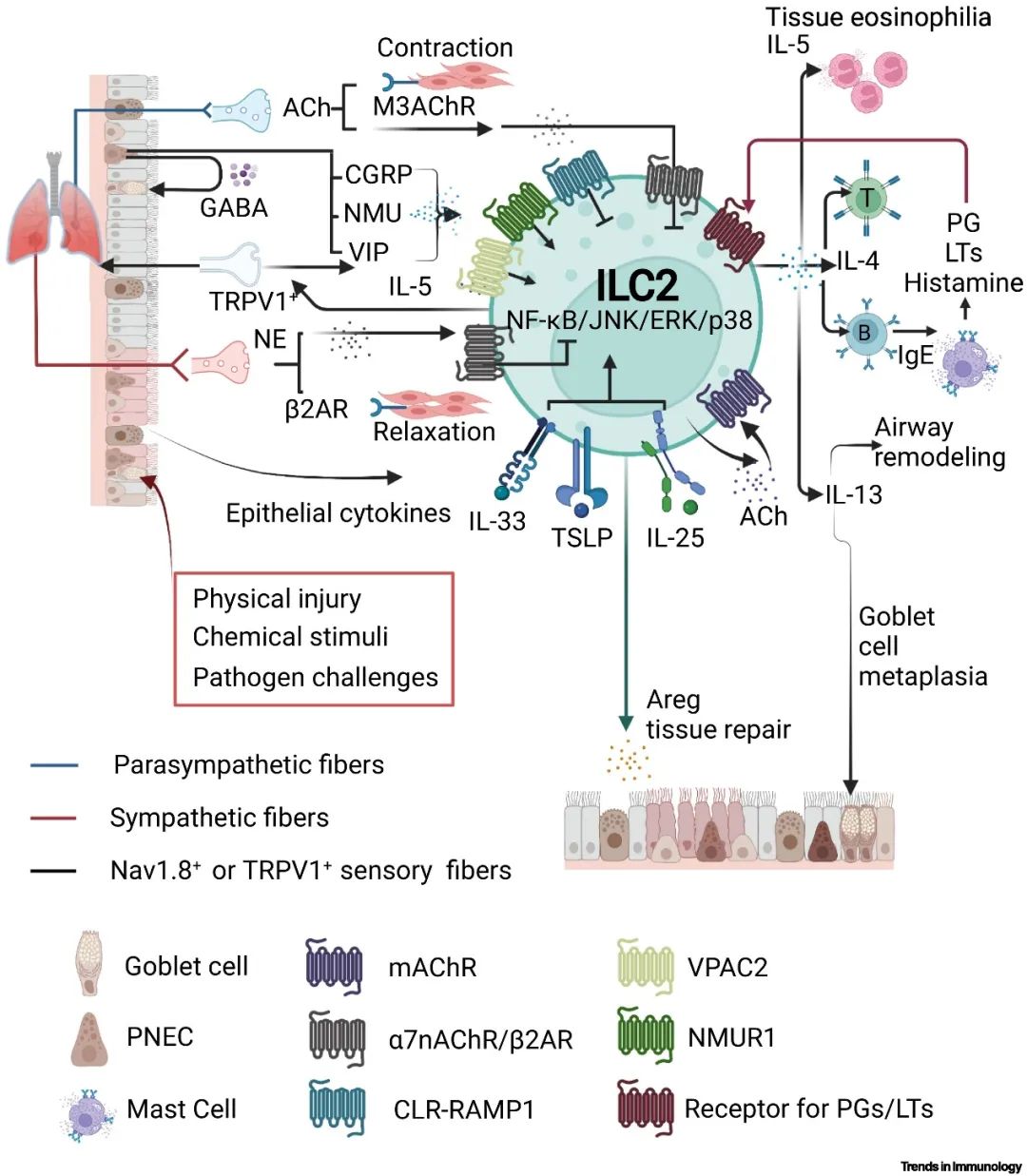
▲图2: 人和小鼠呼吸道ILC2通过整合上皮与神经信号维持呼吸道稳态
神经肽如NMU、CGRP和NMB等均能作为调控ILC2从而影响肺内微环境稳态的重要神经信号,并影响由上皮信号因子介导的免疫反应——肺内DRG神经元是NMU的主要来源,体内和体外实验均已证实NMU-NMUR轴能够激活ILC2从而释放2型细胞因子,且IL-25与NMU能够协同激活ILC2。另一类神经纤维以Nav1.8+、TRPV1+ 和/或 TRPA1+ 痛觉感受器为代表,能够释放血管活性肠肽、P物质和CGRP以调节ILC2等免疫细胞;此外,这类神经纤维也能够接收免疫信号刺激,如由ILC2释放的IL-5能够直接激活NaV1.8+ 的神经纤维。在呼吸道微环境中,ILC2与其周围的生物信号相互作用,在神经-上皮-免疫调控单元中发挥核心作用。
消化道与ILC2
胃肠道的微环境稳态也依赖于上皮屏障细胞、支持和结构细胞、免疫细胞和神经元之间的相互作用。胃肠道主要由中枢神经系统(CNS)控制,并由肠道神经系统(ENS)进行调节——这是感觉神经元、神经元间质和运动神经元的复杂集合;而肠道屏障中的ILC2则负责整合上皮细胞和神经信号,维持组织微环境的稳态。肠上皮细胞的IL-33有助于宿主防御病原体,并通过调节ILC2对神经系统的反应来恢复肠道稳态。胃IL-33的缺乏并不影响ILC2的数量,但会减弱IL-5和IL-13的产生。值得注意的是,ST2表达的时空差异性与ILC2的异质性有关。小鼠实验表明,上皮细胞的细胞因子在决定ILC2的功能和控制其自分泌神经递质以维持肠道平衡方面至关重要。
肠道交感神经元通过释放肾上腺素和去甲肾上腺素来应对致病代谢物、ATP和其他损伤相关分子的攻击。研究表明β2AR信号对ILC2介导的炎症起着负面的调节作用,而肠道ChAT+神经元来源的NMU与CGRP一起在调节肠道2型免疫反应中起着关键作用。同时,IL-33还可以通过MyD88提高NMU表达。总之,神经信号的正负调节作用使得肠道ILC2数量动态变化得以实现,说明ILC2可以直接或间接受上皮细胞细胞因子的调节。这些发现进一步支持了神经-上皮-ILC2单元的概念。
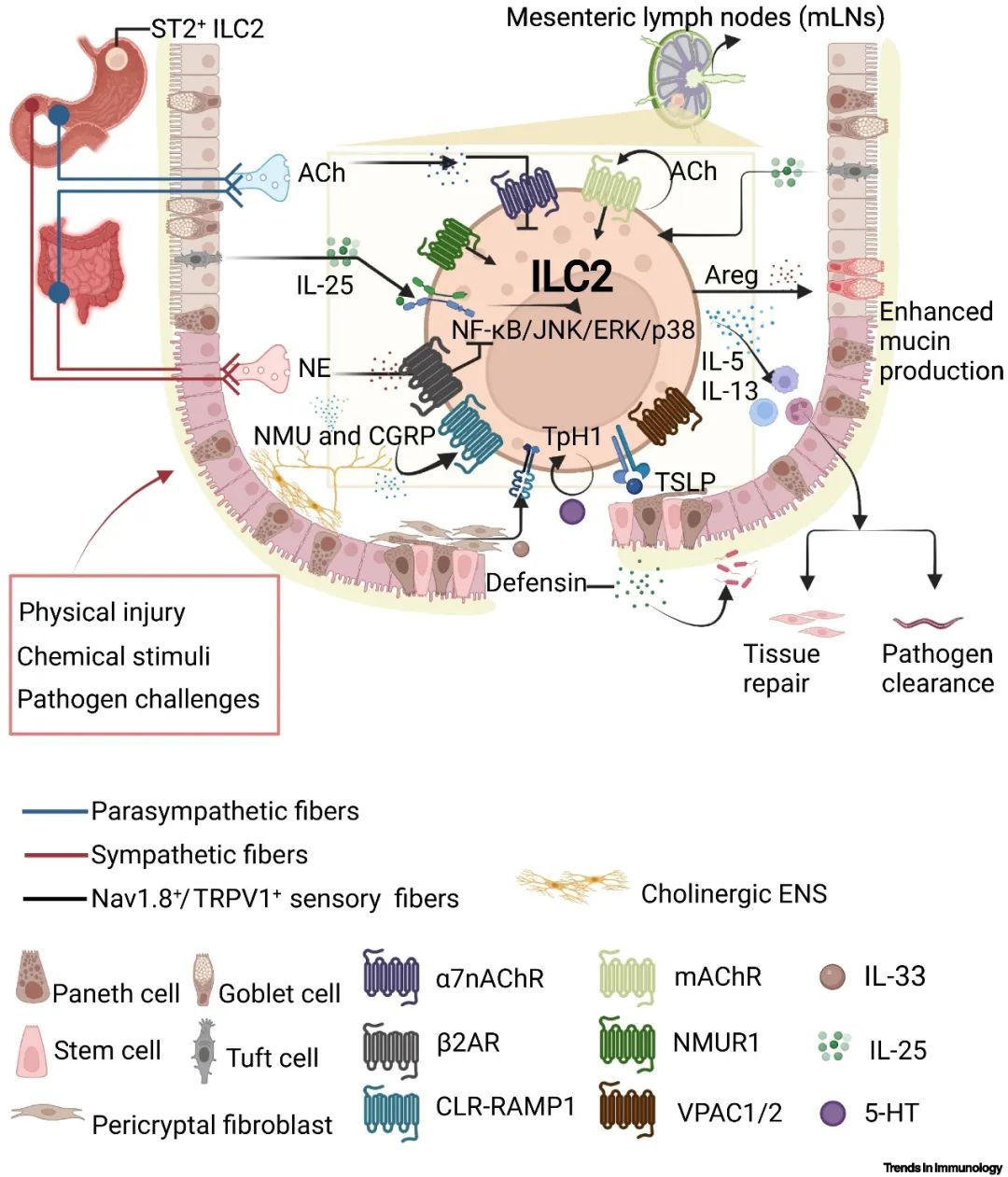
▲图3: 人和小鼠消化道ILC2通过处理上皮和神经来源的信息调节消化道稳态
特应性皮炎、哮喘、急性呼吸窘迫综合征、炎性肠病等是全球重大医疗负担。本文围绕皮肤、呼吸道及消化道三大屏障组织,从局部神经解剖基础(尤其是能够接收外界信号刺激,释放相关神经信号的纤维,包括TRPV1+感觉纤维等)、上述疾病的发病机制、特别是神经-上皮-ILC2单位在疾病发生发展过程中发挥的关键作用展开论述。本文为神经-上皮-免疫相互作用网络的生物基础研究提供了新思路,并指出了屏障组织重大疾病临床治疗和药物研发相关的重要科学问题。
本文参考文献
1. Cardoso, V., et al., Neuronal regulation of type 2 innate lymphoid cells via neuromedin U. Nature, 2017. 549(7671): p. 277-281.
2. Klose, C.S.N., et al., The neuropeptide neuromedin U stimulates innate lymphoid cells and type 2 inflammation. Nature, 2017. 549(7671): p. 282-286.
3. Wallrapp, A., et al., The neuropeptide NMU amplifies ILC2-driven allergic lung inflammation. Nature, 2017. 549(7672): p. 351-356.
4. Nagashima, H., et al., Neuropeptide CGRP Limits Group 2 Innate Lymphoid Cell Responses and Constrains Type 2 Inflammation. Immunity, 2019. 51(4): p. 682-695.
5. Wallrapp, A., et al., Calcitonin Gene-Related Peptide Negatively Regulates Alarmin-Driven Type 2 Innate Lymphoid Cell Responses. Immunity, 2019. 51(4): p. 709-723.
6. Xu, H., et al., Transcriptional Atlas of Intestinal Immune Cells Reveals that Neuropeptide alpha-CGRP Modulates Group 2 Innate Lymphoid Cell Responses. Immunity, 2019. 51(4): p. 696-708.
7. Moriyama, S., et al., β(2)-adrenergic receptor-mediated negative regulation of group 2 innate lymphoid cell responses. Science, 2018. 359(6379): p. 1056-1061.
8. Roberts, L.B., et al., Acetylcholine production by group 2 innate lymphoid cells promotes mucosal immunity to helminths. Sci Immunol, 2021. 6(57).
9. Chu, C., et al., The ChAT-acetylcholine pathway promotes group 2 innate lymphoid cell responses and anti-helminth immunity. Sci Immunol, 2021. 6(57).
10.S. Udit, K. Blake and I. M. Chiu. Somatosensory and autonomic neuronal regulation of the immune response. Nat Rev Neurosci, 2022. 23(3): p. 157-171.

论文作者介绍

刘泉
副教授
刘泉,医学博士,南方科技大学医学院生物化学系副教授,博士生导师,博士后导师。现任中共南方科技大学医学院联合党委副书记、医学院联合分工会主席、中国生物医学工程学会免疫治疗工程分会移植免疫专业委员会副主任委员。历任哈尔滨医科大学附属第二医院心脏大血管外科住院医师、主治医师、副主任医师。2009年至2017年,在匹兹堡大学Thomas E. Starzl移植研究所从事免疫学科学研究。移植免疫学研究成果被写入经典免疫学教材Janeway’s Immunobiology (10th Ed, 2022)。发表SCI论文23篇,其中10篇被发表在Journal of Clinical Investigation、Nature Communications、Trends in Immunology、Blood、Angewandte Chemie International Edition、Cell Death & Differentiation和Cancer Research上。研究领域包括1、肿瘤免疫及免疫治疗;2、神经-免疫-代谢的相互作用,特别是上皮细胞因子、神经递质等对ILC及Treg的免疫生物学作用;3、移植免疫。
相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Immunology,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Neuro–epithelial–ILC2 crosstalk in barrier tissues
▌论文网址:
https://www.cell.com/trends/immuno-logy/fulltext/S1471-4906(22)00187-9
▌DOI:
https://doi.org/10.1016/j.it.2022.09.006
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




