- +1
阿尔茨海默病风险基因破坏了大脑“线路”的绝缘体
原创 MIT 阿尔茨海默病
一项新研究表明,阿尔茨海默病风险基因 APOE4 是通过少突胶质细胞的胆固醇失调损害髓鞘形成。
麻省理工学院皮考尔研究所
11月16日消息
众所周知,携带一个 APOE4 基因变体副本的人患阿尔茨海默病的风险会增加三倍,携带两个副本的人患阿尔茨海默病的风险会增加约十倍,但其根本原因以及如何帮助患者仍基本未知。
麻省理工学院的一个研究小组近日发表在《自然》(Nature)杂志上的一项研究[1]提供了一些新的答案,这是一系列更广泛的研究的一部分,这些研究证明了 APOE4 对大脑中不同细胞类型的影响。论文题目:“APOE4 impairs myelination via cholesterol dysregulation in oligodendrocytes“(APOE4 通过少突胶质细胞的胆固醇失调损害髓鞘形成)。

研究于2022年11月16日发表在《Nature》(最新影响因子:69.504)杂志上
这项新研究结合了来自死后人脑、实验室培养的人脑细胞和阿尔茨海默病模型小鼠的证据,表明当人们有一到两个 APOE4 副本,而不是更常见的、风险不高的 APOE3 版本时,一种叫做少突胶质细胞的细胞会对胆固醇管理不善,无法将脂肪分子运输到长藤状轴突“布线”上,而神经元则通过这种“布线”来连接大脑电路。这种被称为髓磷脂的脂肪绝缘体的缺乏可能是阿尔茨海默病的病理和症状的重要原因,因为没有适当的髓磷脂,神经元之间的通信就会退化。
由麻省理工学院(Massachusetts Institute of Technology,MIT)皮考尔学习与记忆研究所和衰老大脑计划主任蔡立慧(Li-Huei Tsai)教授领导的研究小组最近的研究发现,APOE4 以独特的方式干扰脂肪分子或脂类,而脂类是由包括神经元、星形胶质细胞和小胶质细胞在内的关键脑细胞类型处理的。在这项新研究和之前的研究中,该团队已经确定了在实验室中出现的可以纠正这些不同问题的化合物,从而产生了潜在的基于药物的治疗策略。

这项新研究不仅通过发现 APOE4 如何破坏髓鞘形成,还通过使用单核 RNA 测序(snRNAseq)首次对主要脑细胞类型进行系统分析,比较了 APOE4 和 APOE3 患者的基因表达差异。
麻省理工学院大脑与认知科学学院的 Tsai 教授说:“这篇论文非常清楚地从死后人脑的 snRNAseq 基因型特异性中显示,APOE4 对不同脑细胞类型的影响非常明显。我们看到脂质代谢的聚合被打乱,但当你真正深入研究不同类型的脑细胞中被打乱的脂质通路时,它们都是不同的。"
“我觉得脂质失调可能是我们观察到的许多病理的基础生物学,”她说。
这篇论文的主要作者是 Joel Blanchard,他是西奈山伊坎医学院(Icahn School of Medicine)的助理教授,在 Tsai 的 MIT 实验室做博士后,Djuna Von Maydell 和 Leyla Akay 是 Tsai 实验室的研究生,Jose Davila Velderrain 是 Human Technopole 的研究小组负责人,也是 MIT 计算机科学教授 Manolis Kellis 实验室的前博士后。
有许多检查髓鞘形成的方法
死后的人类大脑样本来自宗教秩序研究(Religious Orders Study)和拉什大学记忆与衰老项目(Rush Memory and Aging Project)。该团队的 snRNAseq 结果是 von Maydell 免费提供的数据集,包含了来自 32 人前额叶皮层的 11 种不同类型的超过 16 万个单个细胞,其中 12 个拥有两个 APOE3 副本,12 个拥有 APOE3 和 APOE4 各一个副本,还有 8 个拥有两个 APOE4 副本。APOE3/3 和 APOE3/4 样本根据阿尔茨海默病诊断、性别和年龄进行了平衡。所有 APOE4/4 携带者都患有阿尔茨海默病,8 人中有 5 人是女性。
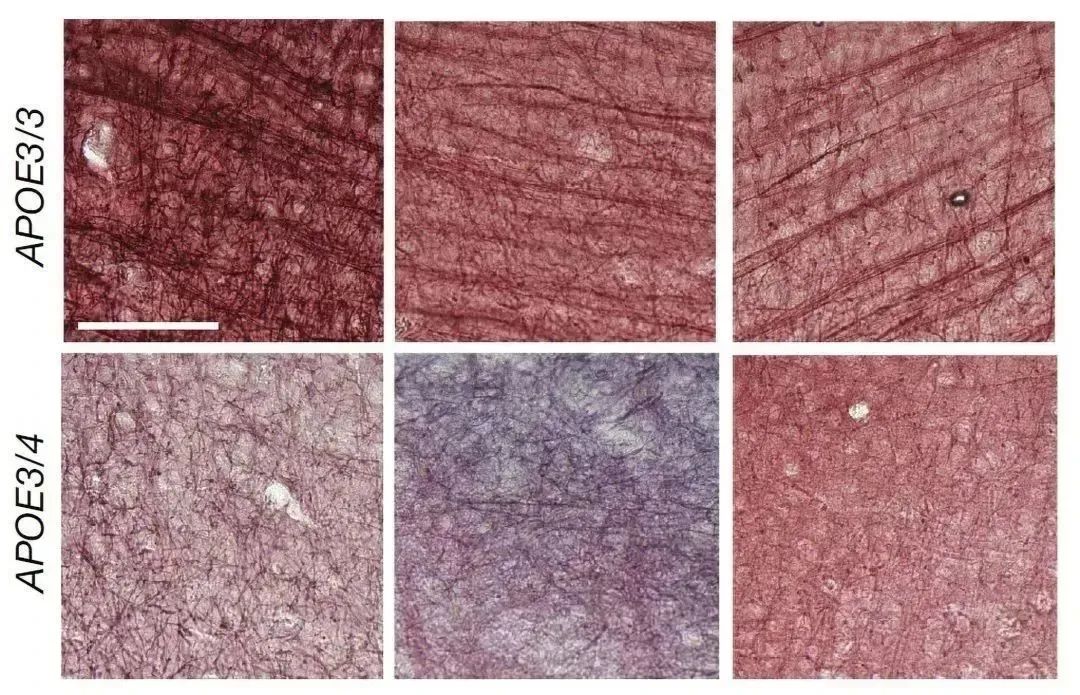
在 APOE3 携带者的死后脑组织中,黑金染色突出了清晰的髓磷脂条纹(上排图片)。在具有一个APOE4 副本(下排图片)的人中,髓鞘形成不太明显
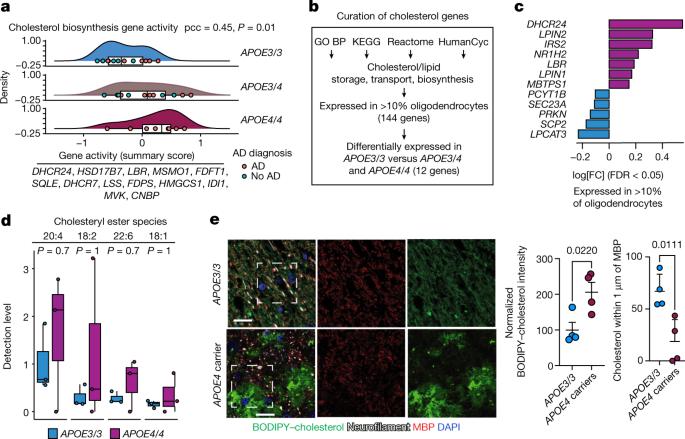
一些结果反映了已知的阿尔茨海默病的病理,但其他的模式是新的。其中一项研究表明,携带 APOE4 的少突胶质细胞表现出更高的胆固醇合成基因表达和胆固醇运输中断。人们的 APOE4 副本越多,影响就越大。考虑到 Tsai 和 Kellis 实验室在 2019 年之前的一项分析结果[2],这尤其有趣,该分析将阿尔茨海默病与少突胶质细胞中髓鞘形成基因的表达减少联系起来。
通过使用各种技术直接观察组织,研究小组发现在 APOE4 大脑中,异常量的胆固醇在细胞体内积累,特别是在少突胶质细胞中,但在神经轴突周围相对缺乏。
为了了解原因,研究小组使用患者来源的诱导多能干细胞,创建了实验室细胞培养的少突胶质细胞,通过基因工程改造,使其仅因是否具有 APOE4 或 APOE3 而不同。APOE4 细胞再次出现严重的脂质破坏。特别是,受影响的少突胶质细胞在体内囤积了额外的胆固醇,有迹象表明,额外的内部脂肪对内质网的细胞器造成了压力,内质网在胆固醇运输中起着重要作用,确实减少了向细胞膜运输的胆固醇。之后,当它们与神经元共培养时,APOE4 少突胶质细胞不能像 APOE3 细胞那样使神经元髓鞘化,无论神经元是否携带 APOE4 或 APOE3。
研究小组还观察到,在死后的大脑中,APOE4 携带者的髓鞘形成要少于 APOE3 携带者。例如,在 APOE4 大脑中,贯穿胼胝体(连接大脑半球的结构)的轴突周围的髓鞘明显更薄。在携带人类 APOE4 基因的小鼠和携带 APOE3 基因的小鼠中,情况也是如此。
有效的干预
急于找到一种潜在的干预手段,研究小组将注意力集中在影响胆固醇的药物上,包括抑制胆固醇合成的他汀类药物和帮助胆固醇运输的环糊精(Cyclodextrin,CD)。他汀类药物没有帮助,但将环糊精应用于培养皿中培养的 APOE4 少突胶质细胞,减少了细胞内胆固醇的积累,并改善了与神经元共培养的髓鞘形成。此外,它对 APOE4 小鼠也有这些作用。
最后,研究小组用环糊精对一些 APOE4 小鼠进行了治疗,对其他小鼠不进行治疗,并对它们进行了两项不同的记忆测试。经环糊精治疗的小鼠在两项测试中的表现都明显更好,这表明髓鞘形成的改善与认知能力的改善之间存在关联。
Tsai 说,一幅清晰的图景正在显现,通过细胞类型干预纠正特定的脂质失调可能有助于抵消 APOE4 对阿尔茨海默病的作用。
Tsai 说:“令人鼓舞的是,我们已经看到了一种挽救实验室和小鼠模型少突胶质细胞功能和髓鞘形成的方法。但除了少突胶质细胞,我们可能还需要找到临床有效的方法来照顾小胶质细胞、星形胶质细胞和血管系统,以真正对抗疾病。”


创立于1861年的麻省理工学院
参考文献
Source:Picower Institute at MIT
Alzheimer's risk gene undermines insulation of brain's 'wiring'
References:
[1].Blanchard, J.W., Akay, L.A., Davila-Velderrain, J. et al. APOE4 impairs myelination via cholesterol dysregulation in oligodendrocytes. Nature (2022). https://doi.org/10.1038/s41586-022-05439-w
[2].Mathys, H., Davila-Velderrain, J., Peng, Z. et al. Single-cell transcriptomic analysis of Alzheimer’s disease. Nature 570, 332–337 (2019). https://doi.org/10.1038/s41586-019-1195-2
免责声明
本公众号上的医疗信息仅作为信息资源提供与分享,不用于或依赖于任何诊断或治疗目的。此信息不应替代专业诊断或治疗。在做出任何医疗决定或有关特定医疗状况的指导之前,请咨询你的医生。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




