- +1
【学术前沿】施裕丰/江赐忠/房静远/陈菊祥发现癌细胞对氧化磷酸化抑制的调控新机制
线粒体为细胞的各种生命活动提供能量,被称为细胞的“能量工厂”。线粒体氧化磷酸化通路偶联三羧酸循环、脂肪酸氧化,不仅为细胞存活、增殖等提供能量,还在细胞合成代谢、信号转导等方面起重要作用。线粒体氧化磷酸化通路是细胞的能量来源,在肿瘤细胞中发生重编程以促进肿瘤细胞增殖,氧化磷酸化通路已成为多种疾病的治疗靶点[1, 2]。靶向线粒体氧化磷酸化的各种抑制剂也已被广泛开发。比如经典的抑制剂Rotenone、Oligomycin A 等,近几年发现的IACS010759[3],Gboxin[3, 4]等已经在进行临床转化。肿瘤细胞对线粒体氧化磷酸化抑制剂的敏感性有很大差异[4-6]。然而决定肿瘤细胞对线粒体氧化磷酸化抑制剂敏感性的分子机制还不清楚,限制了靶向线粒体氧化磷酸化在肿瘤治疗中的应用。肿瘤细胞的能量来源有的更多依赖于线粒体氧化磷酸化通路,有的则更依赖于糖酵解通路,只有对于能量来源更依赖于线粒体氧化磷酸化通路的肿瘤使用线粒体氧化磷酸化通路的抑制剂才更有疗效,因此研究调控氧化磷酸化通路抑制剂敏感性的基因,解析他们内部的机制,对于靶向线粒体氧化磷酸化通路治疗肿瘤具有重要意义。
2022年11月16日,同济大学癌症中心施裕丰组、生科院江赐忠组联合上海交大仁济医院房静远组、上海长海医院陈菊祥组合作在Advanced Science在线发表题为“NNMT-DNMT1 Axis is Essential for Maintaining Cancer Cell Sensitivity to Oxidative Phosphorylation Inhibition”的研究论文,该研究报道了首次发现NNMT-DNMT1信号轴影响肿瘤细胞对线粒体氧化磷酸化抑制剂的敏感性。

线粒体的代谢物与表观遗传密切相关,多个代谢物作为表观遗传的辅因子或者表观遗传酶的底物[2]。线粒体代谢与表观遗传共同作用影响肿瘤转移、耐药以及肿瘤细胞命运[7]。烟酰胺N甲基转移酶(NNMT)是一种细胞内甲基转移酶,利用S-腺苷甲硫氨酸(SAM) 作为甲基供体, 催化烟酰胺(NAM)生成N-甲基烟酰胺(1-MNAM)[8-10],1-MNAM被醛氧化酶进一步氧化并随尿液排出人体。NNMT最初的功能是参与烟酰胺代谢以及体内外源小分子解毒[11],但现在越来越多的证据表明NNMT参与SAM和SAM/SAH的调控。NNMT的高表达可以改变细胞内SAM的水平,NNMT是细胞内SAM水平的负调节器。
SAM是DNA和组蛋白甲基化的甲基供体,NNMT通过影响SAM和SAH的水平影响DNA和组蛋白的甲基化。DNA甲基化在基因转录调节和细胞身份确定中起着核心作用[12, 13],它受到进化上保守的蛋白质家族DNA甲基转移酶(DNMTs)的严格调控[14, 15]。在哺乳动物的基因组中,多种DNMT已被鉴定,其中,DNMT3A/3B主要负责建立DNA的甲基化,而DNMT1主要是在DNA复制中维持DNA的甲基化。DNMT基因表达的增加与基因组DNA甲基化的动态转换有关,这在细胞命运决定中起重要作用[16, 17]。
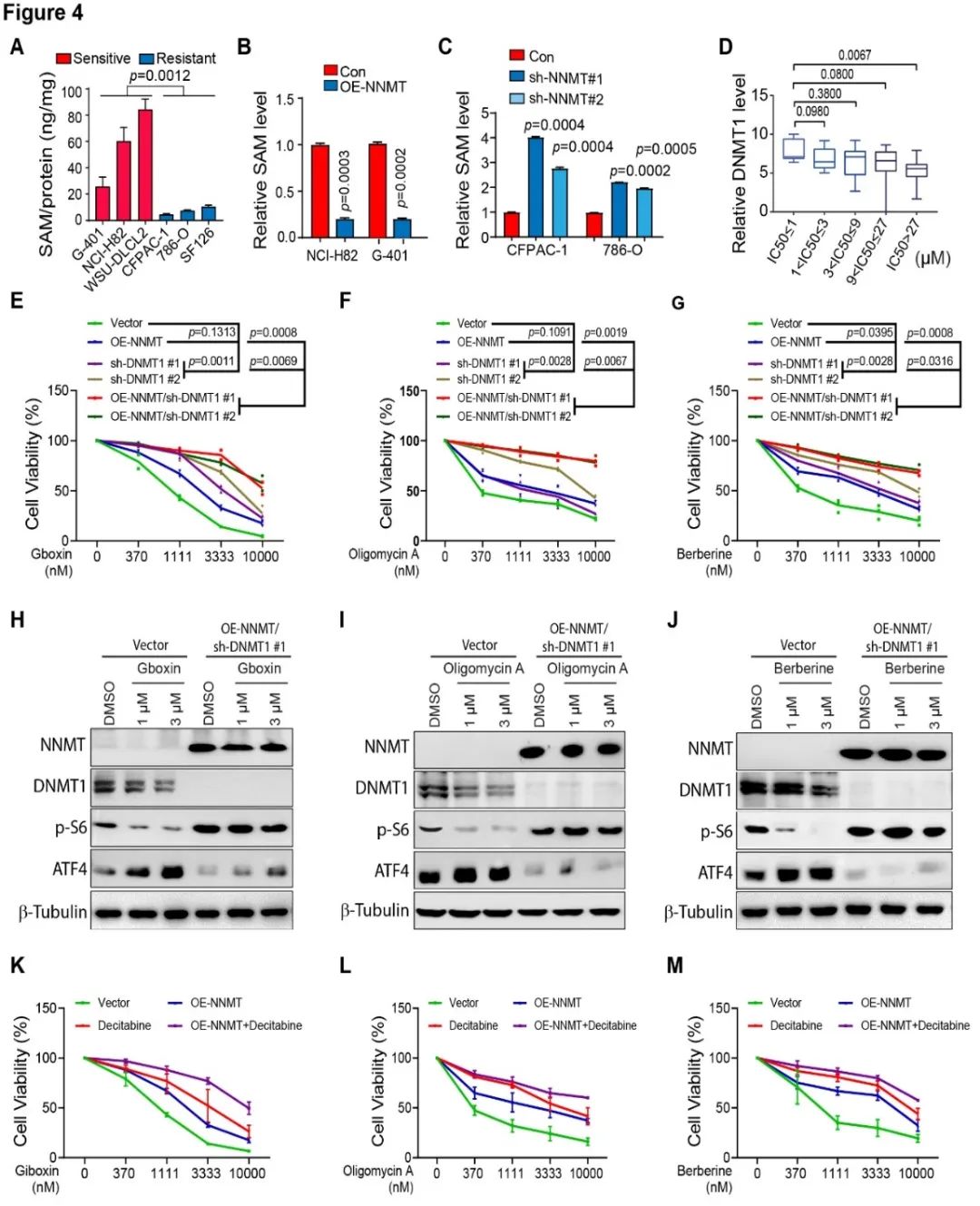
为了寻找对线粒体抑制剂耐药和敏感的两类肿瘤细胞的基因表达特征,研究者使用线粒体抑制剂Gboxin对57株肿瘤细胞进行了ATP活力检测, 将57株细胞系按照对Gboxin的敏感性排列,分别取耐药株5株和敏感株5株进行转录组测序,发现耐药株中NNMT基因高表达,而敏感株中DNMT1基因高表达。由于NNMT是烟酰胺甲基转移酶,NNMT的表达可能影响基因组的甲基化。同时甲基化在已有研究中经常作为肿瘤标记物存在,研究者也对5株耐药株和5株敏感株进行了全基因组甲基化测序, 发现耐药株中NNMT的启动子区甲基化程度低而敏感株的NNMT启动子区甲基化程度较高,这与RNA测序中基因表达结果相一致(DNA高甲基化抑制基因表达)。而对敏感的细胞株进行过表达NNMT同时敲低DNMT1(NNMThighDNMT1low)可以大幅度增强其耐药性,从而使细胞从敏感株变为耐药株。因此,NNMT和DNMT1共同维持肿瘤细胞对线粒体氧化磷酸化抑制剂的敏感性,即代谢酶NNMT 和表观修饰共同调节线粒体功能来调节细胞代谢。
研究者接着在动物体内进行了功能验证,使用线粒体氧化磷酸化抑制剂敏感的细胞株(NCI-H82和MDA-MB-453)和耐药的细胞株(CFPAC-1 和NCI-H82 NNMThighDNMT1low的细胞)进行裸鼠皮下成瘤,检测肿瘤切片发现NNMT在耐药的肿瘤中高表达,敏感的肿瘤中低表达,DNMT1在耐药株的肿瘤中低表达,敏感的肿瘤中高表达。进一步使用腹腔注射氧化磷酸化抑制剂S-Gboxin或Berberine, 发现他们可以显著抑制敏感株肿瘤体积而对耐药株成瘤的肿瘤几乎没有抑制效果。与体外表型一致,抑制剂对NNMThighDNMT1low的细胞形成的肿瘤抑制效果甚微。因此,NNMT/DNMT1信号轴维持了肿瘤细胞对氧化磷酸化抑制剂的敏感性。
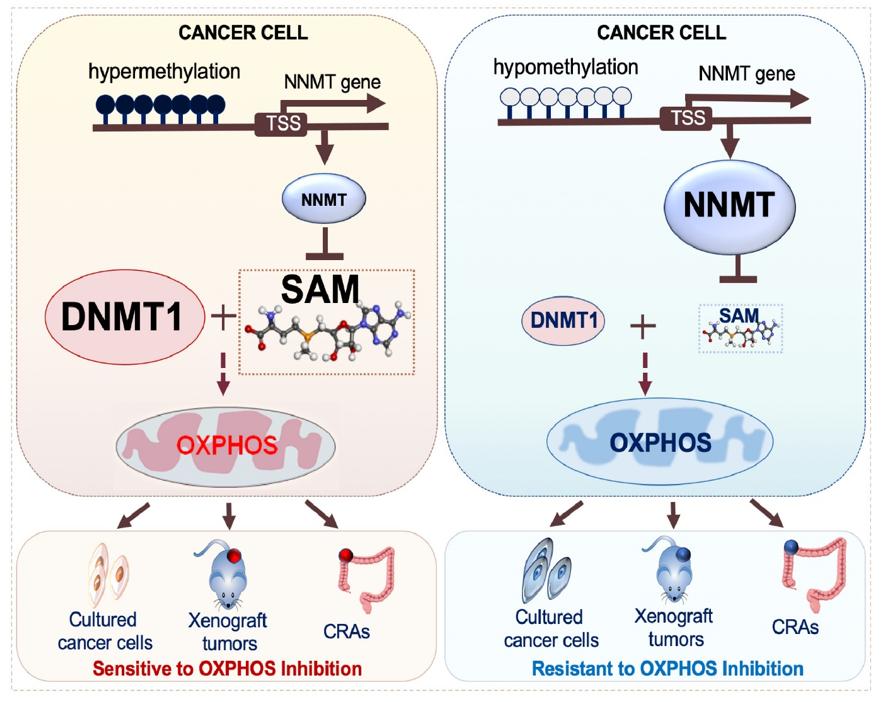
模式图:肿瘤细胞线粒体抑制剂敏感株和耐药株具有不同的基因表达特征
小檗碱(Berberine)可以抑制线粒体氧化磷酸化通路。通过服用小檗碱的结直肠腺瘤病人进行回顾性研究,作者发现肿瘤不复发的病人的肿瘤样本中DNMT1高表达且NNMT低表达,表明服用小檗碱的药物起到了作用,肿瘤对线粒体氧化磷酸化的抑制剂比较敏感,使用氧化磷酸化的抑制剂治疗达到了很好的疗效。而在肿瘤复发病人的肿瘤样本中发现NNMT高表达且DNMT1低表达,肿瘤细胞对氧化磷酸化抑制剂具有抗药性,使用氧化磷酸化抑制剂治疗无效,肿瘤复发。
本研究揭示了肿瘤细胞对线粒体氧化磷酸化抑制剂敏感性和耐药的分类标签,为靶向线粒体氧化磷酸化治疗肿瘤提供了新策略。
本研究的通讯作者为同济大学癌症中心、脑和脊髓研究中心、医学院的施裕丰教授,共同通讯作者为同济大学生科院江赐忠教授、上海交通大学附属仁济医院房静远教授、海军军医大学第一附属医院陈菊祥教授。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202202642
最终通讯作者简介:
施裕丰 同济大学医学院教授、博导
施裕丰教授于2007年在中科院生化细胞所获得博士学位,曾先后在 美国康奈尔大学、纪念斯隆凯特琳癌症中心工作。以第一/共一、通讯/共 通讯作者在Nature、Cell、Nature Immunology、STTT等杂志上发表论文多篇,拥有多项发明专利,曾以共同主持人身份主持1项美国纪念斯隆-凯特琳癌症中心药物研究项目,参与2 项美国国家健康研究院(NIH)研究 项目和3 项德克萨斯州肿瘤研究院项目。主持国自然面上基金及上海市科委基金。2019年8月回国任同济大学医学院教授。目前担任中国生物物理学会线粒体分会理事、中国抗癌协会肿瘤微环境专委会青年委员、中国抗癌协会肿瘤标志物专委会青年委员。主要研究方向为线粒体代谢与肿瘤发生发展之间的关系,以神经胶质瘤为模型,研究线粒体在肿瘤细胞中的功能及靶向肿瘤细胞线粒体。
(1)通过对57株肿瘤细胞测序,已发现肿瘤细胞对线粒体抑制剂敏感性不同
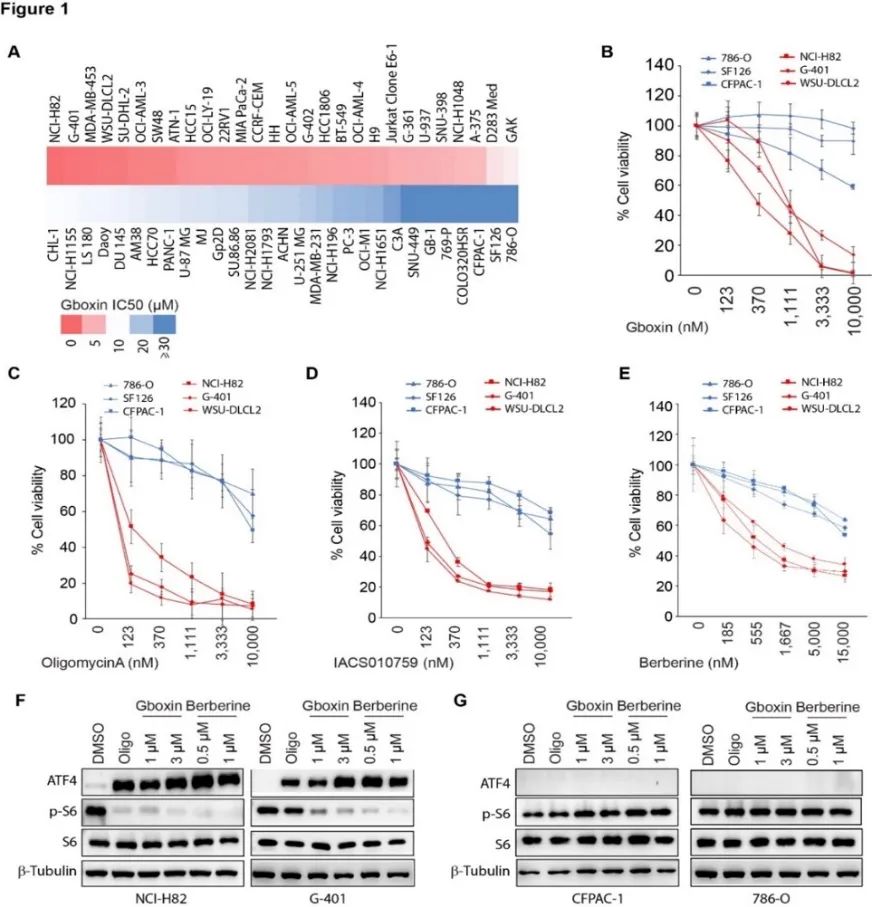
(2)对敏感株细胞进行过表达NNMT同时敲低DNMT1,可增强其耐药性,变为耐药细胞株
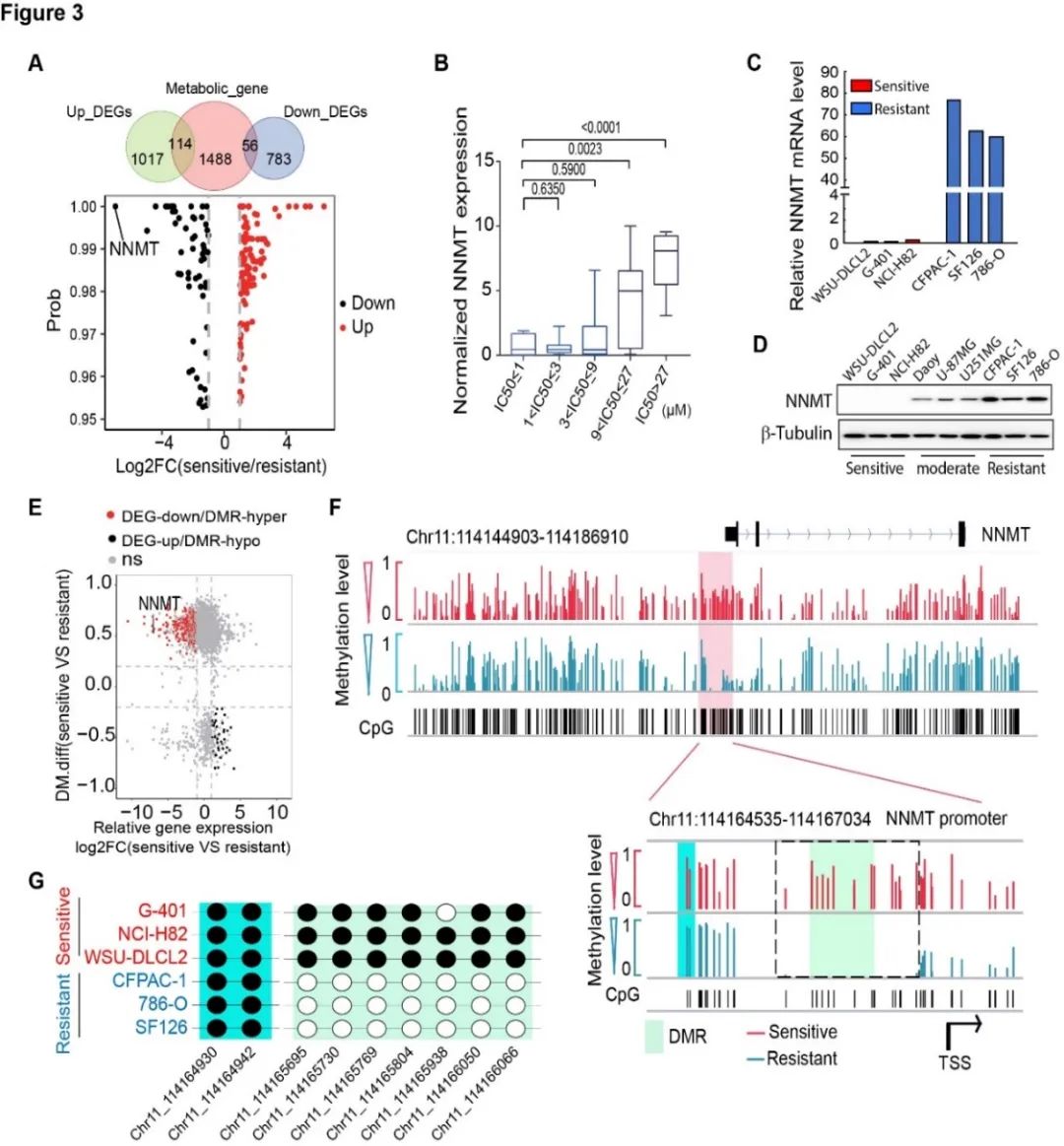
(3)过表达NNMT同时敲低DNMT1可以使敏感株变得更加耐药
Reference
[1] Y.E. Liu, Y.F. Shi, Mitochondria as a target in cancer treatment. MedComm. 2020;1(2):129-139.
[2] Y. Liu, C. Chen, X. Wang, et al., An Epigenetic Role of Mitochondria in Cancer. Cells. 2022;11(16).
[3] L. Zhang, Y. Yao, S. Zhang, et al., Metabolic reprogramming toward oxidative phosphorylation identifies a therapeutic target for mantle cell lymphoma. Science Translational Medicine. 2019;11(491).
[4] Y. Shi, S.K. Lim, Q. Liang, et al., Gboxin is an oxidative phosphorylation inhibitor that targets glioblastoma. Nature. 2019;567(7748):341-346.
[5] T.M. Ashton, W.G. McKenna, L.A. Kunz-Schughart, et al., Oxidative Phosphorylation as an Emerging Target in Cancer Therapy. Clin Cancer Res. 2018;24(11):2482-2490.
[6] J. Garcia-Bermudez, L. Baudrier, K. La, et al., Aspartate is a limiting metabolite for cancer cell proliferation under hypoxia and in tumours. Nature Cell Biology. 2018;20(7):775-781.
[7] R.P. Chakrabarty, N.S. Chandel, Mitochondria as Signaling Organelles Control Mammalian Stem Cell Fate. Cell Stem Cell. 2021;28(3):394-408.
[8] Y.A. Kang-Lee, R.W. McKee, S.M. Wright, et al., Metabolic effects of nicotinamide administration in rats. J Nutr. 1983;113(2):215-221.
[9] T. Scheller, H. Orgacka, C.L. Szumlanski, et al., Mouse liver nicotinamide N-methyltransferase pharmacogenetics: biochemical properties and variation in activity among inbred strains. Pharmacogenetics. 1996;6(1):43-53.
[10] L. Yan, D.M. Otterness, T.L. Craddock, et al., Mouse liver nicotinamide N-methyltransferase: cDNA cloning, expression, and nucleotide sequence polymorphisms. Biochem Pharmacol. 1997;54(10):1139-1149.
[11] P. Pissios, Nicotinamide N-Methyltransferase: More Than a Vitamin B3 Clearance Enzyme. Trends in Endocrinology and Metabolism. 2017;28(5):340-353.
[12] O.A. Ulanovskaya, A.M. Zuhl, B.F. Cravatt, NNMT promotes epigenetic remodeling in cancer by creating a metabolic methylation sink. Nat Chem Biol. 2013;9(5):300-306.
[13] M.A. Eckert, F. Coscia, A. Chryplewicz, et al., Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts. Nature. 2019;569(7758):723-+.
[14] M.V.C. Greenberg, D. Bourc'his, The diverse roles of DNA methylation in mammalian development and disease. Nat Rev Mol Cell Biol. 2019;20(10):590-607.
[15] A. Parry, S. Rulands, W. Reik, Active turnover of DNA methylation during cell fate decisions. Nat Rev Genet. 2021;22(1):59-66.
[16] F. Lyko, The DNA methyltransferase family: a versatile toolkit for epigenetic regulation. Nat Rev Genet. 2018;19(2):81-92.
[17] H. Leonhardt, A.W. Page, H.U. Weier, et al., A targeting sequence directs DNA methyltransferase to sites of DNA replication in mammalian nuclei. Cell. 1992;71(5):865-873.
原标题:《【学术前沿】施裕丰/江赐忠/房静远/陈菊祥发现癌细胞对氧化磷酸化抑制的调控新机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




