- 3
- +11
《自然》:癌细胞惊现反常识运动模式丨科学大发现
原创 奇点糕 奇点网 收录于合集 #肿瘤 8个
*仅供医学专业人士阅读参考


在奇点网先前的众多推送中,相信你已经大概知道癌细胞有多狡猾了。它们有时会逃脱免疫细胞的监视,甚至能利用免疫细胞来扩张自身版图。
除此之外,还有一些机制使癌细胞变得“脚滑”,哪怕是在高黏度的细胞外液中,它们也不被阻拦,反而跑得更快!
近日,由约翰霍普金斯大学Konstantinos Konstantopoulos教授领衔的研究团队发现,高黏度细胞外液对细胞运动的促进作用,是通过调节细胞骨架、水通道和离子通道来实现的。并且脱离高黏度环境之后,细胞仍能保持较为活跃的迁移能力。这项研究于11月2日发表在《自然》上[1]。
这项研究首次揭示了高黏度细胞外液影响肿瘤转移的分子调控机制,可能为肿瘤治疗甚至形态发生相关的研究提供新的切入点。

▲论文截图
肿瘤微环境在肿瘤发生和进展中的作用一直是近来的关注热点,但你知道除了形形色色的非肿瘤细胞和细胞因子,微环境的物理特性也会调节肿瘤转移吗?
当所处外界环境的刚度、流体切应力和液压压力等变化时,细胞会受到这些物理刺激的影响[2-5]。由于肿瘤细胞和微环境中的内皮细胞分泌黏蛋白、淋巴回流受阻、细胞外基质降解等因素,肿瘤微环境的细胞外液黏度比健康生理状况下更高[6]。
常规体外细胞培养的环境黏度与水近似,但实际体内组织液的黏度可达水的7倍之多[7],在内皮细胞和肿瘤细胞分泌的黏蛋白等大分子作用下,组织液的黏度还可进一步升高[8]。
此前已经有研究显示,在黏度远高于体内水平的环境中,贴壁生长的癌细胞和正常细胞的运动能力均会增强[9, 10]。这个现象相当反直觉,因为生活智慧早就告诉我们,液体黏度越高,流动性越差。
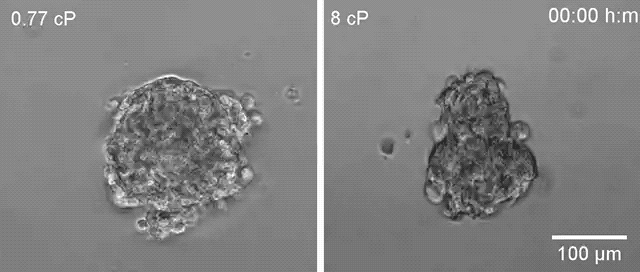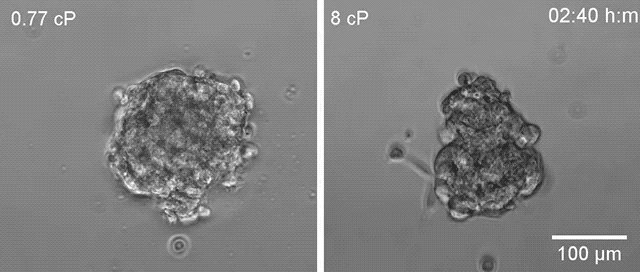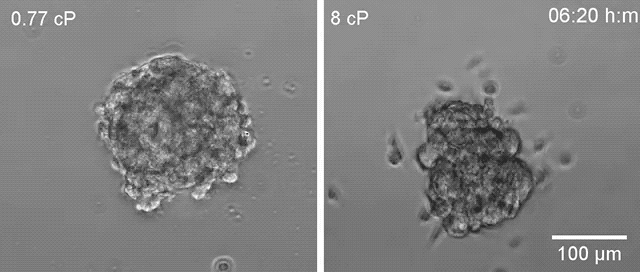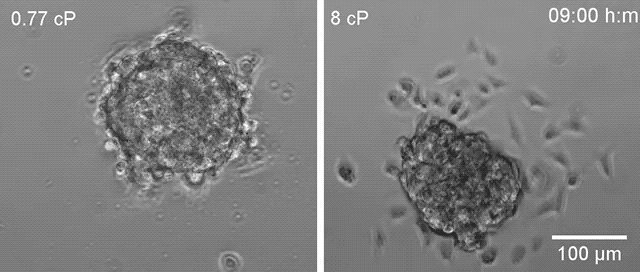
▲高黏度环境下(右)乳腺癌细胞更容易散开
因此,这一现象背后的机制或许并不局限于物理效应,很可能还存在更为复杂的生物学信号传递。另外,细胞通过何种分子机制感知黏度变化并做出反应,仍然是一个有待解决的问题。
研究人员向培养基中添加甲基纤维素、右旋糖酐或聚乙烯吡咯烷酮(PVP)等大分子,这些大分子可以制造高黏度的培养环境,却不明显改变培养基的渗透压。结果显示,无论是贴壁培养还是三维培养条件,无论添加何种大分子,只要细胞外液黏度升高,均会促进多种细胞的运动和肿瘤扩散。
接下来,通过进一步探究细胞运动活跃背后的分子机制,研究人员发现,细胞外液黏度升高,增加了细胞的机械负荷,在肌动蛋白相关蛋白2/3(ARP2/3)复合体的作用下,促进肌动蛋白核聚,即新纤维的末端附着在已有纤维上,组成树枝状的网络。这种致密的肌动蛋白网络集中分布在细胞前缘,有助于细胞伸出片状伪足、进行迁移。看来细胞也可以把压力转化为动力,只是在癌细胞中,这样的“动力”是我们不希望看到的。
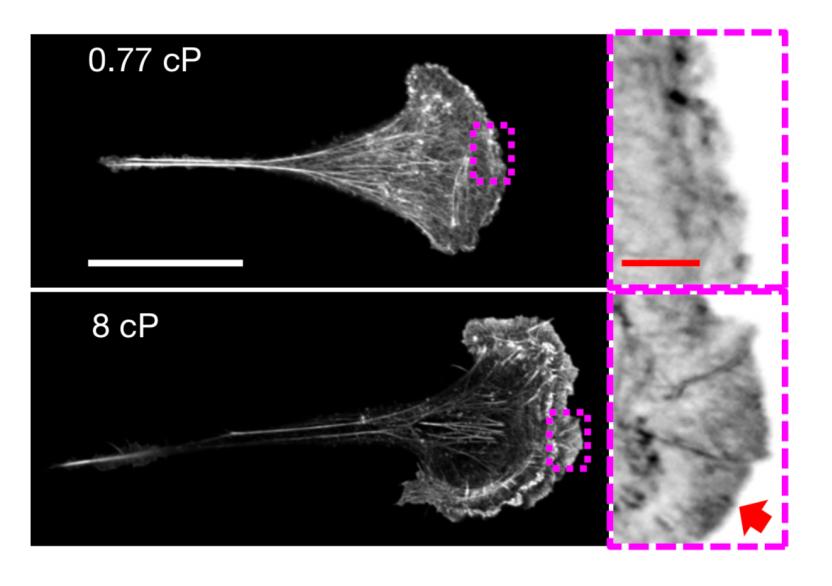
▲高黏度环境下,细胞伸出的板状伪足中含有丰富的肌动蛋白(红色箭头所示)
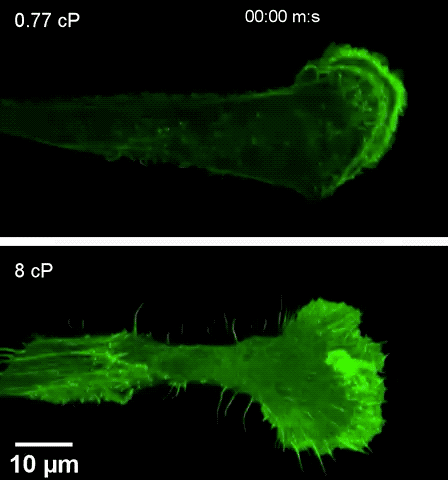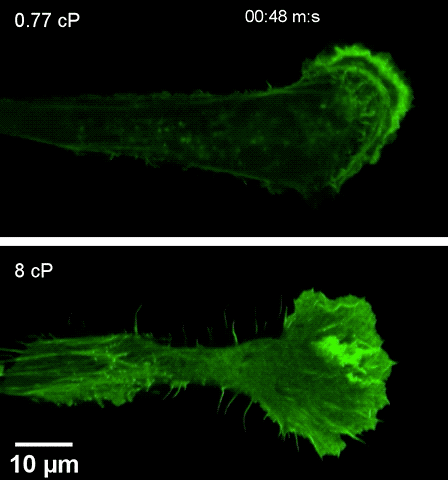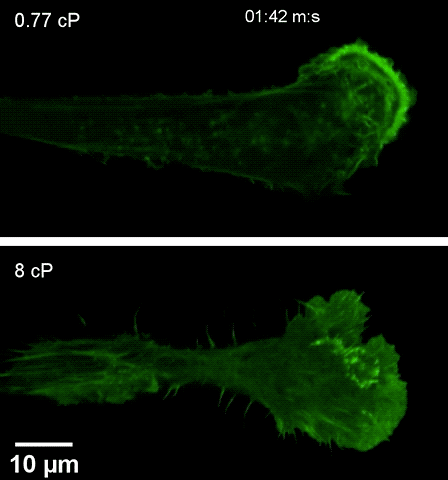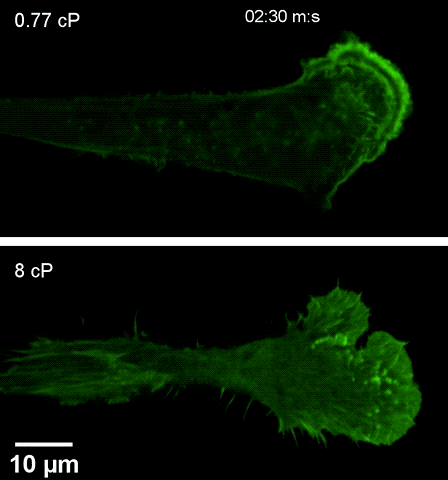
注高黏度环境下(下),细胞伸出伪足更快
接下来,结合在肌动蛋白上的Ezrin蛋白将钠氢离子交换蛋白1(NHE1)锚定在细胞膜前端,NHE1与水通道蛋白5(AQP5)协同促进细胞吸收水。细胞吸水肿胀后,细胞膜的张力也会增大,从而激活细胞膜上的机械力/渗透压敏感离子通道 (MOSICs)。研究人员通过筛选发现,在各种允许钙离子通过的MOSICs中,只有TRPV4能被高黏度的细胞外液激活,并参与细胞运动,促进钙内流。
同时,作为MOSICs中的“天选之子”,TRPV4还能升高细胞前端的RHOA活性。RHOA– ROCK–肌球蛋白II信号通路被激活后,肌球蛋白IIA(MIIA)作为使细胞收缩的主要效应蛋白,在细胞内形成局部较高的压力,有助于细胞在运动时克服高黏度环境的阻力。
不过,MIIA的功能并没有这么专一。它还参与肌动蛋白网络的解体[11],可以破坏高黏度环境下形成的致密肌动蛋白网络。这时多亏了细胞前端密集分布的黏着斑,它们牢牢固定住应力纤维,使细胞在前端顺利伸出突出,而不至于在MIIA的作用下过度收缩。在这一张一弛之间,细胞自然就向前运动啦。
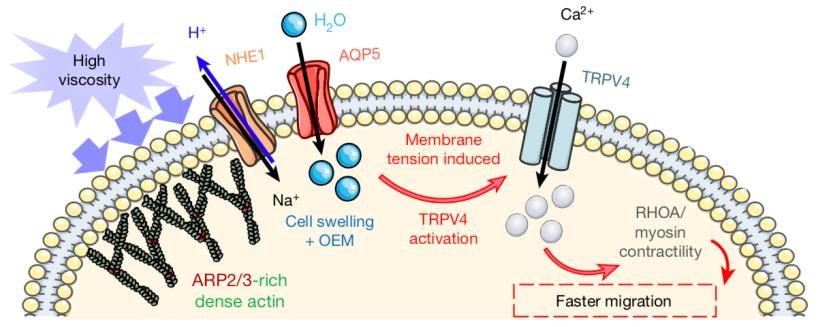
▲高黏度细胞外液促进细胞运动的分子机制
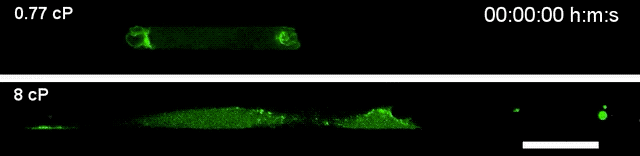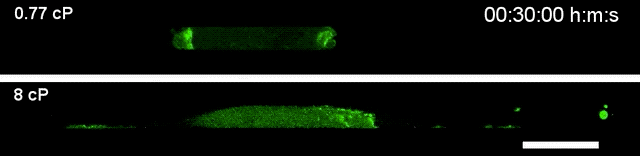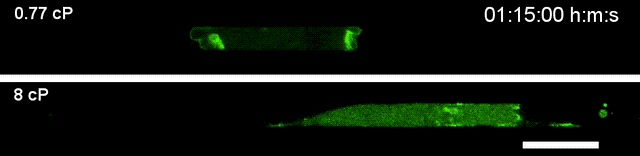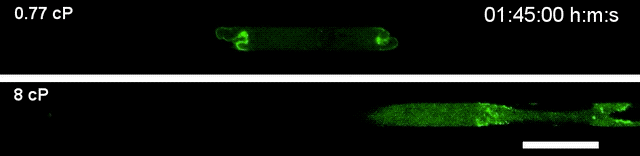
▲高黏度环境下(下),细胞运动速度更快
到这一步,高黏度的细胞外液如何促进细胞迁移,其中的道理可以说是阐述得很明白了。但新的问题也随之而来:当细胞从高黏度环境迁移到黏度相对较低、甚至正常的环境中,如果这种效应随即消失,那么细胞似乎也跑不了多远?
为了进一步探究细胞在高黏度环境中增强的运动能力究竟能维持多久,研究人员将细胞在高黏度环境下培养6天,再转移到正常黏度的环境中。他们发现,即便培养条件恢复到正常黏度,细胞仍然能保持高黏度环境中较快的运动速度,并且对高黏度的“记忆”依赖于TRPV4。
在斑马鱼、鸡胚和小鼠等体内肿瘤模型中,已经被高黏度环境激活了TRPV4的肿瘤细胞也同样能维持这种“记忆”,迁徙与定植能力均有所增强。细胞还真是“一入高黏深似海,从此迟缓是路人”!
▲这篇论文的全部高清动图看这里
这项研究将高黏度细胞外液促进肿瘤转移的分子机制阐述得十分明确,未来通过干预这些生物学过程,科学家们或许能发现治疗肿瘤的新靶点。
另外,细胞外液黏度对细胞的改变并不是瞬时的,即便离开高黏度环境,细胞的变化仍然可以维持较长时间。因此,高黏度刺激在肿瘤进展和转移中发挥的作用不容小觑,或许还可以从物理学角度入手,寻找新的癌症治疗手段。
这项研究还发现,高黏度细胞外液促进细胞运动的效果并不仅限于癌细胞,对正常细胞也有类似的作用。除了肿瘤转移之外,细胞的迁移行为还广泛存在于形态发生、伤口愈合、免疫反应等过程,高黏度环境是否也参与这些活动,还有待今后进一步探索。

参考文献:
[1] Bera K, Kiepas A, Godet I, et al. Extracellular fluid viscosity enhances cell migration and cancer dissemination. Nature. 2022;611(7935):365-373. doi:10.1038/s41586-022-05394-6
[2] Discher DE, Janmey P, Wang YL. Tissue cells feel and respond to the stiffness of their substrate. Science. 2005;310(5751):1139-1143. doi:10.1126/science.1116995
[3] Yankaskas CL, Bera K, Stoletov K, et al. The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Sci Adv. 2021;7(28):eabh3457. Published 2021 Jul 9. doi:10.1126/sciadv.abh3457
[4] Zhao R, Afthinos A, Zhu T, et al. Cell sensing and decision-making in confinement: The role of TRPM7 in a tug of war between hydraulic pressure and cross-sectional area. Sci Adv. 2019;5(7):eaaw7243. Published 2019 Jul 24. doi:10.1126/sciadv.aaw7243
[5] Renkawitz J, Kopf A, Stopp J, et al. Nuclear positioning facilitates amoeboid migration along the path of least resistance. Nature. 2019;568(7753):546-550. doi:10.1038/s41586-019-1087-5
[6] Park S, Jung WH, Pittman M, Chen J, Chen Y. The Effects of Stiffness, Fluid Viscosity, and Geometry of Microenvironment in Homeostasis, Aging, and Diseases: A Brief Review. J Biomech Eng. 2020;142(10):100804. doi:10.1115/1.4048110
[7] Yao W, Shen Z, Ding G. Simulation of interstitial fluid flow in ligaments: comparison among Stokes, Brinkman and Darcy models. Int J Biol Sci. 2013;9(10):1050-1056. Published 2013 Nov 5. doi:10.7150/ijbs.7242
[8] Kufe DW. Mucins in cancer: function, prognosis and therapy. Nat Rev Cancer. 2009;9(12):874-885. doi:10.1038/nrc2761
[9] Gonzalez-Molina J, Zhang X, Borghesan M, et al. Extracellular fluid viscosity enhances liver cancer cell mechanosensing and migration. Biomaterials. 2018;177:113-124. doi:10.1016/j.biomaterials.2018.05.058
[10] Pittman M, Iu E, Li K, et al. Membrane ruffling is a mechanosensor of extracellular fluid viscosity. Nature Physics. 2022/09/01 2022;18(9):1112-1121. doi:10.1038/s41567-022-01676-y
[11] Bergert M, Chandradoss SD, Desai RA, Paluch E. Cell mechanics control rapid transitions between blebs and lamellipodia during migration. Proc Natl Acad Sci U S A. 2012;109(36):14434-14439. doi:10.1073/pnas.1207968109


本文作者丨初 一
责任编辑丨代丝雨
原标题:《《自然》:癌细胞惊现反常识运动模式!约翰霍普金斯大学团队发现,癌细胞在高黏度细胞外液中迁移更快丨科学大发现》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。



- 习近平参加首都义务植树活动
- 世贸组织就美国关税政策发表声明
- 加拿大:对美汽车加征25%关税

- 俄总统特别代表:俄美探讨多领域合作可能
- 国际油价持续走低

- 京剧伴奏乐器中的主要弦乐器,又名胡琴的是
- 连接地中海与红海,属于亚非分界线一部分的人工水道是

- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司










