- +1
浙江大学林爱福等发现肿瘤细胞中PD-L1翻译后修饰的调控新因子
原创 转网 转化医学网
本文为转化医学网原创,转载请注明出处
作者:Mia
导读:靶向PD-L1/PD-1轴的免疫检查点阻断疗法已显示出显著的临床疗效。提高对潜在调节机制的理解可能有助于对免疫疗法有新的见解。最近,有研究团队发现跨膜和泛素样结构域蛋白1 (TMUB1)是肿瘤细胞中PD-L1翻译后修饰的调节因子。
2022年11月14日,浙江大学林爱福、周天华、周如鸿,加州大学Wenqi Wang与西湖大学李旭在Nature Communications杂志上共同通讯发表了题为“Promoting anti-tumor immunity by targeting TMUB1 to modulate PD-L1 polyubiquitination and glycosylation”的研究论文。该研究表明TMUB1调节PD-L1的细胞丰度以促进癌细胞逃逸,并有望作为免疫治疗的潜在靶标。

https://doi.org/10.1038/s41467-022-34346-x
研究背景
01
肿瘤细胞可以通过免疫编辑绕过免疫识别。免疫编辑包括对免疫检查点分子,如程序性细胞死亡配体-1 (PD-L1)的调节。T细胞上表达的PD-1与肿瘤细胞上表达的PD-L1相互作用,抑制CD8+ T细胞的活化和扩张,从而使癌细胞逃避免疫破坏。
目前以PD-L1/PD-1轴为靶点的免疫检查点阻断疗法已证明具有临床疗效。然而,源于肿瘤微环境的免疫抑制性质,大多数患者对这些治疗反应不佳。因此,研究PD-L1调控的分子机制,制定提高抗PD -1/PD-L1治疗效果的策略,具有重要的临床和科学意义。
PD-L1在肿瘤细胞上的表达受多种因素的调控,包括几种翻译后修饰,如糖基化、泛素化、棕榈酰化和磷酸化。靶向PD-L1的翻译后修饰可能是抗肿瘤治疗的有效途径。因此进一步阐明与PD-L1翻译后修饰相关的效应分子,可能有助于发现癌症治疗的免疫治疗靶点。
跨膜和泛素样结构域含蛋白1 (TMUB1),也称为肝细胞奇蛋白穿梭(HOPS),是一种跨膜泛素样蛋白,最初是在再生肝脏中被发现的。越来越多的证据表明,TMUB1除了参与细胞增殖外,还是凋亡、基因组稳定性和癌症发展的重要调节因子。
TMUB1调节PD-L1并促进肿瘤的免疫逃逸
02
在这项研究中,基于乳腺癌患者肿瘤和非恶性组织的质谱数据集,研究人员发现肿瘤中PD-L1糖基化和磷酸化水平高于非恶性组织。此外,几种翻译后修饰途径被上调,表明PD-L1的翻译后修饰可能是肿瘤的一个特征和免疫治疗的有希望的靶点。
研究人员对中山大学癌症中心乳腺癌患者队列的组织样本进行的免疫组织化学(IHC)和RT-qPCR分析显示,高水平的TMUB1和PD-L1与生存率降低显着相关,患者肿瘤组织中的CD8+T细胞浸润与TMUB1的蛋白质水平呈负相关。
团队使用野生型和稳定的TMUB1敲低MDA-MB-231和MDA-MB-468乳腺癌细胞系与活化的外周血单核细胞(PBMC)共培养进行了T细胞杀伤测定。有趣的是,TMUB1敲低减弱了肿瘤细胞诱导的免疫抑制,导致T细胞介导的癌细胞死亡增加。此外,与野生型细胞共培养的PBMC相比,与TMUB1下调MDA-MB-231细胞共培养的PBMC中IFN-γ和TNF-α的表达均增加。这些结果证实了TMUB1可以增加癌细胞中的PD-L1水平并促进免疫逃避。
在机制上,TMUB1与HECT,UBA和WWE结构域的含蛋白1(HUWE1,一种E3泛素连接酶)竞争,与PD-L1相互作用并抑制其在内质网中K281处的多泛素化。此外,TMUB1通过募集STT3A增强PD-L1 N-糖基化和稳定性,从而促进PD-L1成熟和肿瘤免疫逃逸。
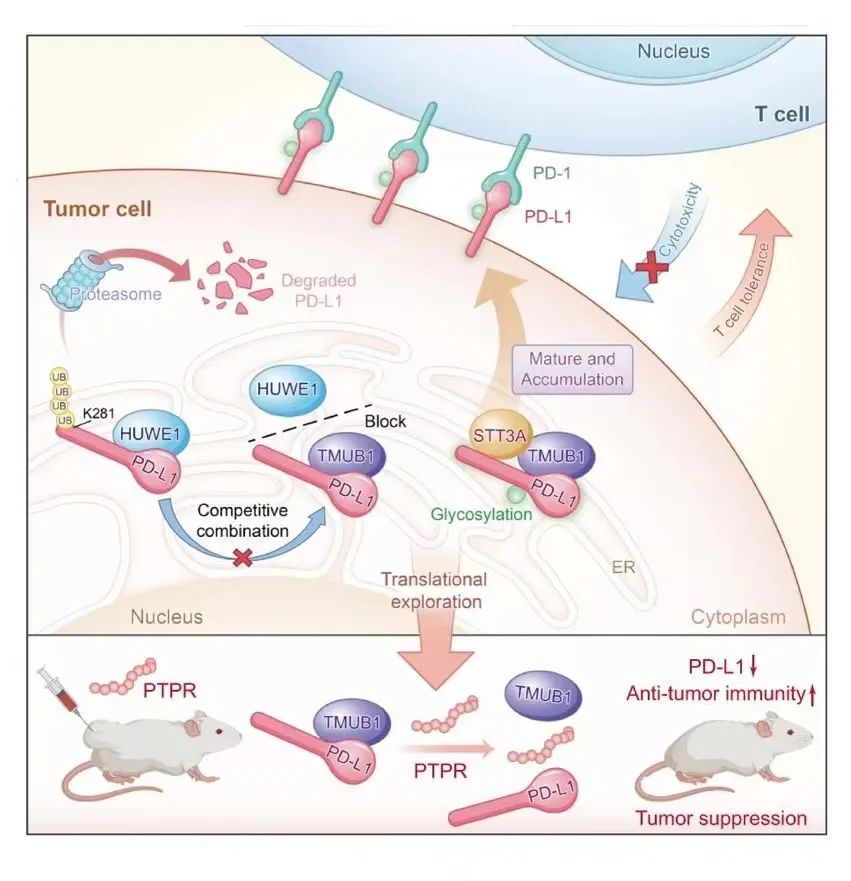
TMUB1调控PD-L1和HUWE1的模型示意图
TMUB1可作为免疫治疗潜在靶点
03
研究人员分析了在中山大学癌症中心和浙江大学第二附属医院获得的乳腺癌患者和胃癌患者组织微阵列中组织样本,发现TMUB1水平高的肿瘤表现出高水平的PD-L1。与TMUB1促进PD-L1降解的发现一致,TMUB1在癌症中的表达增加导致PD-L1积累,从而驱动癌症/肿瘤细胞从抗肿瘤免疫中逃逸。
鉴于TMUB1在PD-L1调控中的重要作用及其潜在的临床意义,研究人员探讨了基于TMUB1的治疗策略。他们开发了FITC标记PR结构域的肽,并将其指定为PTPR(TMUB1 PD-L1调控结构域的肽)。PTPR能够削弱PD-L1和TMUB1之间的结合,增强HUWE1与PD-L1的结合,进而促进了其泛素化降解,降低了TMUB1过表达引起的PD-L1蛋白水平,即对细胞表现出显著的PD-L1抑制作用。此外,在荷瘤小鼠模型中,注射PTPR的小鼠的肿瘤生长受到显著抑制。这些发现将TMUB1确定为有前途的免疫治疗靶点。
参考资料:
https://doi.org/10.1038/s41467-022-34346-x
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




