- +1
小胶质细胞通过Piezo1感知淀粉样斑块硬度限制阿尔兹海默病进程
原创 Cell Press CellPress细胞科学

生命科学
Life science
近日,厦门大学莫玮教授团队在Neuron期刊上发表了题为 “Microglial Piezo1 senses Aβ fibrils stiffness to restrict Alzheimer’s disease”的研究成果,揭示了小胶质细胞通过机械力受体Piezo1感知纤维化Aβ硬度而激活,并显著改善AD相关病理变化。
阿尔兹海默病(Alzheimer’s disease,简称AD)是老年人群中最为常见,以渐进性认知功能障碍和行为损害为特征的神经退行性疾病。AD的两个典型病理特征分别是脑中主要由淀粉样蛋白-β (Amyloid-β, Aβ) 纤维化沉积形成的淀粉样斑块和神经细胞内Tau蛋白过度磷酸化导致的神经纤维缠结。目前,AD尚缺乏切实有效的治疗药物,随着寿命的延长和社会老龄化加剧,AD将是一个亟待解决的公共医疗问题。
小胶质细胞(Microglia)是中枢神经系统的常驻固有免疫细胞,在维持大脑稳态、大脑发育以及神经退行性病理过程中起着重要作用。研究表明,许多AD风险基因座(Risk loci)在小胶质细胞中独有或在其高度表达,提示小胶质细胞与AD病理变化密切相关,甚至可挖掘重要的潜在AD治疗靶点。小胶质细胞可通过其表面受体与淀粉样斑块中Aβ等化学组分结合,从而触发小胶质细胞响应,吞噬清除Aβ淀粉样斑块。虽有研究表明体外纤维化的Aβ具有超强的硬度,但体内Aβ淀粉样斑块如何改变与之镶嵌的局部脑组织硬度并不清楚。小胶质细胞具有趋硬特性(Durotaxis),但小胶质细胞如何识别淀粉样斑块带来的物理性变化,如何因应激活以及如何最终影响AD病理进程,这些都是AD研究领域仍有待解答的问题。
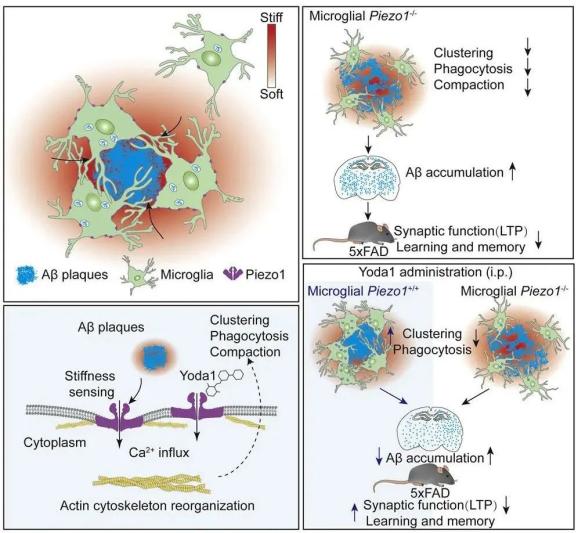
本研究利用Methoxy-X04体内标记AD小鼠脑中Aβ淀粉样斑块并结合原子力显微镜首次明确了鲜活AD小鼠脑片中Aβ淀粉样斑块相关组织机械硬度高于非Aβ淀粉样斑块组织。在体外利用软硬水凝胶系统,通过钙成像和细胞电生理实验揭示小胶质细胞通过机械力受体Piezo1感知纤维化Aβ硬度。进一步通过特异敲除小胶质细胞Piezo1加重了AD小鼠脑中Aβ累积,认知行为下降,而药物激活小胶质Piezo1则可以缓减AD相关表型。本文从机械力生物学角度揭示了小胶质细胞Piezo1介导的信号传导在AD病理过程中的保护作用,拓宽了小胶质细胞与AD病理进程紧密相关的认识,也为AD的药物研发提供了潜在的新靶点。
该论文的第一作者兼共同通讯作者为胡进博士;博士生陈强、硕士生朱泓瑞以及厦门大学附属翔安医院麻醉科侯立朝为本文共同第一作者。莫玮教授和张亮教授为本文共同通讯作者。特别感谢浙江大学国家健康和疾病人脑组织资源库为本研究提供AD人脑组织样本。本研究工作得到国家重点研发计划项目,国家自然科学基金委杰出青年基金,国家自然科学基金委青年、面上基金,等的资助和支持。
亮点
Aβ斑块增加组织的硬度
小胶质细胞通过Piezo1感知纤维化Aβ硬度,利于AD小鼠脑中Aβ的清除,减少累积
小胶质细胞Piezo1激活改善Aβ相关病理变化
作者专访
Cell Press细胞出版社公众号特别邀请莫玮教授代表研究团队接受了专访,请他为大家进一步详细解读。
CellPress:
请问您是怎么想到把小胶质细胞、机械力感知受体、阿尔兹海默症联系到一起的呢?
莫玮教授:
近年来,随着全基因组测序技术的发展和应用,有许多AD风险基因座被发现,有趣的是,大部分AD相关风险基因在小胶质细胞中独有或在其高度表达,说明小胶质细胞与AD病理变化密切相关。小胶质细胞可以通过其表面受体与淀粉样斑块中Aβ等化学组分结合,触发小胶质细胞响应,吞噬清除Aβ淀粉样斑块。有研究表明体外纤维化的Aβ是具有超强硬度的,另一方面小胶质细胞又具有趋硬特性。所以我们就想纤维化的Aβ在触发小胶质细胞响应中是否有这种物理信号在里面起作用,而细胞对这种硬度等的感知主要通过机械力受体,所以就把这三者联系起来了。
CellPress:
我们一直认为阿尔兹海默症病人的大脑与正常人相比是更柔软的,这怎么与您文章提到小胶质细胞感知病人组织硬度统一呢?
莫玮教授:
对阿尔兹海默症病病人大脑进行硬度测量,确实发现相比正常大脑,病人大脑更为柔软,原因是大量神经元死亡和相伴的脱髓鞘。我们的发现是在病人大脑的局部区域,文中描述为淀粉样斑块邻近区域,它的物理特性由于淀粉样斑块改变,变得更为刚性。
CellPress:
除了小胶质细胞,脑内的其他细胞是否也可能通过Piezo1去感知淀粉样斑块的硬度?
莫玮教授:
我们在敲除小胶质细胞Piezo1之后发现,即使再用Yoda1激活Piezo1也不能有效减少AD小鼠脑中Aβ淀粉样斑块累积,说明小胶质细胞Piezo1激活是Yoda1显著降低AD小鼠脑中Aβ淀粉样斑块累积的主要原因。先前有文献报道少突胶质前体细胞,以及星形胶质细胞也会有Piezo1表达。我们不排除脑中其他细胞比如星形胶质细胞表达的Piezo1会感知淀粉样斑块硬度的可能,那这些细胞中Piezo1对AD病理有何影响,需要进一步探索。
CellPress:
您文章中认为小胶质细胞吞噬Aβ淀粉样斑块过程中,Piezo1起到了正向调节作用,怎么解释淀粉样斑块周边小胶质细胞Piezo1高表达,但最后还是不能有效清除Aβ淀粉样斑块?
莫玮教授:
对,我们发现在Aβ淀粉样斑块周边的小胶质细胞中Piezo1表达是显著增高的,包括体外软硬胶实验,在有硬度刺激情况下Piezo1蛋白增加。这种Piezo1蛋白的增高很可能是受硬度刺激形成正反馈的一种作用结果。这提示在有机械力的刺激下,Piezo1可以被激活并引发下游细胞功能,例如吞噬。所以淀粉样斑块周边小胶质细胞中Piezo1感知不可溶性纤维化Aβ硬度刺激而发挥吞噬功能,但是另一方面也有文章报道可溶性Aβ单体或者寡聚体可以抑制Piezo1活性。我们知道淀粉样斑块周边是包含大量可溶性Aβ的,所以在前期我们认为Piezo1被激活起到了吞噬、限制淀粉样斑块,但是后期Piezo1活性是被可溶性Aβ抑制了,这可能也是淀粉样斑块周边小胶质细胞即使Piezo1高表达,但最后还是不能有效清除Aβ的一个原因。在AD小鼠模型中用Piezo1激动剂Yoda1处理确实也发现Piezo1激活是可以缓减Aβ在脑中累积。
CellPress:
我看您在文章中用到Piezo1的激动剂Yoda1处理小鼠,在您看来有希望被用到临床上缓解AD的症状吗?
莫玮教授:
目前,针对AD治疗还没有完全有效的药物问世。从我们目前的研究结果来看,Yoda1还是有一定潜力的。我们研究表明Yoda1是可以通过血脑屏障的,小鼠长期皮下给药Yoda1并没有引起明显的肝毒性,同时显著缓减AD小鼠脑中Aβ累积,并改善记忆认知。当然要作为治疗药物,我们还需要做更多,更详细的安全性验证。总之,我们的研究为AD的药物研发提供了新的潜在靶点。

作者介绍

莫玮
教授
论文通讯作者,莫玮,厦门大学生命科学学院教授,细胞应激生物学国家重点实验室副主任,课题组组长,闽江学者,博士生导师,国家杰出青年基金获得者。主要聚焦在自身和环境变化引起的炎症应激,近些年取得了一系列具有国际影响的创新成果:发现了内源性逆转录病毒(ERV)转录产物dsRNA通过核酸感应器ZBP1激活细胞坏死性凋亡和宿主炎症的新路径;阐明了神经胶质细胞分化或迁移障碍引起的中枢神经炎症的新机制;报道了阿尔兹海默病中小胶质细胞通过机械力受体Piezo1感知Aβ淀粉样斑的物理硬度,激活小胶质细胞对Aβ淀粉样斑的吞噬功能。近5年研究成果以通讯/共通讯作者分别发表在Nature (2020), Molecular cell (2020), Advanced Science (2021), Nature Communications (2022), Neuron (2022)等国际主流学术期刊。同时担任中国细胞生物学会细胞死亡分会常务委员和中国生物化学与分子生物学会基因专业分会委员等。

张亮
副教授
论文共同通讯作者,张亮,厦门大学生命科学学院博士生导师,课题组组长,副教授。主要从事神经胶质细胞和脑白质相关研究,探索脱髓鞘相关疾病的致病机理,为脑疾病诊治提供潜在靶点。近年来阐明了核孔蛋白通过在核孔周围构建转录激活复合体进而调控神经细胞发育和髓鞘生成中的生理功能与机制;发现了包被小泡所介导的少突细胞自分泌调控机制和组蛋白甲基化修饰在成体神经胶质细胞再生中的功能;揭示了小胶质细胞感受Aβ淀粉样斑块硬度进而限制阿尔兹海默病进程的功能。近5年以通讯/共同通讯作者身份在Neuron (2019), J Clin Invest (2022), Nat Commun (2022), Neuron (2022)等国际主流学术刊物上发表论文。同时担任中国研究型医院学会神经再生与修复专业委员会委员。

胡进
博士
论文第一作者兼共同通讯作者,胡进,博士,厦门大学生命科学学院工程师,主要研究方向为阿尔兹海默病等神经退行性疾病致病机理研究,研究成果以第一或通讯(包含共同)作者发表在Neuron, Molecular Neurodegeneration, Neuropharmacology, PloS One等期刊。

陈强
博士研究生
论文共同第一作者,陈强,厦门大学生命科学学院博士生,师从莫玮教授,目前从事代谢与炎症方面的研究。

朱泓瑞
博士研究生
论文共同第一作者,朱泓瑞,厦门大学医学院硕士毕业生,目前为中国科学技术大学附属第一医院麻醉学在读博士,从事重症脑保护的相关研究。

侯立朝
教授
论文共同第一作者,侯立朝,厦门大学医学院教授、博导,厦大附属翔安医院麻醉科主任、主任医师,福建省引进高层次人才,教育部高等学校麻醉学教学指导分委员会委员,在临床上擅长各种疑难危重病人的手术麻醉、急救与复苏、重症救治等,深谙脓毒症的临床表现和诊治现状;在科研上,主要从事脓毒症与围术期脏器功能保护研究,尤其聚焦中枢神经系统损伤免疫炎症机制与防治策略研究,负责并完成3项国家自然科学基金课题,发表相关文章48篇,累计引用数为1631(Neuron, 2022; Front Immunol., 2022; Molecular Neurobiology, 2022; Int J Neurosci., 2022; J Cell Mol Med., 2021; Int Immunopharmacol., 2020; Apoptosis., 2019; Shock., 2010; Shock., 2010; Shock., 2010; Shock., 2009 等)。
相关论文信息
▌论文标题:
Microglial Piezo1 senses Aβ fibril stiffness to restrict Alzheimer’s disease
▌论文网址:
https://www.cell.com/neuron/fulltext/S0896-6273(22)00954-0
▌DOI:
https://doi.org/10.1016/j.neuron.2022.10.021
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




