- +1
【学术前沿】Cancer Cell|苏士成团队揭示肿瘤成纤维细胞Fcγ受体调控单抗耐药
单克隆抗体是肿瘤靶向治疗的重要药物。单克隆抗体由抗原结合域(Fab)和恒定区(Fc)组成。单抗的Fab与肿瘤细胞结合,Fc会被Fcγ受体识别。传统认为Fcγ受体只表达于造血系统。尤其是白细胞的Fcγ 受体对单抗治疗效果起到关键作用。细胞Fcγ 受体介导作用(cellular FcγR-mediated effects)主要有三种:1)抗体依赖的细胞毒作用(ADCC):NK 细胞Fcγ 受体激活后,通过释放穿孔素和颗粒酶杀伤单抗结合的肿瘤细胞;2)抗体依赖的细胞吞噬(ADCP):巨噬细胞Fcγ 受体激活后,吞噬与单抗结合的肿瘤细胞;3)树突状细胞通过 Fcγ 受体摄取免疫复合物,进而提呈肿瘤抗原并激活抗肿瘤特异免疫【1-4】。
值得注意的是,近期研究发现一些非白细胞也会表达Fcγ受体。例如,小鼠感觉神经元表达I型Fcγ受体,介导类风湿关节炎相关疼痛【5】;肝脏内皮窦状细胞表面的II型Fcγ受体影响循环免疫复合物的清除【6】。然而目前对肿瘤微环境中非白细胞表达Fcγ受体未见报道。
2022年11月14日,中山大学孙逸仙纪念医院苏士成(曾获2021年中国细胞生物学学会青年科学家奖)团队在Cancer Cell杂志上发表题为CD16+ Fibroblasts Foster a Trastuzumab-Refractory Microenvironment That is Reversed by VAV2 Inhibition的研究成果,该研究鉴定出一群表达III型Fcγ受体(CD16)的成纤维细胞亚群,首次报道促癌的Fcγ受体信号。揭示成纤维细胞Fcγ受体激活后收缩胶原,阻碍药物递送导致单抗治疗耐药。

研究者应用全光谱流式分析技术,对新鲜人乳腺癌标本中表达Fcγ受体细胞图谱分布进行检测。与预期一致的是表达Fcγ受体的主要是CD45+的白细胞。令人意外的是,一部分表达CD32b/c (IIb/IIc型Fcγ受体) 和 CD16的细胞是CD45-的非白细胞。通过流式细胞术、免疫荧光等技术,研究者进一步确证CD32b/c+的非白细胞是肿瘤细胞,而表达CD16的CD45-细胞是一个新的成纤维细胞亚群(图1)。CD16+成纤维细胞数目只在HER2+乳腺癌患者中与不良预后相关,并和抗HER2单抗(曲妥珠单抗)治疗耐药相关。
在此基础上,研究者从乳腺癌患者肿瘤标本中分离CD16+成纤维细胞,建立了人源性肿瘤异种移植 (Patient-derived tumor xenograft, PDX) 模型、肿瘤细胞与成纤维细胞的共注射小鼠模型,发现CD16+成纤维细胞能够导致曲妥珠单抗治疗耐药。鉴于成纤维细胞在肿瘤结缔组织增生 (desmoplasia) 中起到关键作用,研究者应用原子力显微技术对患者乳腺癌新鲜标本的弹性模量进行测定,发现曲妥珠单抗耐药患者的肿瘤硬度更大,而CD16+ 成纤维细胞的浸润数目与组织硬度显著正相关。并且在曲妥珠单抗治疗后,CD16+ 成纤维细胞与肿瘤细胞间的平均距离明显缩短。
在移植瘤模型中,研究者观察到CD16+ 成纤维细胞能够在曲多珠单抗治疗后产生胶原纤维和透明质酸等细胞外基质,抑制肿瘤组织的血管灌注。应用3D荧光显微成像技术,发现CD16+ 成纤维细胞阻碍了肿瘤组织中曲妥珠单抗及其与化疗联合用药时化疗药物的递送 (图1)。研究者进一步借助敲入人HER2基因、能够耐受人HER2蛋白的ErbB2+转基因小鼠模型还原体内研究模型的真实微环境。发现在曲妥珠单抗的母药鼠抗人HER2单抗——4D5的作用下,CD16+ 成纤维细胞还能够抑制NK和CD8+T细胞浸润,最终导致治疗耐药。
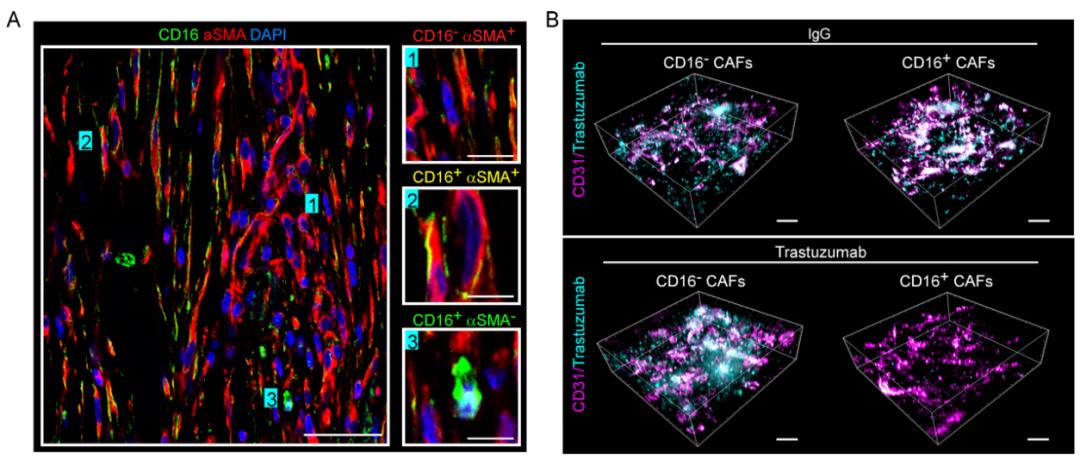
图 1部分实验结果:(A)人乳腺癌组织切片免疫荧光染色显示CD16+ 成纤维细胞;(B)3D荧光显微成像技术显示CD16+ 成纤维细胞抑制单抗递送。
既往研究表明Fcγ受体胞内段能够与SYK相互作用,从而激活VAV蛋白家族【7】。在线蛋白组数据库数据显示,VAV1和VAV3主要分布在造血系统细胞中。有趣的是,VAV2 在造血系统细胞的表达量不高、反而在成纤维细胞中高表达。在肿瘤与成纤维细胞共注射小鼠模型中,VAV2敲除能够抑制单抗治疗下CD16+ 成纤维细胞介导的肿瘤结缔组织增生、逆转单抗治疗耐药。进一步应用成纤维细胞体外三维荧光培养模型,研究者发现敲除VAV2能够阻止单抗与成纤维细胞CD16作用产生的下游信号,但却不会对巨噬细胞和NK细胞的ADCP和ADCC抗肿瘤作用产生影响。因此,靶向VAV2能够特异性阻止单抗治疗下Fcγ受体的促癌信号,而不干扰免疫细胞Fcγ受体介导的抗肿瘤作用。
总的来说,本研究首次报道非白细胞表达Fcγ受体在肿瘤微环境中的作用,揭示了第一种促癌的Fcγ 受体介导作用,并提出特异靶向促癌Fcγ信号又不影响抑癌Fcγ信号的治疗靶点(图2)。
成纤维细胞是肿瘤微环境中数量最丰富的间质细胞,是肿瘤进展的重要参与者。但无差别耗竭成纤维细胞反而促进肿瘤进展【8,9】。宋尔卫院士和苏士成团队前期研究发现肿瘤微环境中 CD10+GPR77+ CAF新亚群,该亚群通过改变肿瘤干细胞微环境维持肿瘤细胞干性,引起化疗抵抗【10】。该研究进一步阐明了恶性肿瘤成纤维细胞的亚群多样性及其功能,对于发展靶向成纤维细胞的新型治疗方案有重要意义。
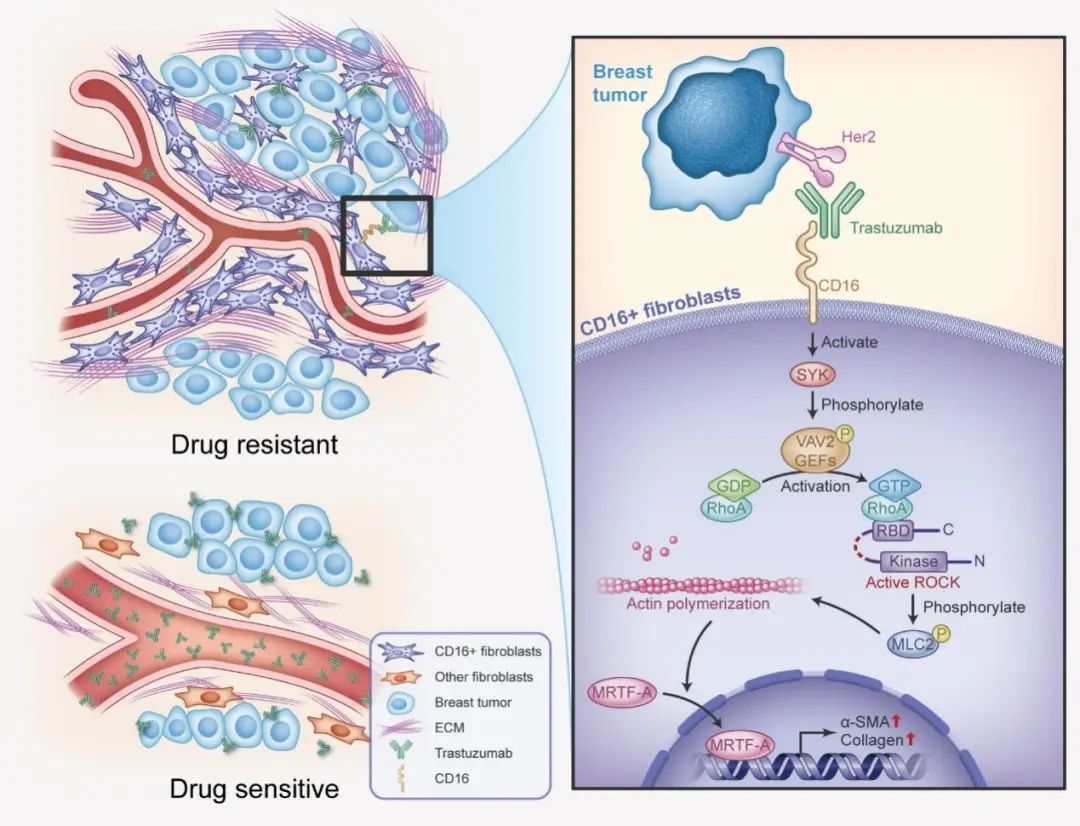
图 2 研究机制示意图
苏士成教授为本研究的通讯作者,刘馨蔚、陆艺文、黄静颖、邢悦为该论文的共同第一作者。
原文链接:
https://doi.org/10.1016/j.ccell.2022.10.015
参考文献
1. Chen, J., et al., PI3K/AKT inhibition reverses R-CHOP resistance by destabilizing SOX2 in diffuse large B cell lymphoma. Theranostics, 2020. 10(7): p. 3151-3163.
2. Li, C., et al., BCMab1, a monoclonal antibody against aberrantly glycosylated integrin alpha3beta1, has potent antitumor activity of bladder cancer in vivo. Clin Cancer Res, 2014. 20(15): p. 4001-13.
3. Liu, G. and H. Yang, Modulation of macrophage activation and programming in immunity. J Cell Physiol, 2013. 228(3): p. 502-12.
4. Shang, Y., et al., Systematic immunohistochemical analysis of the expression of CD46, CD55, and CD59 in colon cancer. Arch Pathol Lab Med, 2014. 138(7): p. 910-9.
5. Bersellini Farinotti, A., et al., Cartilage-binding antibodies induce pain through immune complex–mediated activation of neurons. 2019. 216(8): p. 1904-1924.
6. Anderson, C.L., L.P. Ganesan, and J.M.J.I.R. Robinson, The biology of the classical Fcγ receptors in non‐hematopoietic cells. 2015. 268.
7. Chen, C.H., et al., Two closely spaced tyrosines regulate NFAT signaling in B cells via Syk association with Vav. Mol Cell Biol, 2011. 31(14): p. 2984-96.
8. Chen, F., et al., New horizons in tumor microenvironment biology: challenges and opportunities. BMC Med, 2015. 13: p. 45.
9. Chen, X. and E. Song, Turning foes to friends: targeting cancer-associated fibroblasts. Nat Rev Drug Discov, 2019. 18(2): p. 99-115.
10. Su, S., et al., CD10(+)GPR77(+) Cancer-Associated Fibroblasts Promote Cancer Formation and Chemoresistance by Sustaining Cancer Stemness. Cell, 2018. 172(4): p. 841-856 e16.
(可上下滑动阅览)
原标题:《【学术前沿】Cancer Cell|苏士成团队揭示肿瘤成纤维细胞Fcγ受体调控单抗耐药》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




