- +1
【学术前沿】PNAS | 杨硕/胡刚/王冰微发现焦亡效应分子GSDMD调控炎症小体激活新机制
炎症是机体免疫系统产生的一种保护效应,在对抗机体感染,清除体内异物,以及对局部组织损伤进行修复等过程中都有重要作用。然而,失控过度活化的炎症反应会对机体造成炎症病理损伤,引起一系列炎症性疾病发生【1】。因此,健康机体需要对免疫炎症进行精确调控,以防炎症过度反应。在不断进化过程中,机体免疫系统已产生许多负反馈调控机制对炎症进行精准及时调控,如IkB抑制NF-κB炎症通路【2】,A20抑制TRAF6信号通路【3】,SOCS3抑制JAK2/STAT3炎症通路等【4】。
炎症小体是机体免疫系统中重要的固有免疫炎症蛋白质机器,参与对病原的宿主免疫防御反应。同时,炎症小体也与众多无菌性慢性炎症疾病发生密切相关【5】。炎症小体是目前各类炎症性疾病研究的热点,也是治疗炎症相关疾病可能的潜在重要靶点。因此,解析炎症小体激活的调控机制对防治炎症性疾病发生具有重要意义,然而,是否像其他炎症反应通路炎症小体激活也存在精密高效的负反馈调控机制目前尚不可知。
2022年11月 2日,南京医科大学杨硕课题组和南京中医药大学胡刚/王冰微课题组合作,在PNAS杂志发表题为The Gasdermin D N-terminal fragment acts as a negative feedback system to inhibit inflammasome-mediated activation of Caspase-1/11 的研究论文,该研究揭示了固有免疫细胞焦亡效应分子GSDMD负反馈调控炎症小体激活的新作用和分子机制,为靶向炎症小体Caspases抗炎药物开发提供了新线索。

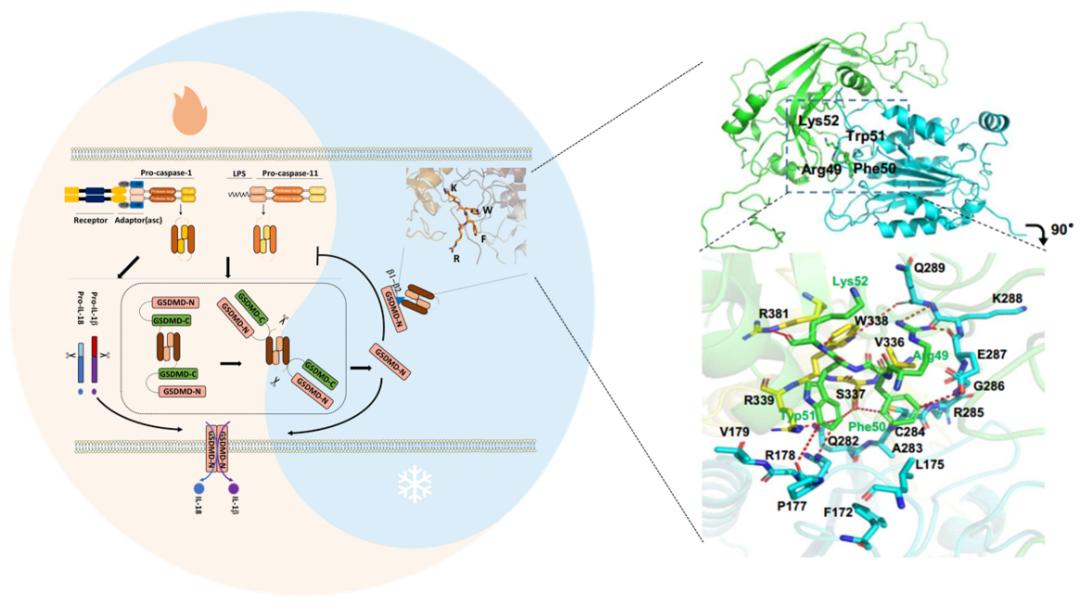
Gasdermin D(GSDMD),是2015年发现的炎症小体下游介导巨噬细胞焦亡的关键效应因子。在病原或体内危险信号刺激下,炎症小体可激活切割GSDMD分子,产生的N端片段随后变构寡聚并与细胞膜结合,在质膜表面形成焦亡小孔,进而引发细胞炎性死亡【6-8】。GSDMD蛋白的发现为炎症性疾病研究开启了新的方向,目前已发现GSDMD在抗病原感染,慢性炎症疾病发生以及肿瘤免疫中均发挥着重要作用【9,10】。GSDMD蛋白结构目前已经解析,多个重要功能结构域和基序已被鉴别,如β1-β2 loop,α1 helix和β3-8sheet等【11,12】,这些结构发挥着重要和复杂的生物学功能。
在本项研究中,研究人员通过骨髓来源巨噬细胞(BMDM)炎症小体激活实验,意外发现焦亡效应分子GSDMD缺失后炎症小体激活显著增强,提示GSDMD可能负反馈调控上游炎症小体激活。随后研究人员采用HEK293T过表达系统和永生化iBMDMs稳定表达细胞,进一步证实GSDMD活化产生的 N 端片段可特异性抑制炎症小体蛋白酶Caspase-1/11激活,进而发挥负反馈调节作用。接下来,研究人员构建了GSDMD N端髓系特异性敲入小鼠,通过小鼠多发硬化症模型等实验在体内水平验证了GSDMD N端片段负反馈抑制效应。研究人员还运用多种分子对接结构分析方法,发现GSDMD N端β1-β2环区段RFWK基序可通过疏水键和氢键等结合Caspase-1/11 酶L1-L4口袋,进而干扰Caspase酶催化活性中心。随后通过点突变GSDMD KO iBMDMs细胞恢复实验,体外重组蛋白GST-Pulldown实验以及Caspase-1/11蛋白酶切实验等,对这一功能基序进行了验证。最后,研究人员基于RFWK抑制基序设计了小分子多肽抑制药物,在体内外水平进一步确证了RFWK多肽抑制剂对Caspase-1/11酶的抑制作用。
综上,该研究首次揭示了炎症小体下游的负反馈调控机制,发现焦亡效应分子GSDMD可通过活化产生的N端片段β1-β2环RFWK基序作用Caspase-1/11酶催化中心,进而控制炎症小体Caspase 的过度激活和炎症反应发生。因此,该研究拓展了我们对GSDMD 蛋白功能的认识,为靶向炎症小体Caspases的抗炎药物开发提供了新线索。
模型图:GSDMD通过N端片段RFWK基序负反馈抑制炎症小体Caspases活化
南京医科大学姑苏学院博士后胡颖超,生殖医学国家重点实验室和基础医学院博士研究生姜玉莹和已毕业博士研究生李晟为本文的共同第一作者,南京医科大学杨硕教授和南京中医药大学胡刚教授、王冰微教授为本文的共同通讯作者。
原文链接:
https://doi.org/10.1073/pnas.2210809119
博士后招聘:
南京医科大学杨硕教授课题组近年主要从事固有免疫与炎症性疾病发生及其干预靶标发现的研究工作,相关工作以通讯作者在Mol Cell(2020)、J. Exp. Med(2019,2021)、Sci Adv(2020)、PNAS (2022) 和Cell Rep(2022)等期刊上发表,并被F1000推荐,专题收录。课题组现公开招聘从事免疫、神经和药物结构相关研究的博士后研究人员1-2名。博后在站期间,将享受南京医科大学良好薪酬待遇,并有很好职业上升空间(出站竞聘副研究员/副教授)。
简历投递(有意者请将个人简历、科研水平证明等材料以PDF文档发至):https://jinshuju.net/f/ZqXwZt
参考文献
1. Netea, M.G., et al., A guiding map for inflammation. Nat Immunol, 2017. 18(8): p. 826-831.
2. Peng, B., et al., Defective feedback regulation of NF-kappaB underlies Sjogren's syndrome in mice with mutated kappaB enhancers of the IkappaBalpha promoter. Proc Natl Acad Sci U S A, 2010. 107(34): p. 15193-8.
3. Shembade, N., A. Ma, and E.W. Harhaj, Inhibition of NF-kappaB signaling by A20 through disruption of ubiquitin enzyme complexes. Science, 2010. 327(5969): p. 1135-9.
4. Carow, B. and M.E. Rottenberg, SOCS3, a Major Regulator of Infection and Inflammation. Front Immunol, 2014. 5: p. 58.
5. Davis, B.K., H. Wen, and J.P. Ting, The inflammasome NLRs in immunity, inflammation, and associated diseases. Annu Rev Immunol, 2011. 29: p. 707-35.
6. Shi, J., et al., Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature, 2015. 526(7575): p. 660-5.
7. Kayagaki, N., et al., Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature, 2015. 526(7575): p. 666-71.
8. Ding, J., et al., Pore-forming activity and structural autoinhibition of the gasdermin family. Nature, 2016. 535(7610): p. 111-6.
9. Orning, P., E. Lien, and K.A. Fitzgerald, Gasdermins and their role in immunity and inflammation. J Exp Med, 2019. 216(11): p. 2453-2465.
10. Gao, J., et al., Downregulation of GSDMD attenuates tumor proliferation via the intrinsic mitochondrial apoptotic pathway and inhibition of EGFR/Akt signaling and predicts a good prognosis in nonsmall cell lung cancer. Oncol Rep, 2018. 40(4): p. 1971-1984.
11. Liu, Z., et al., Crystal Structures of the Full-Length Murine and Human Gasdermin D Reveal Mechanisms of Autoinhibition, Lipid Binding, and Oligomerization. Immunity, 2019. 51(1): p. 43-49 e4.
12. Xia, S., et al., Gasdermin D pore structure reveals preferential release of mature interleukin-1. Nature, 2021. 593(7860): p. 607-611.
(可上下滑动阅览)
原标题:《【学术前沿】PNAS | 杨硕/胡刚/王冰微发现焦亡效应分子GSDMD调控炎症小体激活新机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




