- +1
葛均波/李华团队:HIFs在心血管疾病中的分子基础和临床意义
原创 Cell Press CellPress细胞科学

生命科学Life science
近日,复旦大学附属中山医院葛均波院士/李华研究员团队在Cell Press细胞出版社期刊Trends in Molecular Medicine以封面文章的形式发表了题为“Molecular basis and clinical implications of HIFs in cardiovascular diseases”的综述。该文系统地总结了以缺氧诱导因子(hypoxia-inducible factors, HIFs)为核心的时空调控网络,详细归纳了心血管疾病中HIFs的临床意义,并提出基于HIFs动态平衡和转换的心血管治疗新策略。该研究入选Trends in Molecular Medicine 2022年11月刊封面论文。
氧气在不同的组织和器官中精细调控以维持机体的稳态。作为心脏在细胞水平上最基本的功能单位,心肌细胞依靠微血管输送氧气和营养物质来维持心脏的正常功能。在缺氧条件下,HIFs是氧平衡时空调节的关键分子。在急性/慢性心肌病变中,HIFs体现出这种时空特异性及潜在治疗靶点。众所周知,成年后心肌缺乏完全再生的能力,而这又是长期以来临床治疗心肌损伤的瓶颈。因此,精准调控HIFs(考虑其动态平衡和转化)并以此开发靶向药物或是一种极具吸引力的心脏保护疗法,其可能减轻心肌缺血和缺氧损伤,减缓心肌重构和心力衰竭,促进心脏功能恢复。
HIFs诱导的心肌适应性改变
在缺氧微环境中,心肌细胞和癌细胞在能量的初始动员上有很高的相似性:HIF-α介导的糖酵解使细胞以相对较小的代价及时获得储备能量的供应。然而,虽然这种能量动员在癌细胞中可以维持(通过PI3K和c-Myc等),但心肌细胞在长时程的这种应激中会进入不可逆的衰亡进程,包括能量生产效率下降、细胞内酸化、糖原和脂质的积累以及病理性肥厚的恶化。此外,当HIF-α介导的糖酵解途径被抑制时,氨基酸代谢拥有为心肌细胞提供能量的潜力。
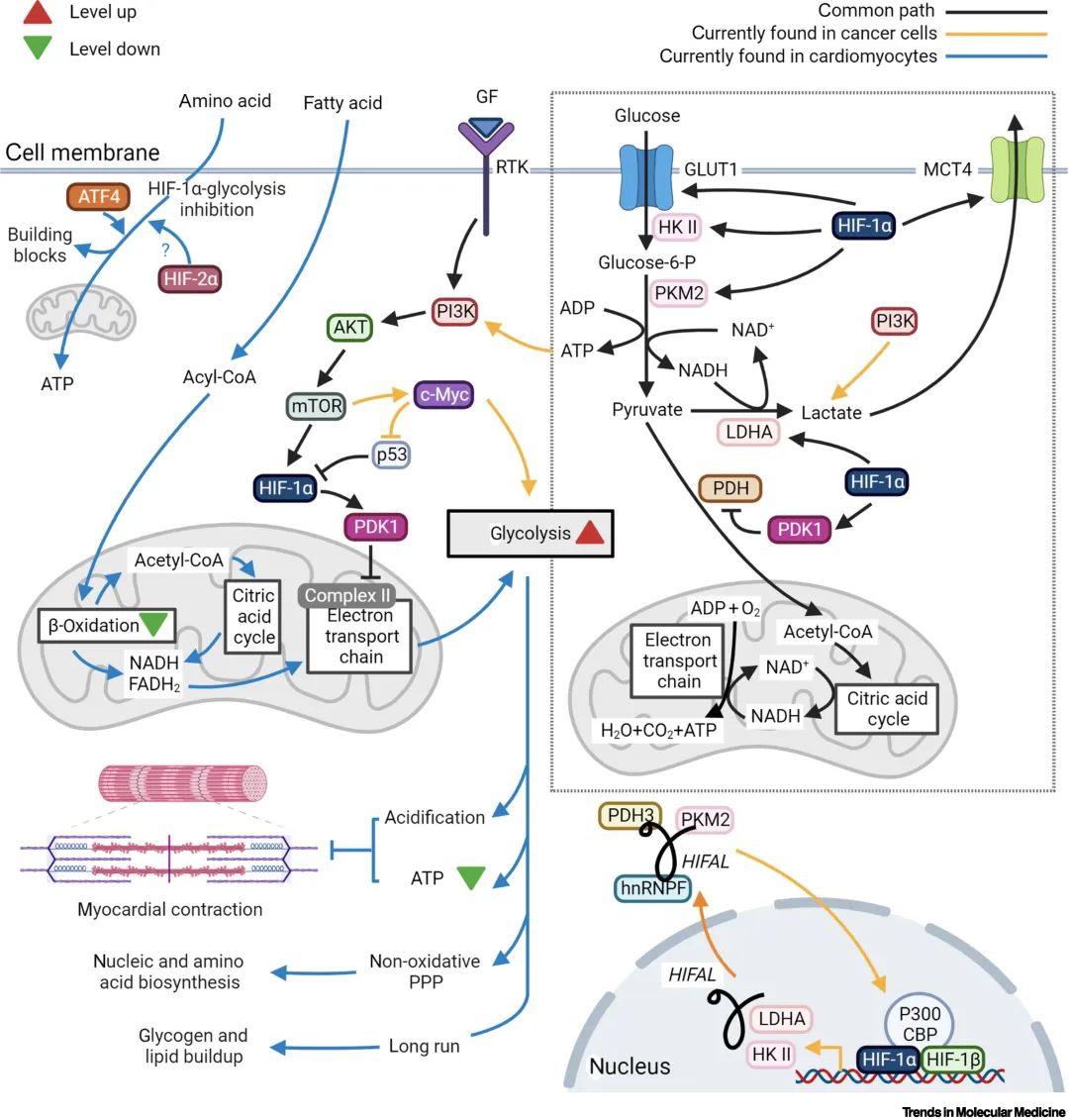
▲图1. 心肌和癌症细胞中HIF 诱导的适应性改变
HIFs在急性心肌损伤中的作用
昼夜节律和远端肢体缺血预处理(remote ischemic preconditioning,RIPC)均被观察到与急性心梗有关联,存在心肌保护的治疗靶点。对于昼夜节律而言,HIFs和昼夜节律似乎拥有双向反馈环路。一般而言,随着缺氧程度的增加,昼夜节律会减慢,其波动幅度会降低。其中,HIF-1、PER1/CRY1和BMAL1/CLOCK这三个复合体是双向反馈回路中的重要节点。除昼夜节律,氧化代谢、糖酵解和血管新生在这个反馈环路中也都有所涉及。稳定HIF-1α信号以抑制生物钟扰动可能有助于改善心脏病发作患者的预后。对于RIPC而言,下肢缺血预处理的心脏保护作用是通过神经-体液途径实现的。其前期产生的保护性因子似乎具有较低的种属异质性,因而具有物种间的广泛保护作用。值得注意的是,RIPC的心脏保护作用发生在治疗后24小时,归类为晚期保护。
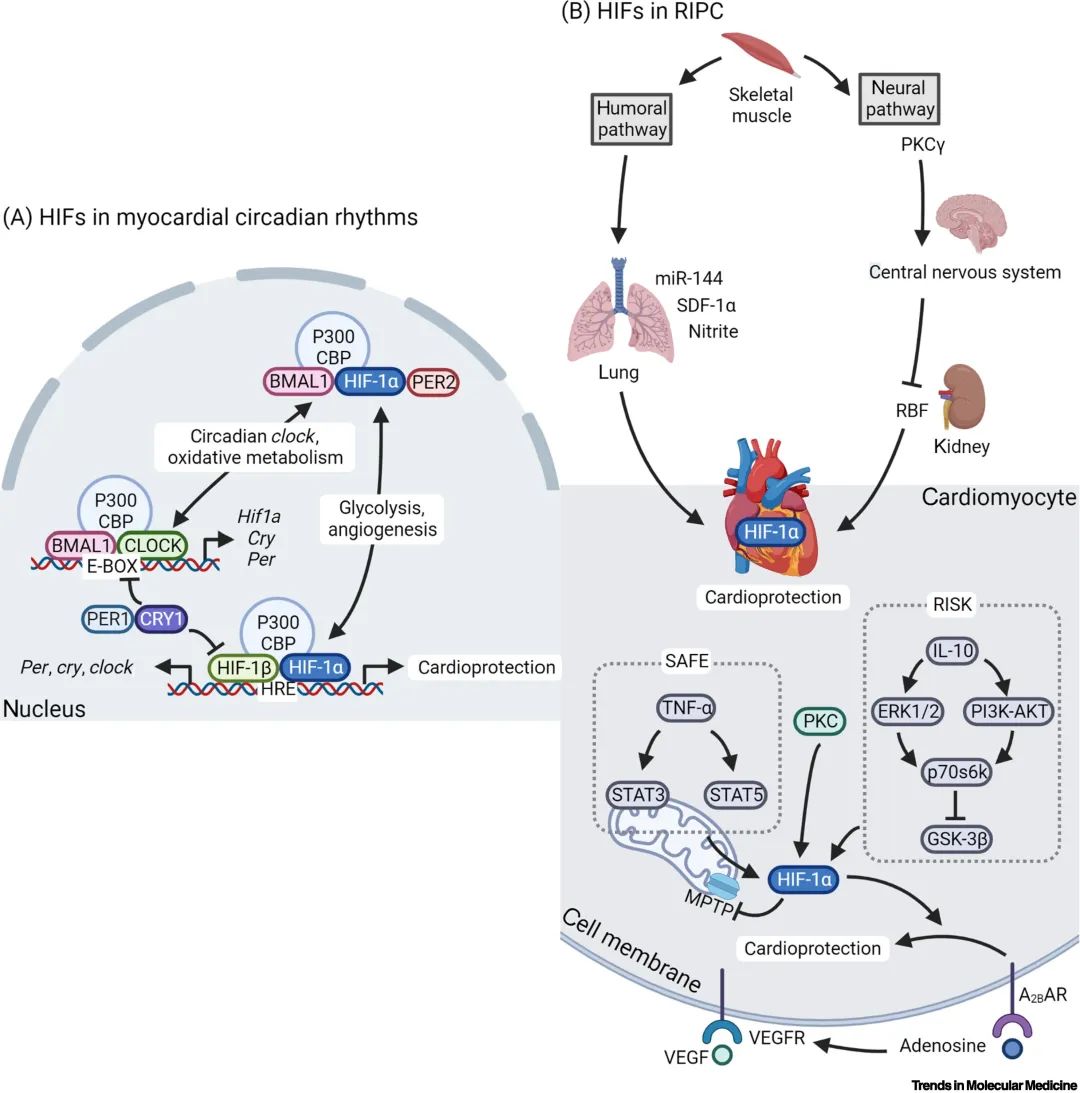
▲图2. 急性心肌损伤中HIF的作用
HIFs在慢性心肌重构中的作用
心肌肥厚往往是心功能代偿性降低的早期表型,而心肌纤维化往往与心肌肥厚相伴随。这些都与HIFs息息相关。对于心肌肥厚而言,其初期代偿性的HIF-1α诱导的VEGF升高以及随之而来的血管新生将支持其肥厚心肌发挥功能,而后期HIF-1α的维持疲软,再加上其他生理性VEGF生成途径的阻遏(如PGC-1α)导致其血管新生乏力,同时助长了NFAT, GATA4 和MEF2复合体的促心肌肥厚效应。心肌周围血管新生(特别是微循环的支持)与心肌肥厚程度的不匹配性是病理性心肌肥厚进展的重要原因。对于心肌纤维化而言,心肌本身的作用和其与微环境的交互作用都值得关注。心肌的HIF-1α和TGF-β可能共同作用导致心肌纤维化。而心肌分泌的因子(Neat1等)和心肌损伤后释放的DAMPs分别在HIF-2α和HIF-1α的介导下参与到心肌纤维化中。除了基本的结构功能外,心肌的电生理功能亦受到HIFs的影响。HIF-1α诱导心肌膜电位下降和促进细胞内钙的释放以减少兴奋-收缩偶联所需的能量消耗。这可能以牺牲较小的心肌搏动幅度为代价换取心肌搏动频率的增加以维持心脏功能。值得注意的是,抑制心肌跳动有助于受损的心脏功能的恢复。然而,从长远来看,乳酸的积累和心肌细胞的酸化会导致这种代偿作用的丧失(失代偿)。同时,不适当的再灌注会之事NF-κB参与到HIF-1α的网路中来,可能导致心脏电生理紊乱。
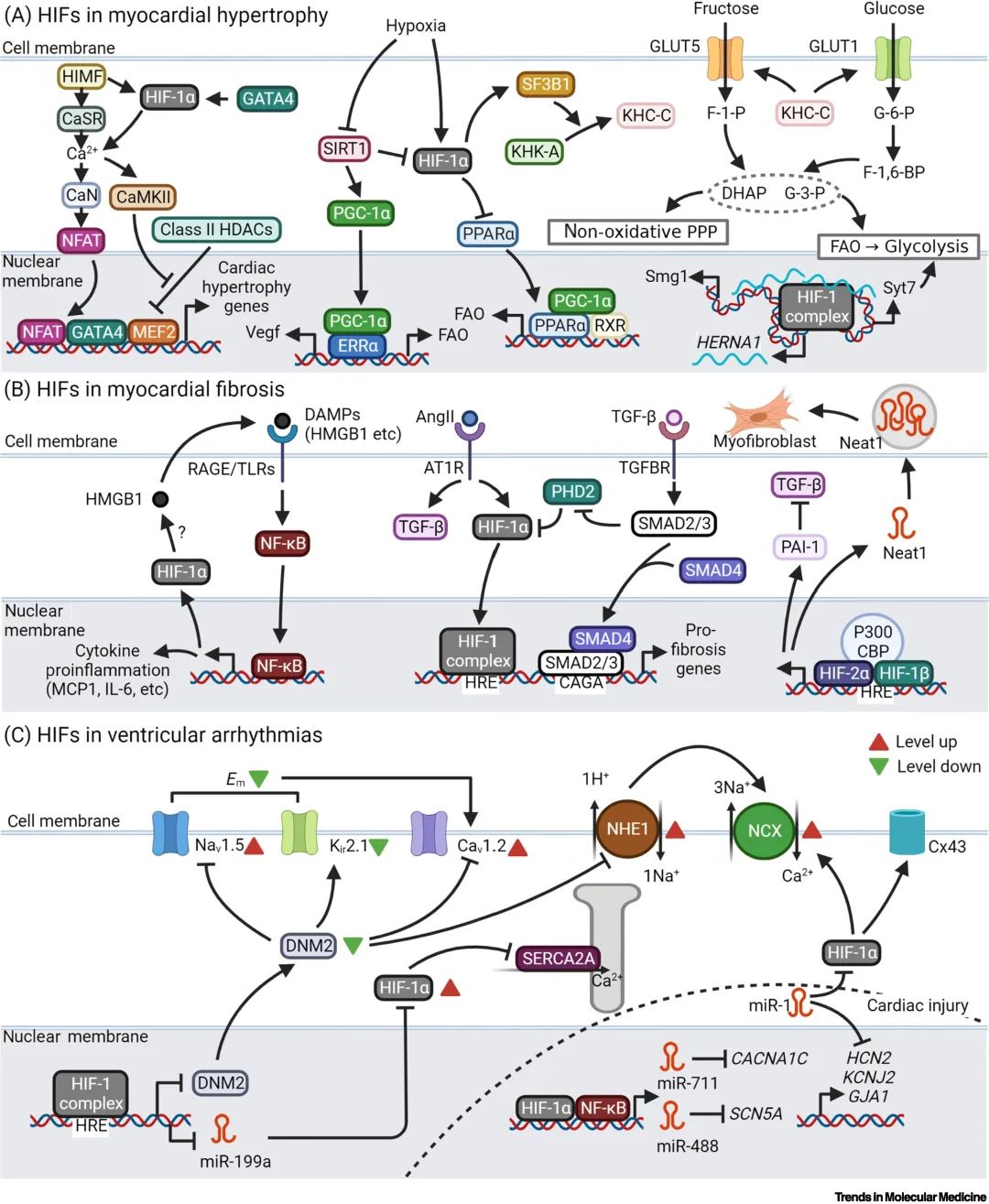
▲图3. 慢性心肌重构中HIF的作用
总结与展望
总之,在不同的生理或病理条件下,不同组织的基本氧张力不同,细胞对于氧反应也相应不同。从组织器官上升到机体层面,生理环境下全身性适度的激活HIFs或可改善心脏功能,减缓机体老化。此外,根据HIFs的互作网络及其时空特异性设计药物和其他干预措施,也将有可能研发出新的心肌治疗方法。当然,我们也要考虑对人的整体性影响。由于药物本身的原因,关注其系统性、个体化的不良反应非常有必要,也就是说,心肌对HIF的反应必须考虑到患者个体化。总的来说,精准区分HIF途径的异构体特异性(包括异构体之间的转换)、背景特异性和细胞特异性作用,可能有助于获得更清晰的临床转化策略。在这个过程中,疾病的不同阶段也应该被考虑在内,以获得更精确和有效的HIF靶向治疗和临床方案。复旦大学附属中山医院心内科博士研究生胡亦清、副主任医师陆浩是本文的共同第一作者,李华研究员、葛均波院士为本文共同通讯作者。

相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Molecular Medicine,
▌论文标题:
Molecular basis and clinical implications of HIFs in cardiovascular diseases
▌论文网址:
https://www.cell.com/trends/molecularm-edicine/fulltext/S1471-4914(22)00235-0
▌DOI:
https://doi.org/10.1016/j.molmed.2022.09.004
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




