- +1
【学术前沿】Cell Stem Cell封面文章 | 程涛/程辉/周波/刘兵合作揭示人造血干细胞最…
造血干细胞(hematopoietic stem cell,HSC)位于造血级联的顶端,具有长期自我更新和多向分化的潜能,能产生所有血液细胞类型,维系机体功能。虽然HSC的发生过程在斑马鱼和小鼠等动物模型被充分揭示,但由于研究技术的缺乏和研究材料的稀缺,目前对人类早期胚胎造血发育的认识仍十分有限。有研究通过异种移植实验表明,HSC最早出现在胚胎卡内基阶段(Carnegie stage,CS)14(妊娠后32天,第5周)的主动脉-性腺-中肾(aorta–gonad–mesonephros,AGM)区域【1】。随后HSC被释放到循环血液中,最早在CS17(妊娠后41天,第7周)迁移到胎肝进行扩增和/或分化【2】。然而HSC何时定植到骨髓和脾脏,目前缺乏功能学证据。造血微环境又称作造血干细胞龛(niche),由多种细胞及其产生的细胞外黏附分子和细胞因子构成。Niche细胞通过分泌重要的细胞因子如CXCL12和SCF来调节HSC的功能【3】。然而,在胚胎时期的骨髓中,参与HSC定植和维持的微环境成分及其调控机制仍有待阐明。
2022年11月3日,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛(中国细胞生物学学会干细胞生物学分会副会长)教授/程辉研究员团队与中国科学院分子细胞科学卓越创新中心周波研究员、解放军总医院第五医学中心刘兵教授合作在Cell Stem Cell期刊在线发表了题为 Uncovering the emergence of HSCs in the human fetal bone marrow by single cell RNA-seq analysis 的研究论文。该研究在国际上率先阐明了人胚骨髓中第一波HSC的定植时间点、分子特征及其与微环境细胞的相互作用,揭示了HSC在人胚骨髓中定植的机制,并为未来HSC发育的研究提供了宝贵的资源。该研究被选为Cell Stem Cell杂志封面故事。

该研究首先利用高通量10x Genomics单细胞转录组测序解析了人类胚胎骨髓(10-14周)和脾脏(12-14周)造血干/祖细胞 (HSPC) 及其造血微环境群体。在骨髓和脾脏中均检测到了免疫表型和转录组定义的HSC/多潜能祖细胞(MPP)。然而通过免疫缺陷鼠移植实验进一步证实,真正具有长期多系造血重建能力的HSC直到12周才出现在骨髓中,相反,12-14周的脾脏均未检测到功能性的HSC。为了阐明最早定植于胚胎骨髓的HSC分子特征,进一步整合多个发育阶段的HSC/MPP单细胞测序数据。发现与成体骨髓中的HSC/MPP相比,胎髓HSC/MPP高表达cell-ECM互作的基因,并且在早期胚胎骨髓(10-14周)的HSC/MPP中表现更为显著,提示该过程可能参与HSC的骨髓定植。该时期的HSC/MPP细胞周期更活跃,而中期胚胎骨髓(17-22周)的HSC/MPP则处于相对静息状态,并且表达和激活更多与HSC干性维持相关的转录因子,提示早期胚胎骨髓HSC/MPP的功能活性低于中期。
此外,研究发现HSC定植骨髓前后,niche细胞类型以及转录组并无显著差异,提示HSC定植骨髓前其niche已经建立。进一步,利用受配体基因互作分析揭示了aEC (arteriolar endothelial cells)和CAR细胞 (CXCL12-abundant reticular cells)是支持HSC功能的重要niche细胞。这两类细胞高表达PTN、DLK1、IGF1、JAG1和CXCL12等多种造血支持因子。体外共培养实验也证明CAR细胞来源的PTN能维持HSC/MPP的功能。为系统探究胚胎到成体发育过程中微环境细胞的变化特征,将胚胎骨髓发育早期(10-12周)和已发表的胚胎骨髓发育中期(16-19周)及成体骨髓的niche细胞的单细胞测序数据进行整合分析。发现CAR细胞在发育过程中呈现阶段性的转录组变化,胚胎和成体骨髓来源的CAR细胞分别表达阶段特异性的细胞因子,提示不同发育阶段的HSC可能受到来自niche的不同因子的调控。
最后,为了进一步解析HSC为何优先选择定植于骨髓而非脾脏,利用受配体基因互作分析揭示胎肝来源的HSC与骨髓和脾脏来源的基质细胞、内皮细胞等微环境群体之间潜在的细胞间相互作用。发现骨髓niche细胞相比于脾脏,表达更多支持HSC迁移、维持和扩增的关键信号,提示人胚胎骨髓为HSC定植提供了更优良的“土壤”。
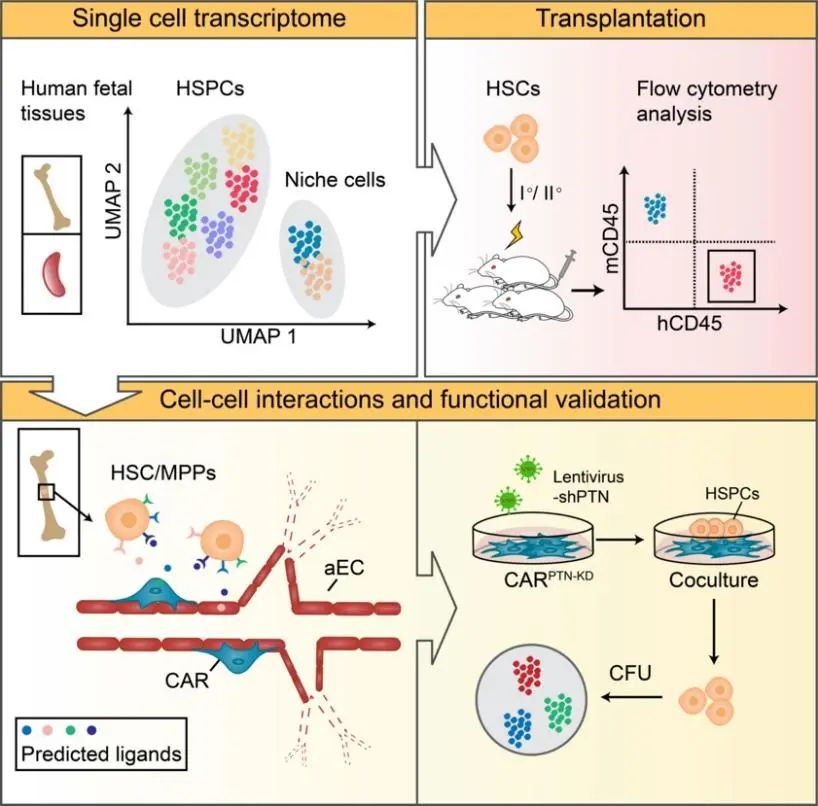
总之,该研究在国际上率先证实了HSC最早定植骨髓的时间点,填补了该领域的空白,剖析了人胚胎HSC和骨髓及脾脏微环境细胞的转录组景观图,预测了可能参与HSC骨髓定植的关键因子,为HSC发育的研究提供丰富的参考数据,同时也为临床造血干细胞移植后归巢提供了重要启示。
中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授和程辉研究员,中国科学院分子细胞科学卓越创新中心周波研究员以及解放军总医院第五医学中心刘兵教授为共同通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)博士生郑昭烽、暨南大学博士生贺涵、中国科学院分子细胞科学卓越创新中心博士生唐新宇、陆军军医大学博士生张晗、天津医科大学博士生苟芳琳以及天津市中心妇产科医院杨华主任为并列第一作者。
原文链接:
https://doi.org/10.1016/j.stem.2022.10.005
参考文献
1.Ivanovs A, Rybtsov S, Welch L, Anderson RA, Turner ML, Medvinsky A. Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region. J Exp Med. Nov 21 2011;208(12):2417-2427.
2.Ivanovs A, Rybtsov S, Ng ES, Stanley EG, Elefanty AG, Medvinsky A. Human haematopoietic stem cell development: from the embryo to the dish. Development. Jul 1 2017;144(13):2323-2337.
3.Crane GM, Jeffery E, Morrison SJ. Adult haematopoietic stem cell niches. Nat Rev Immunol. Sep 2017;17(9):573-590.
原标题:《【学术前沿】Cell Stem Cell封面文章 | 程涛/程辉/周波/刘兵合作揭示人造血干细胞最早定植骨髓的时间点和微环境特征》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




