- +1
浙大吕志民/中国医学科学院赫捷研究确定克服免疫检查点抑制剂耐药的联合疗法
原创 转网 转化医学网

本文为转化医学网原创,转载请注明出处
作者:Jevin
导读:2020年8月27日,温州医科大学检验医学院吕建新团队与浙江大学转化医学研究院吕志民团队在《Journal of Experimental Medicine》上在线发表了研究论文,该研究发现了GBM中激活异常的AKT/β-catenin信号会导致免疫检查点分子PD-L1表达水平升高并造成肿瘤免疫逃逸,基于该研究结果,研究人员使用AKT抑制剂MK2206与PD-1抗体联合用药治疗小鼠GBM模型,发现联合用药对GBM模型的治疗效果远好于单药治疗。2022年8月24日,浙江大学转化医学研究院/附属第一医院吕志民教授团队在《Cell Metabolism》杂志在线发表了研究论文,研究阐述了肿瘤细胞Warburg效应促进肿瘤免疫逃逸的发现。
2022年10月21日,浙江大学转化医学研究院/浙江大学医学院附属第一医院吕志民团队与国家癌症中心/中国医学科学院肿瘤医院赫捷团队,在《Nature Cancer》杂志以封面文章的形式在线发表了研究论文,揭示联合使用CD55/CD59抗体与PD-1抗体可以克服EGFR突变的NSCLC患者对免疫检查点抑制剂治疗不响应的现象。

https://www.nature.com/articles/s43018-022-00444-4
EGFR突变激活的非小细胞肺癌患者治疗遇瓶颈
01
非小细胞型肺癌包括鳞状细胞癌、腺癌、大细胞癌,与小细胞癌相比其癌细胞生长分裂较慢,扩散转移相对较晚。非小细胞肺癌约占所有肺癌的80%,约75%的患者发现时已处于中晚期,5年生存率很低。
目前,EGFR突变激活的非小细胞肺癌(NSCLC)患者对免疫检查点抑制剂治疗不敏感,肺癌免疫治疗面临挑战。而的不断发现以及详细阐明肿瘤微环境调控肿瘤免疫逃逸新机制将会给这部分NSCLC患者带来新希望。
联合疗法效果显著
02
补体系统是一种关键的免疫成分,但其在肿瘤免疫逃逸和CD8+ T细胞活化中的作用尚未明确。补体系统识别外来病原体和表达异常表面分子的自身细胞,以触发炎症介质的释放、免疫细胞的募集、吞噬反应和细胞裂解。
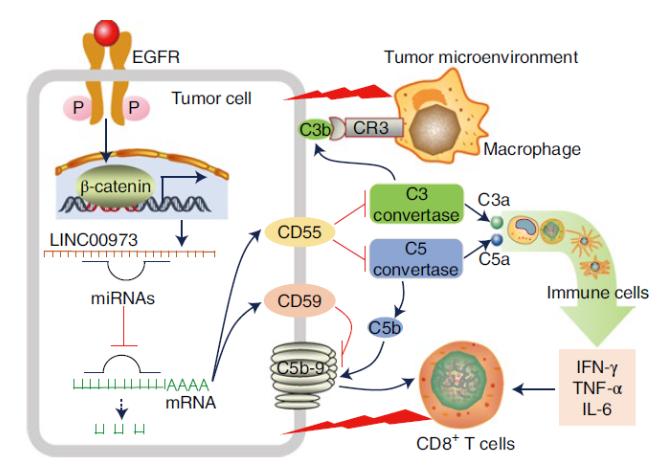
吕志民与赫捷团队发现,NSCLC细胞中EGFR突变激活提高了肿瘤细胞中CD55和CD59的表达,抑制了补体激活和CD8+ T细胞的活性。进一步研究发现,表皮生长因子受体EGFR/ Wnt信号传导诱导β连环蛋白介导的长非编码RNA(lncRNA)LINC00973表达以海绵靶向CD55靶向miR-216b和CD59靶向miR-150。因此上调的CD55/CD59表达抑制CD8T细胞活化所需的补体系统和细胞因子分泌。CD55/CD59中和抗体治疗或LINC00973启动子突变激活补体和CD8T细胞,抑制肿瘤生长。
重要的是,联合抗CD55/CD59抗PD-1抗体治疗可引发协同肿瘤抑制作用。此外,CD55/CD59水平与人肺癌标本中M1巨噬细胞和CD8T细胞的浸润呈负相关,并预测患者预后。此外,联合使用CD55/CD59抗体与PD-1抗体更有效促进了肿瘤中CD8+ T细胞和M1巨噬细胞的浸润,进而抑制了肿瘤生长,显著延长了荷瘤小鼠的生存时间。
临床转化价值
03
研究揭示了肿瘤微环境中补体和免疫细胞之间内在的调节关系,提供的临床前证据表明联合阻断mCRP功能和PD-1/PD-L1检查点治疗EGFR突变激活NSCLC的新策略具有较高的临床转化价值。此外,研究还揭示了EGFR/Wnt/β-连环蛋白上调CD55/CD59表达在抑制补体和CD8T细胞活化对肿瘤免疫逃逸和免疫检查点阻断抵抗方面的关键作用,并确定克服这些影响的潜在联合疗法。
参考资料:
https://www.nature.com/articles/s43018-022-00444-4
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




