- +1
清华大学葛亮团队:生物分子凝聚体靶向自噬途径的机制
原创 Cell Press CellPress细胞科学

生命科学Life science
生物分子凝聚体(biomolecular condensates)是细胞内由蛋白、RNA等生物大分子聚集而成的无脂膜包被的特殊结构。生物分子凝聚体的形成与调控对细胞有重要的生理与病理意义。近日,清华大学生命科学学院的葛亮团队在Cell Press细胞出版社期刊Trends in Cell Biology上发表了题为“Targeting of biomolecular condensates to the autophagy pathway”的综述文章,概述了生物分子凝聚体被自噬受体识别与转运的最新研究,并展望了通过靶向细胞自噬降解生物分子凝聚体治疗疾病的应用前景。
真核细胞中的生物分子凝聚体
细胞内生物大分子间的弱相互作用会促使其发生液-液相变(liquid-liquid phase separation, LLPS),形成具有流动性的液态凝集颗粒。这些无膜包被的凝集颗粒在细胞内发挥着重要的生理功能,例如调控RNA的转录、加工与降解等。它们的形成与解离受到了精确的调控。然而,突变蛋白或持续的细胞压力等条件会造成凝集颗粒的过度积累与状态转变,进而引发一系列疾病,例如阿尔兹海默病、帕金森疾病、亨廷顿疾病和肌萎缩性脊髓側索硬化症等(图1)。目前,越来越多的药物开发也将视线聚焦于凝聚体,其中就包括溶解或降解病理性凝聚体。
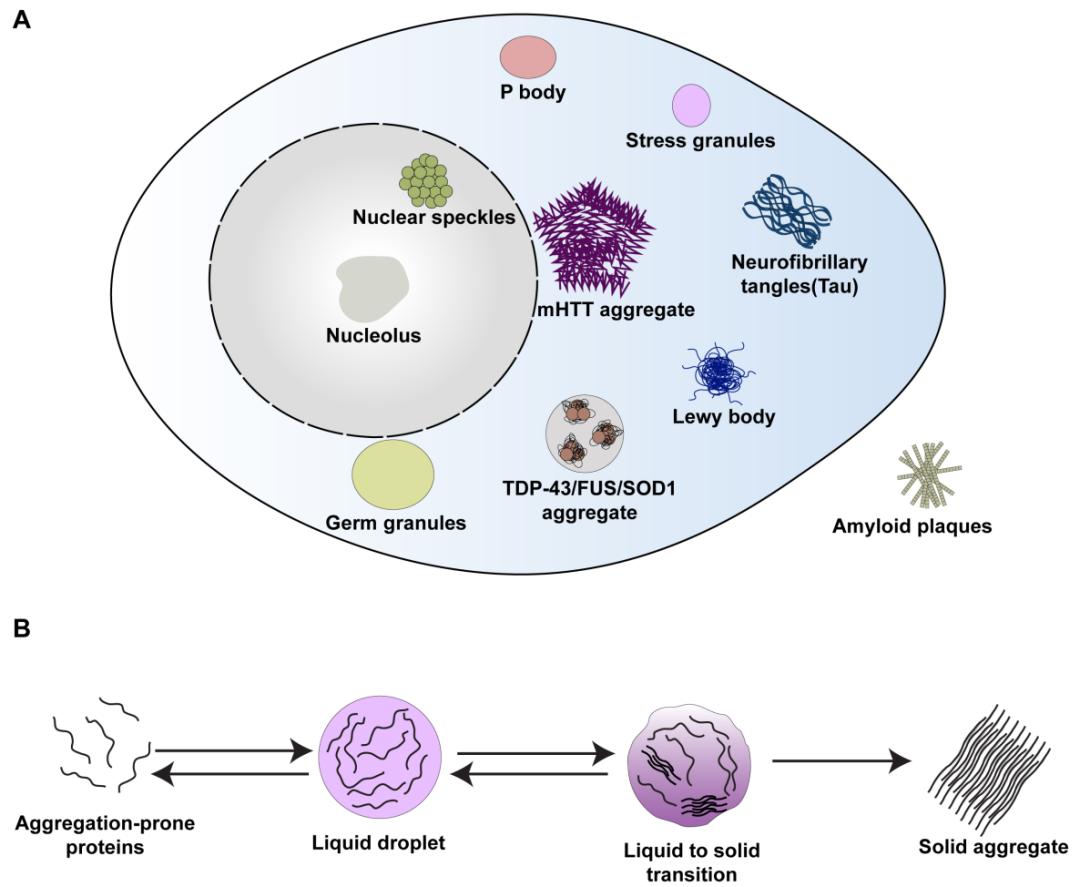
▲图1. 细胞内各种生物分子凝聚体(A)以及其状态变化(B)
细胞自噬是清除冗余或异常生物分子凝聚体的主要途径
真核细胞本身存在着一个固有的清除机制叫做细胞自噬。细胞自噬是清除细胞内多余生物大分子或受损细胞器的主要途径。细胞自噬的发生涉及到自噬的起始、自噬体膜的延伸、自噬体的形成、与溶酶体融合与降解以及回收等,其中涉及到众多的自噬相关蛋白(图2)。日本科学家大隅良典就因在细胞自噬机制研究方面做出的重大贡献获得了2016年诺贝尔生理学或医学奖。细胞自噬可以是非选择性地吞噬细胞内组分,也可以选择性地降解特定的底物。根据底物的不同,选择性自噬又可以包括线粒体自噬(mitophagy)、内质网自噬(ER phagy)、过氧化物酶体自噬(pexophagy)、聚集体自噬(aggrephagy)等等。自噬的选择性是由各种自噬受体所介导的,这些受体是连接底物与自噬的“桥梁”,负责将底物运送到自噬体中。自噬也是清除冗余或异常生物分子凝聚体的主要途径。由于生物分子凝聚体种类繁多,我们将以它们为底物的自噬性降解或加工统称为“生物分子凝聚体自噬(biocondensophagy)”。与其他选择性自噬相同,生物分子凝聚体自噬也受到多种自噬受体的调控。了解这些受体的作用机制将为我们治疗由凝聚体引发的疾病提供依据。
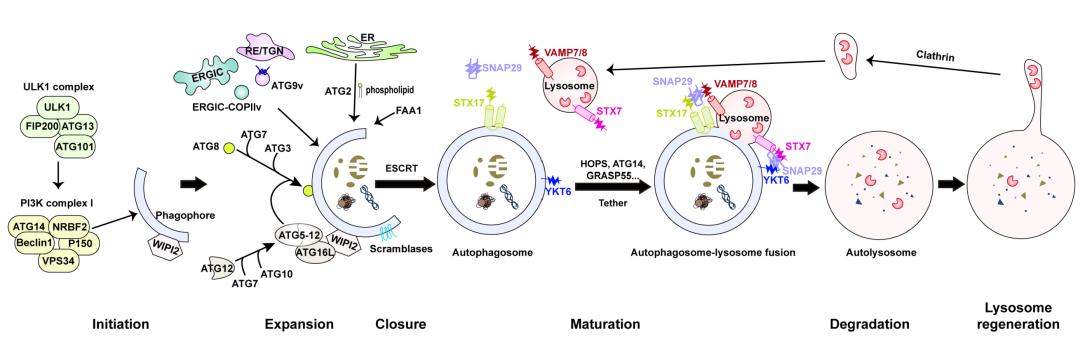
▲图2. 哺乳动物中的细胞自噬机制
泛素依赖的生物分子凝聚体自噬
泛素化是一种的常见的蛋白修饰方式,细胞通过一系列的酶促反应,为蛋白带上泛素链标签。对于凝聚体而言,泛素化一方面调控相变发生,促进凝聚体形成,另一方面又是一个降解信号,为诸多自噬受体提供了识别位点。这些受体包括P62、NBR1、TAX1BP1、OPTN和Tollip等,它们通过结合凝聚体上的泛素链与自噬体膜上的ATG8蛋白,将凝聚体运送到自噬体中(图3A)。
这些泛素结合受体不仅在介导凝聚体降解中起重要作用,其中一些还在凝聚体的形成过程中发挥重要作用。最近的研究发现,一些泛素结合受体例如P62可以通过自身寡聚化以及结合泛素链来提供多重分子相互作用以发生相分离,从而驱动生物分子凝聚体的形成。之后NBR1和TAX1BP1的加入会进一步加速凝聚体的组装,并招募自噬相关蛋白来降解凝聚体(图3B)。
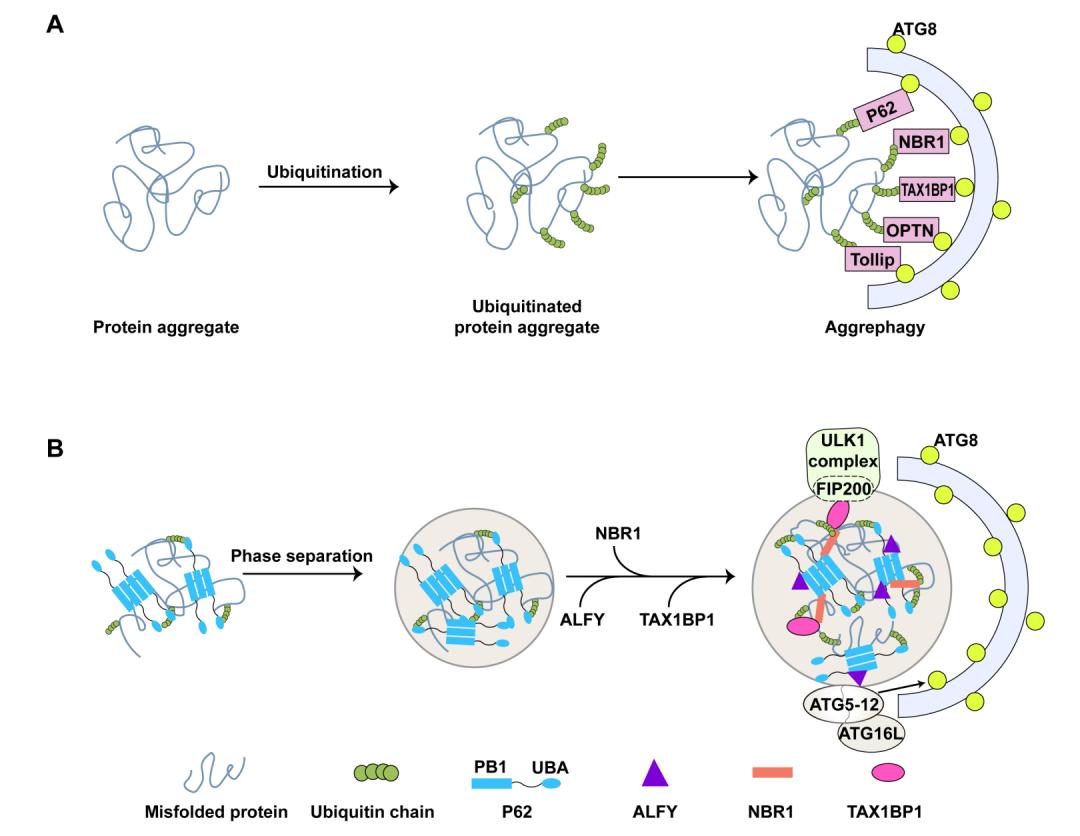
▲图3. 泛素依赖的生物分子凝聚体自噬受体
非泛素依赖的生物分子凝聚体自噬
泛素化为自噬受体识别凝聚体提供了便利,也被人们视为一个重要的降解标志。然而,还有一些生物分子凝聚体自噬是由一些非泛素化依赖的受体来介导的。与能够结合各种凝聚体上的泛素链的泛素结合受体不同,这些非泛素化依赖的受体结合的是某一种凝聚体中的特定蛋白。其中的代表包括酵母中自噬介导的Ape1凝聚体的转运以及线虫发育过程中PGL颗粒的自噬性清除。
Ape1是酵母液泡中的水解酶,而其前体是在细胞质中合成的。自噬受体Atg19结合Ape1前体并与之共同发生相分离,同时招募Atg8来介导自噬体对Ape1凝聚体的吞噬。最终通过自噬体与溶酶体的融合,Ape1前体被运送到溶酶体中加工为成熟的Ape1。值得注意的是,Ape1凝聚体的这一转运过程依赖于其流动性,Ape1的P22L位点突变因引起了Ape1凝聚体固化而不能被自噬转运(图4A)。
在线虫的发育过程中,体细胞中由PGL-1和PGL-3蛋白发生相变形成的PGL颗粒会被自噬降解,这一过程主要由自噬受体SEPA-1所介导。SEPA-1能够直接结合PGL-3与LGG-1(线虫中Atg8的同源蛋白)来促进PGL颗粒的自噬性清除(图4B)。
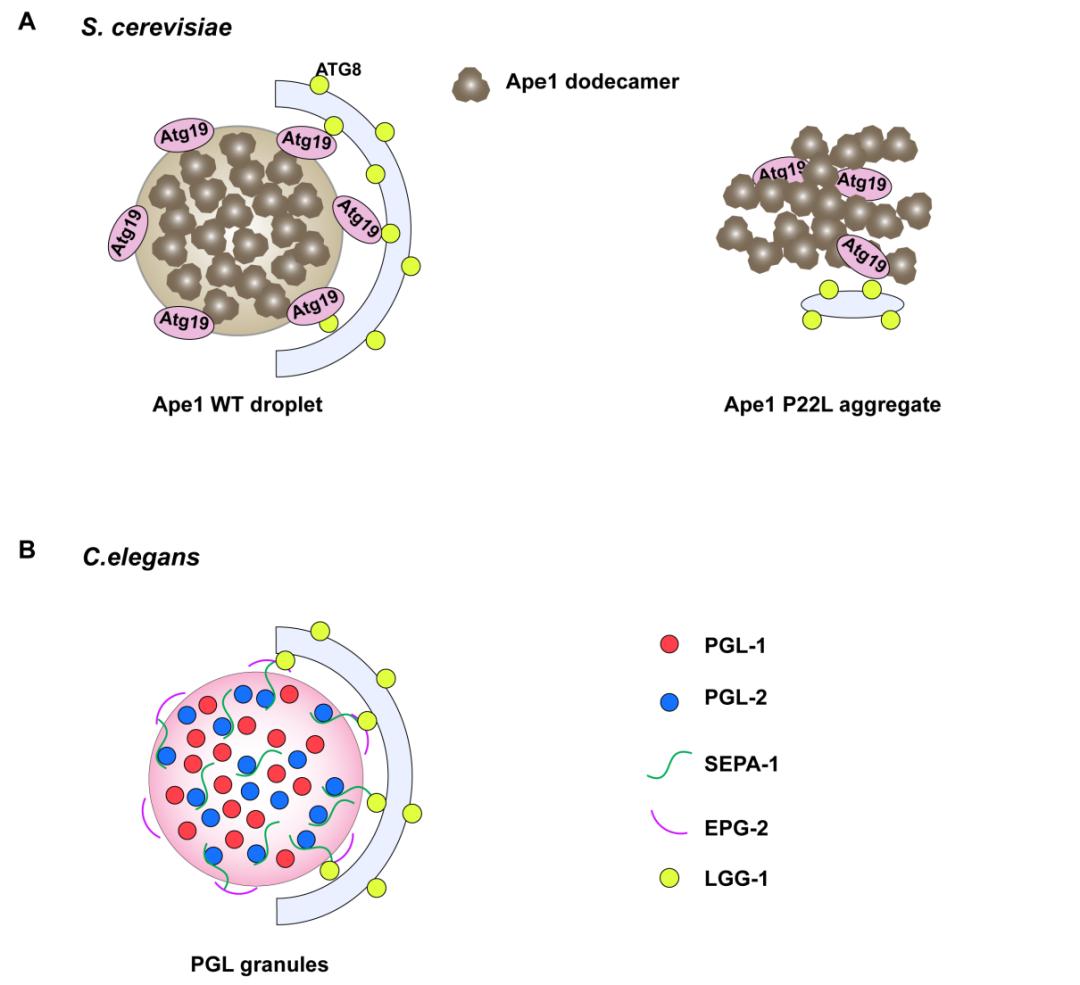
▲图4. 酵母与线虫中非泛素依赖的生物分子凝聚体自噬
固态聚集体的自噬性清除
在以上所述的生物分子凝聚体自噬的过程中,凝聚体的液态或胶状性质是它们被自噬体吞噬的必要条件。而当液态凝聚体固化形成固态聚集体后却难以被自噬清除,这为成为治疗疾病的一大障碍。然而,最近一项令人兴奋的研究发现, chaperonin复合体的一个亚基——CCT2能够作为一种新型的自噬受体,特异性地识别并促进固态聚集体的降解。作为一个分子伴侣蛋白,CCT2有与生俱来的结合错误折叠蛋白的能力,这种结合是不依赖于泛素化的。当独立于chaperonin复合体时,CCT2将不再行使分子伴侣功能,而是获得了结合ATG8的能力,从而介导固态聚集体的自噬性清除(图5)。是否有更多的自噬受体或其他蛋白参与降解固态聚集体值得我们进一步地探究。
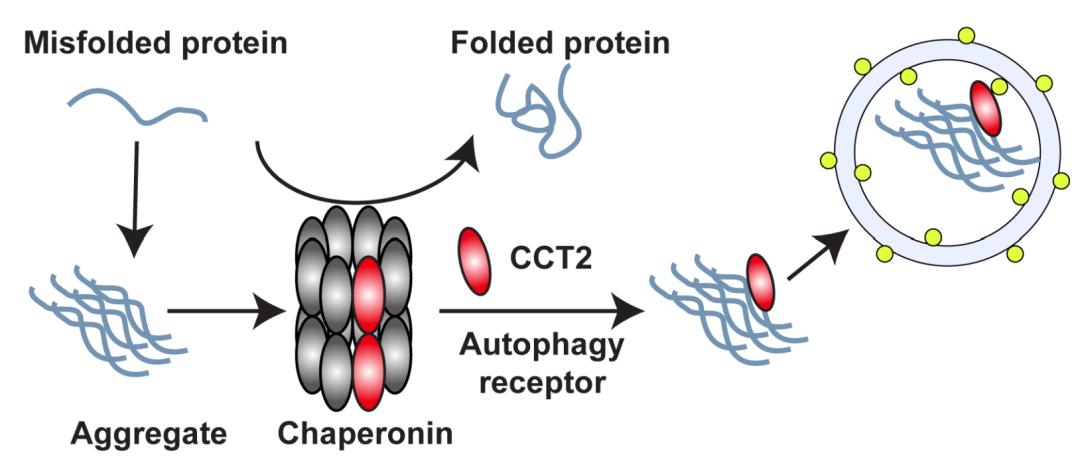
▲图5. CCT2促进固态聚集体的自噬性降解
生物分子凝聚体自噬性降解在疾病治疗中的应用前景
生物分子凝聚体,尤其是固态的蛋白聚集体,是导致神经退行性疾病的重要原因。已有研究表明,通过上调自噬水平能够减少细胞内蛋白聚集体的积累,有助于减缓由蛋白聚集体导致的疾病,然而,广泛的自噬上调对于降解聚集体的效率还有待提高。著名学者曾指出,选择性自噬是治疗神经退行性疾病的重要靶点。一些自噬受体的基因突变,如p62、OPTN和NBR1,与神经退行性疾病有关,进一步提示了凝集体自噬受体在疾病中的重要作用。因此,通过增加自噬受体、提高自噬水平来促进这些病理性凝聚体的自噬性降解成为了重要思路之一。然而,这一过程中还有一些亟待解决的问题,例如,自噬体是如何吞噬比自己大的凝聚体的?不同的自噬受体是如何协作共同介导凝聚体自噬的?它们对不同蛋白形成的凝聚体是否有选择性?研究这些问题,将为我们治疗相关疾病提供更好的理论指导与应用对策。
本文参考文献
1. Wang, Z. and H. Zhang, Phase Separation, Transition, and Autophagic Degradation of Proteins in Development and Pathogenesis. Trends in Cell Biology, 2019. 29(5): p. 417-427.
2. Patel, A., et al., A Liquid-to-Solid Phase Transition of the ALS Protein FUS Accelerated by Disease Mutation. Cell, 2015. 162(5): p. 1066-77.
3. Sun, D., et al., Polyubiquitin chain-induced p62 phase separation drives autophagic cargo segregation. Cell Research, 2018. 28(4): p. 405-415.
4. Gubas, A. and I. Dikic, A guide to the regulation of selective autophagy receptors. The FEBS Journal, 2022. 289(1): p. 75-89.
5. Turco, E., et al., Reconstitution defines the roles of p62, NBR1 and TAX1BP1 in ubiquitin condensate formation and autophagy initiation. Nature communications, 2021. 12(1): p. 5212-5212.
6. Yamasaki, A., et al., Liquidity Is a Critical Determinant for Selective Autophagy of Protein Condensates. Molecular Cell, 2020. 77(6): p. 1163-1175.e9.
7. Zhang, Y., et al., SEPA-1 Mediates the Specific Recognition and Degradation of P Granule Components by Autophagy in C. elegans. Cell, 2009. 136(2): p. 308-321.
8. Ma, X., et al., CCT2 is an aggrephagy receptor for clearance of solid protein aggregates. Cell, 2022. 185(8): p. 1325-1345.e22.
9. Scrivo, A., et al., Selective autophagy as a potential therapeutic target for neurodegenerative disorders. Lancet Neurol, 2018. 17(9): p. 802-815.

相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Cell Biology
▌论文标题:
Targeting of biomolecular condensates to the autophagy pathway
▌论文网址:
https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(22)00208-2
▌DOI:
https://doi.org/10.1016/j.tcb.2022.08.006
论文作者介绍

葛亮
副教授
论文通讯作者,葛亮,本科毕业于山东师范大学生命科学学院。获中国科学院上海生命科学研究院生物化学与细胞生物学研究所博士学位。随后在美国加州大学伯克利分校作为博士后从事细胞自噬方面的研究工作。期间获得Jane Coffin Child Foundation Fellowship、Human Frontier Science Fellowship和NIH Pathway to Independence Award。2017年回国在清华大学生命科学学院任职,现为副教授,中国生物物理学会亚细胞器分会副会长,中国细胞生物学会细胞器分会副秘书长,主要从事细胞内膜系统形态和功能学研究。代表性有研究成果1:发现了内质网高尔基体中间体(ERGIC)膜蛋白TMED10参与非经典蛋白分泌,并揭示了一条TMED10介导的非经典分泌蛋白跨膜转运的分子通路(THU通路),解答了非经典分泌邻域无信号肽蛋白如何进入分泌途径的关键问题(Cell,2020);2:发现新型内膜体ERGIC-ERES互作调节自噬体的形成 ,解答了细胞自噬领域自噬体膜来源和组装的重要问题(Cell Research,2021);3.发现新型自噬受体CCT2介导固态聚集体的自噬降解(Cell, 2022)。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




