- +1
eLight·封面 | 荧光“定量型”超分辨纳米探针
撰稿人:黄冠 (悉尼科技大学,博士生)

小细胞外囊泡(small extracellular vesicles, sEVs) 是细胞分泌的纳米级脂质膜囊泡,携带着特定的生物活性分子信息(如脂质、蛋白质、代谢物和核酸等)在体液内循环。而肿瘤细胞产生的sEVs,可促进肿瘤微环境的形成,增强肿瘤侵袭和转移能力,是一种重要的肿瘤标志物。sEVs在体内的变化独特地反映了与肿瘤生长相关的动态生物学变化,可用于疾病诊断。然而,由于sEVs的纳米尺寸低于光学衍射极限,大多数普通光学显微镜不足以分辨它们携带的各种生物信息的异质性。
针对这一科学难题,近日,来自悉尼科技大学的金大勇院士及其团队利用基于上转换荧光纳米探针 (UCNPs)和受激发射损耗(Stimulated emission depletion, STED)的超分辨成像技术,实现了单个sEV的超分辨成像,并且 “数字化”量化单个sEV上表面肿瘤标志物的变化趋势(如图1所示)。
该研究成果以“Upconversion Nanoparticles for Super-resolution Quantification of Single Small Extracellular Vesicles” 为题在线发表于卓越计划高起点新刊eLight。共同第一作者是黄冠、刘永焘,通讯作者是澳大利亚工程院院士金大勇教授。
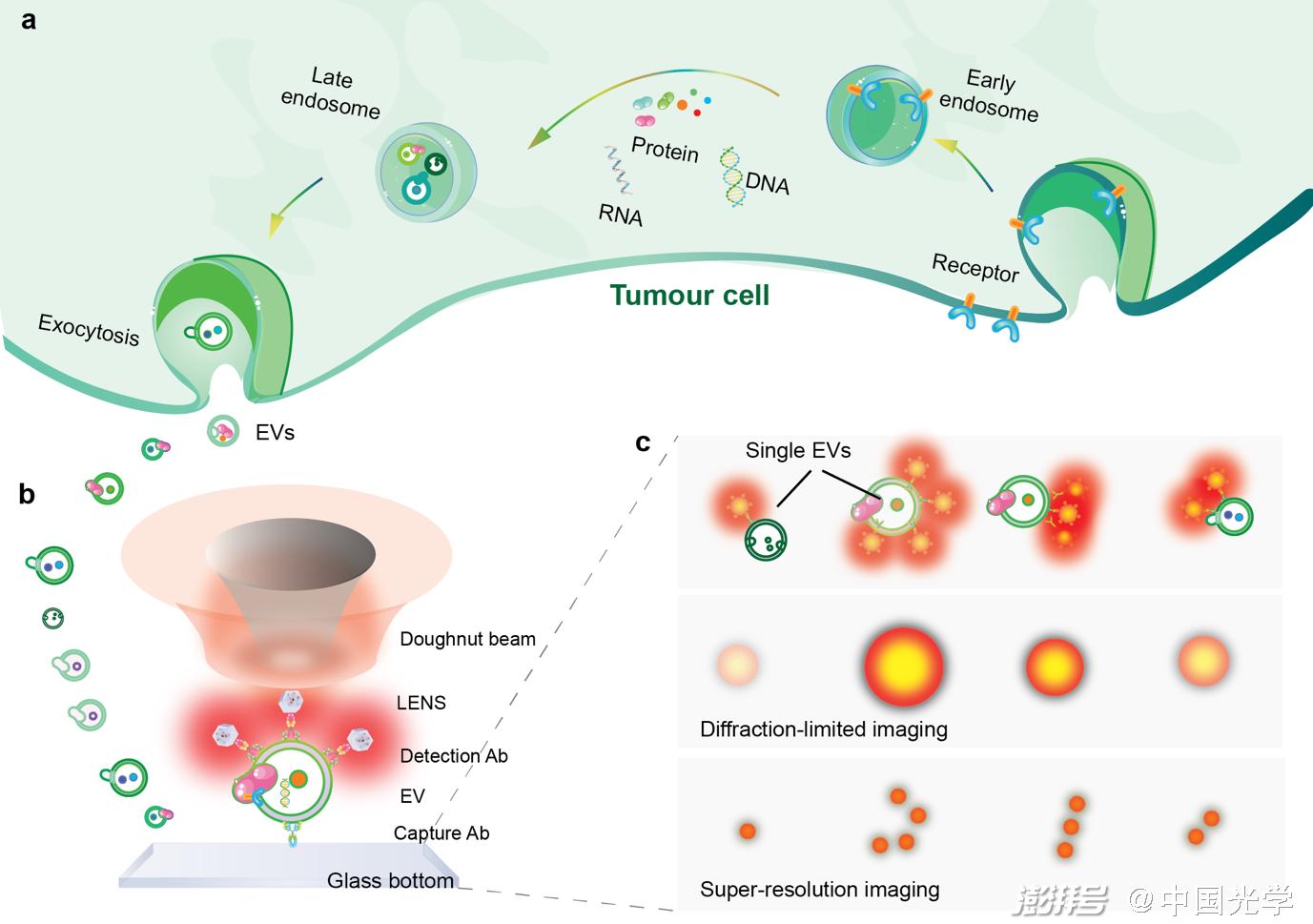
图1:基于荧光纳米探针的超分辨技术对单个sEV上的肿瘤标志物进行定量的示意图
上转换荧光纳米探针有良好的光学特性,在生物成像中无荧光背景干扰。此前,该研究团队实现了对大量sEV的肿瘤标志物超灵敏定量检测 ,比标准的酶联免疫吸附试验 (ELISA) 高出近三个数量级(Nano Lett. 2022, 22, 9, 3761–3769)。在eLight文章中,该研究团队首次实现了对单个sEV上肿瘤标志物的定量。首先,通过共定位实验,研究团队验证了荧光纳米探针可以特异性识别sEV上的肿瘤标志物(如图2所示)。
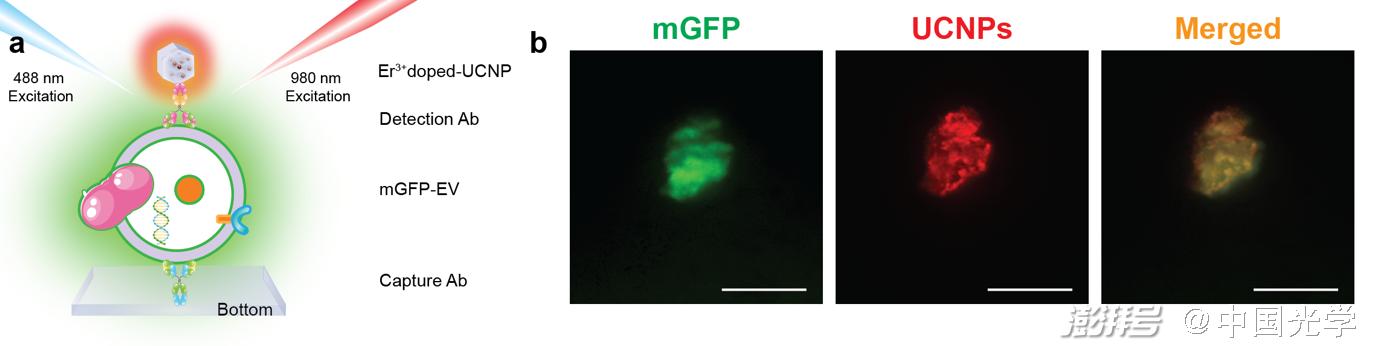
图2:mGFP-UCNPs共定位实验
其次利用上转换荧光纳米探针的非线性饱和特性,提高激发光功率以突破衍射极限。sEV首先被捕获在涂有特异性抗体的载玻片上,其表面的肿瘤相关抗原被抗体特异性识别,随后被均匀、明亮和光稳定的荧光纳米探针标记。荧光纳米探针被“甜甜圈状”的中空光束(高斯贝塞尔光束)扫描,当探针位于光束中间时,超分辨显微镜产生一个环形暗斑的图案,从而实现了单个sEV上肿瘤标志物的亚30 nm超分辨率成像 ,进而量化每个sEV上的肿瘤标志物的数目(如图3所示)。最后,研究团队探究了荧光纳米探针的尺寸大小对空间位阻的影响,发现随着荧光纳米探针的尺寸越来越小,其空间位阻随之减少。
该方法的一个重要应用是可以用于临床监测整个癌症进展或癌症治疗过程,不仅为sEV应用于临床液体活检提供了可能,亦有望为上转换材料在生物医药和纳米技术等领域开拓新的应用窗口。
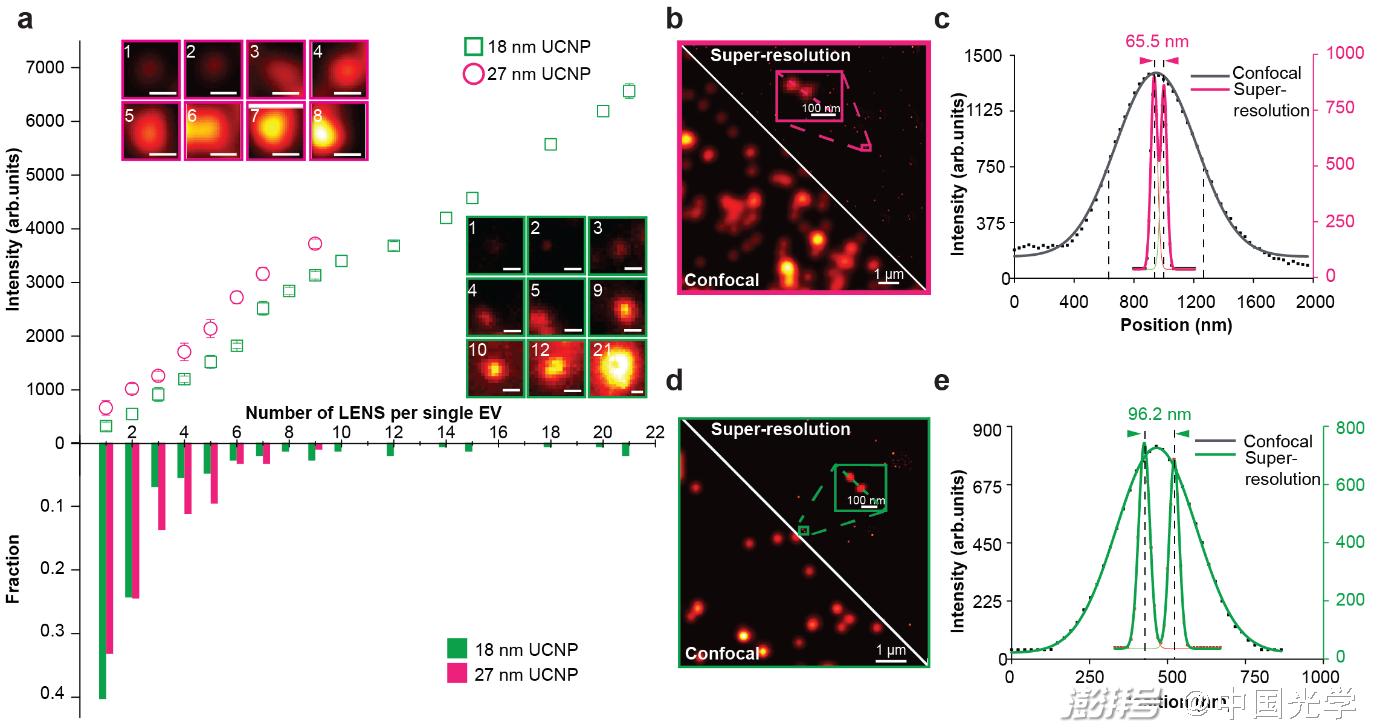
图3:纳米颗粒尺寸对超分辨成像的影响、以及sEVs的异质性
| 论文信息 |
Huang, G., Liu, Y., Wang, D. et al. Upconversion nanoparticles for super-resolution quantification of single small extracellular vesicles. eLight 2, 20 (2022).
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




