- +1
Life Med | 钟清/鲁伯埙等发表自噬溶酶体靶向降解与疾病的综述

近日,上海交通大学医学院、“细胞分化与凋亡”教育部重点实验室钟清课题组联合复旦大学生科院鲁伯埙课题组在Life Medicine发表了题为"Manipulating Autophagic Degradation in Human Diseases: from Mechanisms to Interventions"的综述文章,文章基于选择性自噬的机制,总结了最新最前沿利用自噬-溶酶体途径设计新型靶向降解技术的研究进展,并展望了未来这一新型靶向降解技术在肿瘤和神经退化性疾病治疗中广泛应用前景以及待解决的关键科学问题。

靶向降解(targeted degradation)是近二十年来新兴的一种药物设计路线。不同于多数传统药物通过紧密结合靶蛋白的活性位点而抑制其功能,靶向降解药物(degrader)尝试利用细胞自身的降解系统选择性消灭靶蛋白。典型的设计方案是一个双功能的化合物:一端的基团可结合某个分子机器,另一端结合靶蛋白,通过将分子机器招募至靶蛋白引起降解效应。目前开发最为充分的是利用泛素化-蛋白酶体途径的靶向降解路线,其代表方案为PROTAC(proteolysis-targeting chimera)。PROTAC利用的分子机器是E3连接酶,可引起靶蛋白泛素化,进而被蛋白酶体识别降解。这一策略已被成功地应用于数十种靶蛋白,并已有至少两种PROTAC进入了临床试验。除蛋白酶体之外,真核细胞尚有另一个重要的降解机器,即溶酶体(lysosome)。溶酶体含有多种酸性水解酶,可降解包括蛋白、核酸、脂质在内的多种物质。近年来,构建利用溶酶体的靶向降解技术逐渐成为研究者的兴趣所在。这类技术包括利用内吞-溶酶体途径降解质膜蛋白和细胞外成分的LYTAC(lysosome-targeting chimera)等;以及利用自噬-溶酶体途径降解细胞内成分的AUTAC(AUtophagy-TArgeting Chimera),AUTOTAC(AUTOphagy-TArgeting Chimera),ATTEC(autophagosome tethering compound)等。
自噬(autophagy),是一类将胞内物质送入溶酶体降解的途径。其中,在多种自噬机器(autophagy machinery)的介导下,形成双层膜的囊泡(自噬体,autophagosome)包裹底物,自噬体再与溶酶体融合的途径,被称为大自噬(macroautophagy),如图1所示。具有底物选择性的大自噬即为选择性自噬(selective autophagy)。选择性的实现,依赖于将分离膜(isolation membrane/phagophore,即自噬体的前体)招募至底物。这一过程由一系列底物受体(cargo receptor)与支架蛋白(scaffold protein)介导。在这篇综述中,它们被统称为recognition machinery,即识别机器。
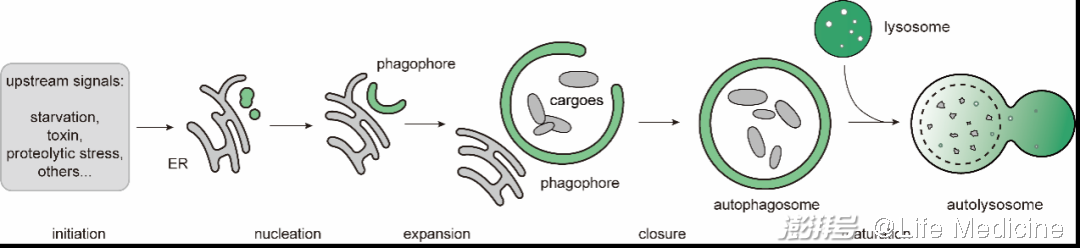
图1(原文Figure 1A)
识别机器具有至少两个功能:结合底物,以及招募分离膜(图2)。在底物一端,一些识别机器结合特定的降解标签(tag),例如泛素、N-degron或特定的糖链,这些标签可以被修饰在底物表面,也可以由底物内部暴露出来;另一些底物受体可直接结合底物。在另一端,大部分底物受体都通过结合分离膜表面的mATG8蛋白而招募分离膜;除此之外,一些底物受体以及支架蛋白还可招募上游自噬机器(autophagy machinery)及它们的调节蛋白,例如ULK1复合物与TBK1等,以促进在底物所在位置(in situ,即原位)形成分离膜。
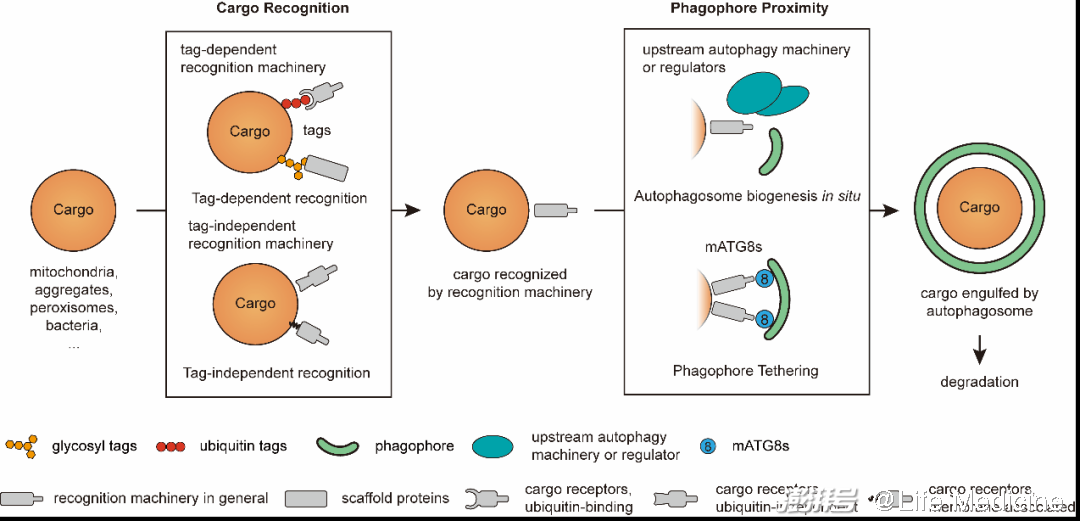
图2(原文Figure 1B)
可见,选择性依赖于底物、识别机器、自噬机器与分离膜之间的相互作用。若用双功能小分子模拟这些相互作用,就有可能将靶标“导入”通向选择性自噬的路线。基于这一思路,可以产生四种主要的自噬依赖靶向降解技术的设计策略(图3)。
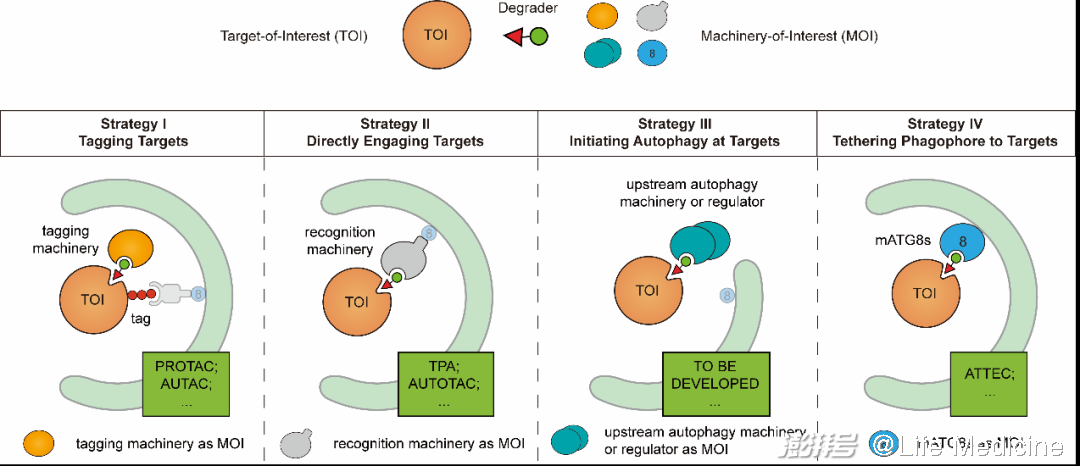
图3(原文Figure 1C)
策略一:加降解标签(tagging targets)。与PROTAC的原理类似,这一策略可以通过招募细胞内的修饰酶实现。这类靶向降解技术中开发相对完善的是AUTAC。这类化合物一端结合底物,另一端为一个Cys-S-cGMP类似物,结合靶标后可以引起靶标K63-多泛素化,以招募识别机器。AUTAC能够引起线粒体以及多种可溶蛋白(Brd4、MetAP2、FKBP12)的自噬降解,不过它如何招募靶标泛素化所需的E3连接酶还不清楚。除此之外,另一些PoC实验也给出了积极的结果。例如,使用SNIPER(selective non-genetic IAP-dependent protein eraser,PROTAC的一种类型)将IAP家族E3连接酶招募至线粒体也能成功地将线粒体泛素化,引起自噬降解。这说明PROTAC所利用的某些分子机器在特定条件下或许也可以被自噬靶向降解所利用。其他参与标记自噬底物的修饰酶,例如为蛋白加上N-Arg(一种N-degron)的ATE1,也是潜在可供利用的分子机器。
策略二:直接识别(directly engaging targets)。这一策略旨在将识别机器招募至靶标。目前已报道的识别机器包括30余种底物受体与一些支架蛋白,其中底物受体p62已经被利用开发出两种靶向降解技术,即TPA(targeted protein autophagy)与AUTOTAC。这两种技术都涉及一端结合底物、另一端结合p62的双功能化合物。不同的是,TPA使用的p62配体是共价结合的,而AUTOTAC使用一个模拟N-degron结构的配体,能够增强p62介导选择性自噬的能力。前者成功降解了Brd4与突变Huntingtin(带有额外poly-Q序列,会形成聚集体)。此外,也有一些PoC实验尝试招募p62与OPTN等识别机器到靶标。
策略三:原位引发自噬(initiating autophagy at targets)。这一策略希望招募上游自噬机器或调节蛋白,以在底物附近引发分离膜的生成。目前这一策略尚未被开发为靶向降解技术,但将ULK1、FIP200等上游自噬机器以及TBK1等调控蛋白招募至靶标的PoC实验已经获得了一些积极的结果。先前的研究也发现其他自噬机器,如ATG9、PI3KC3-C1、ATG12-5-16L1等,也可以被招募到选择性自噬的底物以促进分离膜形成,因而也有被开发为靶向降解技术的潜力。
策略四:拴系分离膜(phagophore tethering of targets)。利用这一策略的靶向降解技术在靶标与分离膜之间建立联系。由于mATG8是分离膜表面相对恒定的成分,将mATG8与底物拉在一起是目前最可靠的路线之一。利用该路线的一项典型技术是ATTEC,这类化合物可一端结合靶标,一端结合mATG8,从而使靶标被逐渐延伸的分离膜所包裹。ATTEC成功地将突变Huntingtin(带有额外的poly-Q),Brd4以及脂滴靶向自噬降解,表现出对聚集体、可溶蛋白以及细胞器的降解能力。
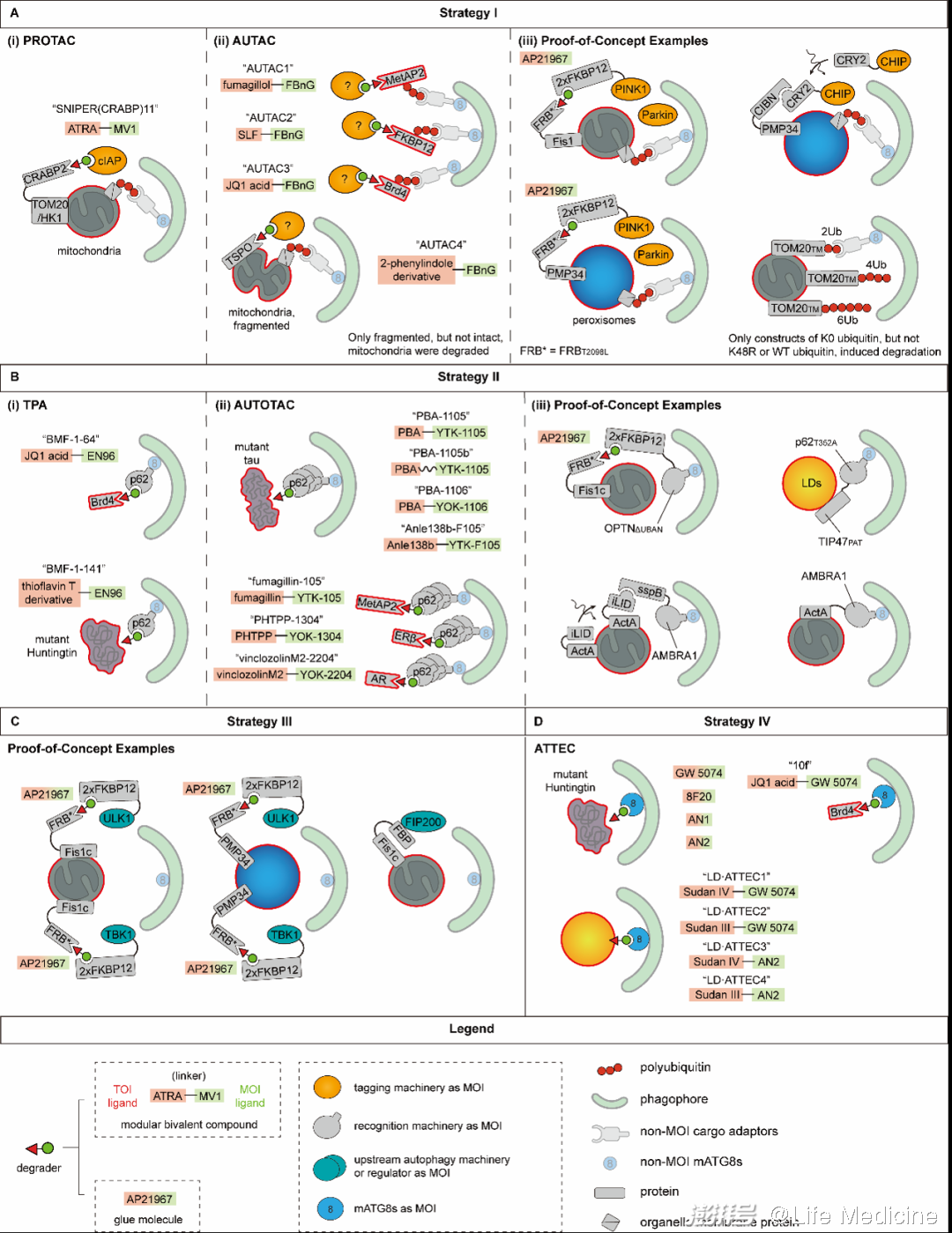
图4(原文Figure 2,本图篇幅所限并未包括全部案例,请参考原文)
自噬依赖靶向降解是靶向降解领域的新方向,或可被应用于多种疾病的治疗。尽管已有一些分子机器被利用设计靶向降解技术,目前还有许多潜在可用的机制与分子机器未被研究;已报道的技术也有很多问题未被完全解答,降解效果也可进一步提高。理解选择性自噬的机制与分子机器对上述过程无疑会有很大帮助。设计验证自噬依赖靶向降解技术的过程可以从PROTAC的开发途径得到许多启发,但也会遇到不同于PROTAC的新问题。为此,这篇综述讨论了自噬依赖靶向降解技术可能具有的一些性质,提出了一些有待解决的问题与猜想,以及一个从确认靶标开始,开发与测试靶向降解技术的工作流程。综上,该综述可为开发新颖的自噬依赖靶向降解药物提供重要的理论指导和启发。
原文链接:https://doi.org/10.1093/lifemedi/lnac043
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




