- +1
Life Med亮点 | 逆转座子调控人类早期胚胎发育及疾病发生

人类基因组测序数据揭示,超过50% 的DNA序列由转座元件(Transposable elements, TEs,又称转座子)所组成,其中反转录转座子(以下简称为反转座子)占绝对比例。顾名思义,反转座子通过转录产生中间体RNA,进而被反转录形成新的DNA拷贝,整合进宿主基因组中(即 "复制-粘贴 "机制)。人类基因组主要包含长末端重复序列(long terminal repeat,LTR)、非长末端重复序列(non-long terminal repeat,non-LTR)和SINE-VNTR-Alu(SVA)序列等三种类型的反转座子。其中,LTR反转座子或内源性逆转录病毒(endogenous retrovirus,ERV)起源于外源逆转录病毒的侵染。在数千万年的进化过程中,ERV逐渐被固定下来,成为宿主基因组的一部分(大约占人类基因组的8%)。另一方面,non-LTR序列,包括LINE和SINE,大约占人类基因组的30%。LINE-1 (L1) 是一类自主性反转座子,能够表达一整套负责转座的蛋白机器。相比之下,作为类人猿所特有的一种非自主性反转座子,SVA 可以利用 L1 元件产生的蛋白机器来实现转座。绝大多数反转座子由于序列突变或受表观调控而处于转录沉默状态,因此长期以来被称认为是“无用DNA”或“化石DNA”。近年来,得益于多组学测序及基因组编辑技术的发展,越来越多的证据表明,这些所谓的“无用DNA”可能对人类发育和健康至关重要。
逆转座子调控人类早期胚胎发育
在进化过程中,ERV 不同程度地保留了其祖先外源病毒的原始特征。其中,某些对宿主发育及健康有利的ERV元件被驯化或共选择下来,成为宿主基因组的必要部分。例如,由 HERV 包被膜基因(如 HERVW-1、HERV-FRD1)所编码的合胞素(如Syncytin-1,-2)在人类胎盘合胞体滋养层形成过程中起着重要作用。此外,作为进化上最为年轻的ERV, HERVK(HML-2)可通过表达附属蛋白 Rec来促进人类植入前胚胎的抗病毒免疫反应。此外,LTR为人类早期胚胎发育过程中的基因表达提供了丰富的顺式调控元件,如增强子、启动子及poly A位点等。多种灵长类/类人猿特异性反转座子在人类胚胎植入前发育过程中被阶段特异性地重新激活,表明这些反转座子参与构建人类早期胚胎发育的基因调控网络。此外,LTR5_Hs 元件(即 HERVK 的末端调控序列)还被发现可作为增强子促进人类原始生殖细胞的特化,表明其在人类生殖细胞发育中的发挥重要作用。
特别是,利用微量细胞ChIP-seq或cut&run技术,研究人员揭示了H3K9me3修饰调控人类着床前胚胎发育的重要功能。研究表明,特定的KRAB-ZNFs蛋白可通过发育阶段特异性的H3K9me3修饰来调节不同LTR家族的转录。其中,在人类胚胎二细胞(2C)发育到八细胞(8C)期间,H3K9me3在类人猿特异性SVA_D反转座子上的沉积减少,有利于这些反转座子与合子基因组激活(ZGA)相关基因相互作用。进一步研究发现,SVA_D逆转座子可充当增强子为8C关键转录因子(如DUXA和ZSCAN4)提供结合位点来促进人类的ZGA。的确,SVA_D元件的表达沉默可阻碍ZGA和囊胚形成,揭示了SVA_D在人类着床前胚胎发育中的重要功能。此外,在胎盘滋养层中,H3K9me3的从头沉积可阻止多能性转录因子与某些类人猿特异性反转座子结合,抑制ICM谱系相关基因表达,表明H3K9me3重编程对人类胚胎早期谱系特化具有潜在促进作用。反转座子是否参与调控人类着床后胚胎中的谱系特化和胚层分化,有待于以后进一步研究。
逆转座子参与人类疾病发生
在正常生理条件下,转座子的转录活性受到人类基因组监控系统的严格控制,而在病理或衰老条件下则有可能发生失调。例如,人类特异性HERVK(HML-2)被报道广泛参肿瘤发生、衰老以及抗病毒先天免疫反应等多个生理过程。其中,HERVK(HML-2)在神经发育中的作用尤其引人关注。最近,一项研究基于人类多能干细胞模型,结合CRISPR-VPR系统,发现 HERVK(HML-2)的异常激活可诱导神经元分化相关基因的过早表达,进而损害皮质神经元的发育,推测HERVK的异常激活可能与神经系统发育异常及神经退行性疾病有关。此外, HERV-K(HML-2)的多个拷贝具有完整的开放阅读框,可在某些病理过程及衰老细胞中产生逆转录病毒样颗粒(RVLPs)。然而,这些HERVK衍生的RVLPs是否以及如何调节肿瘤发生或衰老还有待进一步回答。
反转座子LINE-1(L1)在衰老及免疫反应过程中的作用近期也得到了广泛关注。研究发现, BMAL1可通过稳定异染色质,进而抑制L1-cGAS-STING途径的激活来防止干细胞衰老,推测L1转录本可通过促进IFN-I介导的先天免疫信号驱动细胞衰老。有趣的是,有研究表明,L1转录本的表达有助于维持新生CD4+T细胞的静止状态。同时,在功能失调的T细胞中也观察到 L1的异常转录,提示其在调控T细胞衰竭方面具有潜在功能。
值得注意的是,作为人类基因组中唯一自主性转座元件,L1转座可能会诱发插入性诱变。一项研究通过泛癌基因组分析发现,近一半的人类癌细胞系表现出体细胞L1转座活性,提示L1转座可能通过引起基因功能缺失而促进肿瘤发生。有趣的是,同时有研究却揭示L1在抑制肿瘤进展方面具有潜在作用。HUSH复合体的组成蛋白MPP8被证明在骨髓性白血病中参与抑制L1,而L1的重新激活则会抑制肿瘤细胞生长。这些表明L1的转座活性具有肿瘤类型特异性。
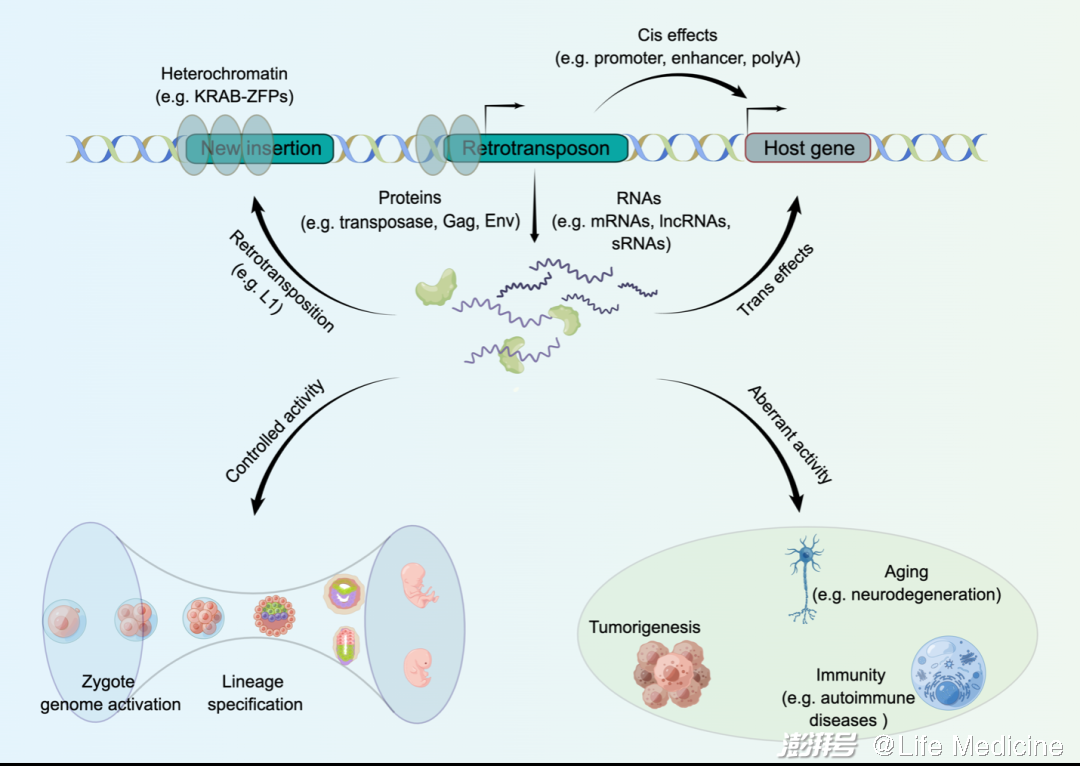
总的来说,最新的一系列研究进一步证实,在正常生理条件下,反转座子的转录激活参与调控人类早期胚胎发育,而其在体细胞中的异常激活则与疾病发生和衰老密切相关,这强调了基因组监控系统的重要性。事实上,像其他真核生物一样,人类已经进化出一套高度协调的分子机制来控制反转座子的转录活性,包括PIWI/piRNA途径、KRAB-ZFP-KAP1复合体、DNA甲基化、组蛋白修饰及RNA修饰等。尽管反转座子在人类衰老、神经退行性疾病、免疫炎症和癌症等过程中存在广泛影响,但其背后的因果联系及分子机制还相当模糊。基因编辑和三代测序技术将为有助于进一步破译反转座子在早期发育和疾病中的多重角色。
原文链接:https://doi.org/10.1093/lifemedi/lnac041
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




