- +1
注射人工合成的RNA病毒,用来治疗癌症,解决溶瘤病毒的局限性
原创 生物世界 生物世界 收录于合集#溶瘤病毒 3 个 #癌症研究 287 个 #递送载体 39 个
撰文丨王聪
编辑丨王多鱼
排版丨水成文
溶瘤病毒(Oncolytic viruses,OV)已经成为一种非常具有吸引力的癌症治疗方式,溶瘤病毒以癌细胞为目标,而又不影响正常细胞,通过在癌细胞内复制,导致癌细胞裂解,同时,溶瘤病毒还能激活肿瘤微环境(TME)。
将溶瘤病毒与癌症免疫疗法相结合,有可能进一步重塑肿瘤微环境(TME)和免疫细胞激活,增强免疫检查点抑制剂对低反应或无反应肿瘤的疗效。
截至目前,溶瘤病毒的治疗仅限于向肿瘤部位注射给药,需要全身抗肿瘤反应才能对非注射部位有效。静脉注射溶瘤病毒能够靶向所有的肿瘤部位,从而提高疗效。然而,静脉注射会导致人体产生抗病毒中和抗体,这严重限制了后续的重复给药。
为了最大化病毒免疫疗法的潜力,必须制定避免被人体内抗体中和的策略。重靶向、细胞载体、聚合物涂层,以及脂质体等方式已被用于保护溶瘤病毒免受中和抗体作用,但这些研究还尚未进展到临床阶段。近年来,mRNA 疫苗的广泛应用为脂质纳米颗粒(LNP)载体系统的发展铺平了道路,也为克服静脉给药的挑战带来了希望。
2022年10月7日,溶瘤病毒疗法开发公司 Oncorus 的研究人员在 Nature Communications 期刊发表了题为:Development of intravenously administered synthetic RNA virus immunotherapy for the treatment of cancer 的研究论文。
研究团队开发了一种完全由人工合成的 RNA 病毒——Synthetic RNA virus,通过脂质纳米颗粒(LNP)递送 RNA 病毒基因组(vRNA),将解决溶瘤病毒重复静脉给药的局限性,提高溶瘤病毒的治疗潜力。
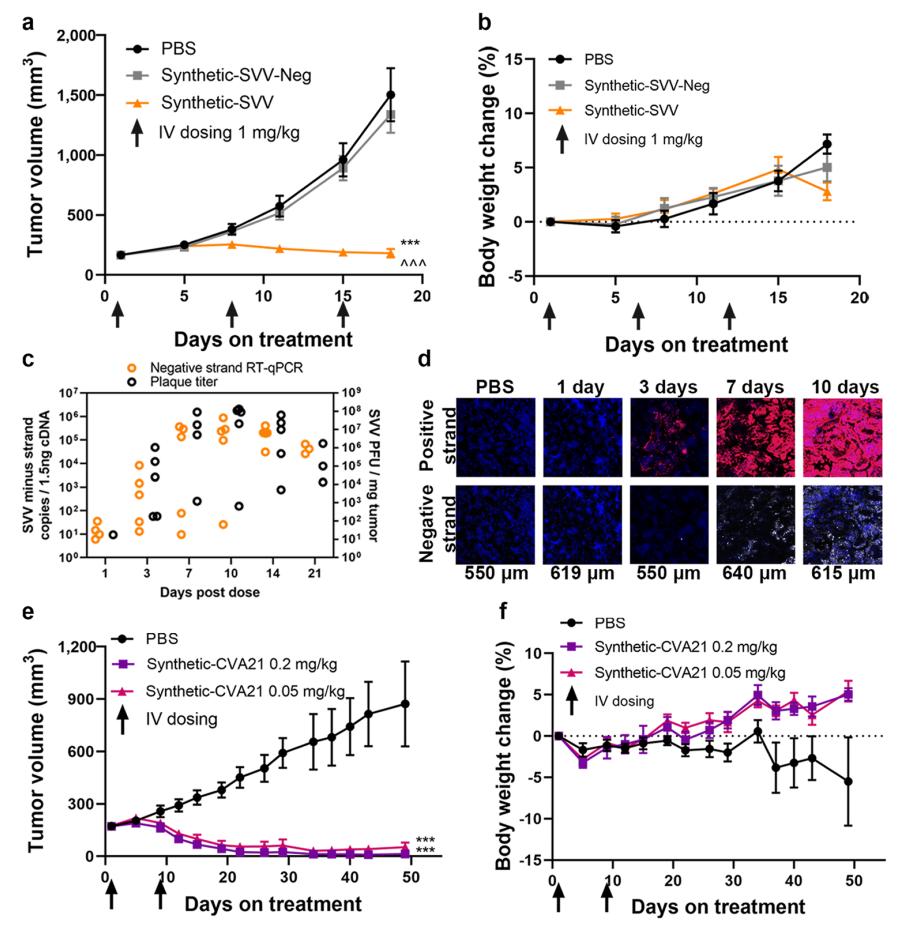
这一合成病毒具有良好的耐受性,并在多种肿瘤模型中证明了在静脉注射后能够选择性杀伤肿瘤细胞,导致肿瘤溶解和抗肿瘤功效。

在这项研究中,研究团队选择了两种病毒——塞尼卡谷病毒(SVV)和柯萨奇病毒A21 (CVA21),它们具有良好的溶瘤活性和临床安全性。这两种病毒的基因组是正义单链 RNA,在进入肿瘤细胞后,足以启动病毒生命周期。该研究报道了人工合成的 SVV 和 CVA21 的 RNA 病毒基因组(vRNA)传递和复制。
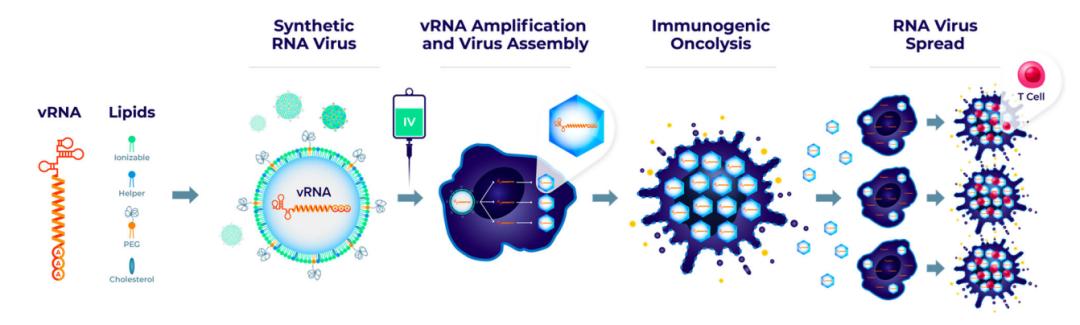
研究结果表明,这一合成病毒具有良好的耐受性,并在多种肿瘤模型中证明了在静脉注射后能够选择性杀伤肿瘤细胞,导致肿瘤溶解和抗肿瘤功效,还能增强 PD-1 抑制剂的抗肿瘤户型。这一合成病毒平台将解决溶瘤病毒重复静脉给药的局限性,提高溶瘤病毒的治疗潜力。
Oncorus 公司是一家临床阶段的溶瘤病毒疗法开发公司,成立于2015年,并于2020年10月在纳斯达克上市,上市之初市值为3.4亿美元,但目前其市值仅为2000万美元。

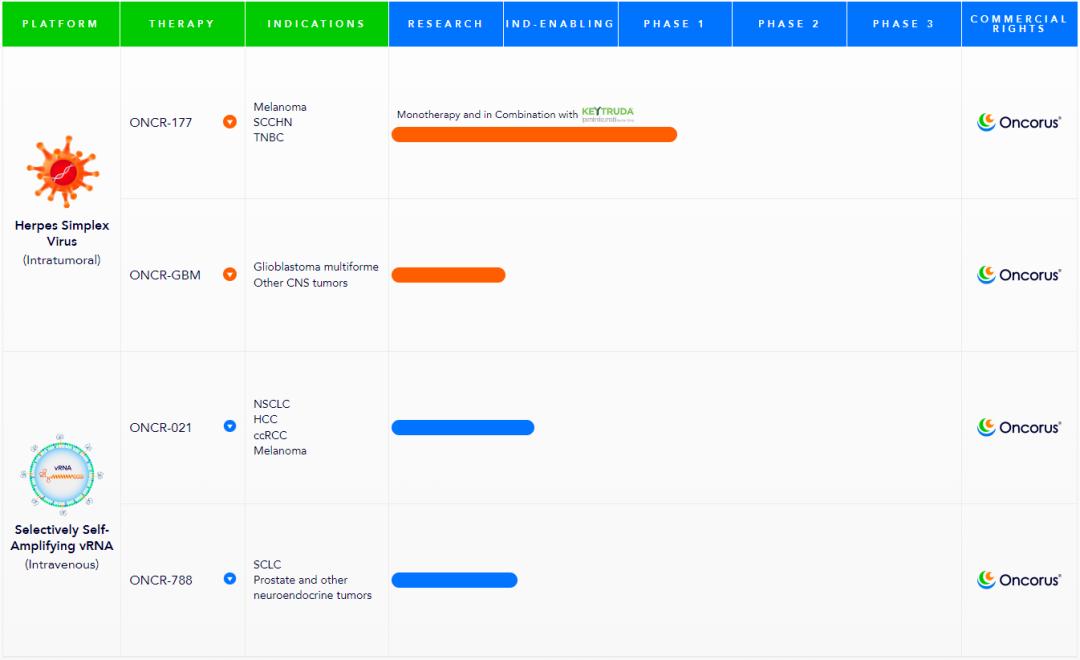
Oncorus 有两条主要的研发管线:分别是改良单纯疱疹病毒和合成病毒。
在改良溶瘤病毒方面,有两款在研疗法,均使用单纯疱疹病毒(HSV),分别是 ONCR-177(用于治疗黑色素瘤、头颈部鳞状细胞癌和三阴性乳腺癌),以及 ONCR-GBM(用于治疗胶质细胞瘤等中枢神经系统癌症),前者处于1期临床试验阶段。
在合成病毒方面,有两款在研疗法,均使用脂质纳米颗粒(LNP)递送 RNA 病毒基因组(vRNA),分别是ONCR-021,ONCR-788,前者编码优化的柯萨奇病毒A21 (CVA21),用于治疗非小细胞肺癌、肝细胞癌、透明细胞肾细胞癌、黑色素瘤,
预计将在2023年年中向 FDA 提交 IND 申请。后者编码优化的塞尼卡谷病毒(SVV),用于治疗小细胞肺癌、前列腺癌,以及其他神经内分泌癌症,将在 ONCR-021 之后提交 IND 申请。
参考资料:
https://www.nature.com/articles/s41467-022-33599-w
https://www.oncorus.com/pipeline/
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




