- +1
【学术前沿】PNAS | 深圳大学医学部许兴智教授/彭斌副教授团队发文揭示复制叉稳态维持的新机制
近日,深圳大学医学部许兴智教授/彭斌副教授团队在国际顶级学术期刊《Proc Natl Acad Sci U S A》发表了题为ASPM promotes ATR-CHK1 activation and stabilizes stalled replication forks in response to replication stress 的原创性研究成果。该报道揭示了ASPM作为支架蛋白促进TopBP1和RAD9在复制叉上的募集,从而促进了复制胁迫下ATR-CHK1信号轴的活化。同时,ASPM募集至阻滞的复制叉并保护新合成DNA链不被核酸酶降解,从而维持复制叉稳态的全新机制。该论文所有工作均在深圳大学完成,该团队博士生伍星璇、博士后许仕彬为共同第一作者,许兴智教授和彭斌副教授为论文的共同通讯作者。
先天性小头畸形(Congenital Microcephaly,MCPH)是一种罕见的常染色体隐形遗传病,大脑结构相对正常但大脑皮层尺寸小,头围相对于其年龄与性别要小三个标准差以上,且伴随神经发育迟滞和不同程度的智力障碍(Okamoto et al., 2018; Xu et al., 2020)。截止目前发现致病基因约有25个(MCPH1-25),其中MCPH5基因突变最为常见(约占40%)。MCHP5基因编码的蛋白也叫ASPM(Abnormal spindle-like microcephaly-associated protein),跟纺锤体组装配密切相关,对于有丝分裂和减数分裂中有丝分裂纺锤体的正确组装和排列是必要的。深入研究表明ASPM是决定大脑皮层尺寸发育的关键调节因子, 其突变后显著降低大脑皮层尺寸而诱发小头畸形,然而其发病的分子机制仍不清楚。
DNA复制是细胞最根本的生命活动之一,精准的复制基因组DNA并将其均分给子代细胞是维持我们物种稳定的根本(Saxena and Zou, 2022)。处于复制期的细胞,基因组DNA极易受各种内、外源因素的攻击而造成DNA复制叉停滞及DNA损伤。我们把在基因组复制过程中加诸在复制机器的挑战统称为“复制胁迫”,如DNA自身的化学修饰、高级结构等因素都会造成复制叉的停滞以及不稳定(Liao et al., 2018; Saxena and Zou, 2022)。复制胁迫下停滞的复制叉可快速激活蛋白激酶ATR(Ataxia-telangiectasia and Rad3 related)和周期检验点蛋白激酶CHK1(checkpoint kinase 1)级联信号通路来应答复制压力。该通路的激活对于稳定复制叉、激活S期周期检验点和重启停滞的复制叉至关重要,以确保基因组的稳定。

研究团队利用CRISPR-Cas9基因编辑技术构建了FLAG-ASPM knock in(KI)的细胞系,通过FLAG抗体富集的互作蛋白进行质谱鉴定,意外发现多个与DNA复制相关的蛋白。研究发现ASPM对于正常的DNA复制进程没有明显影响,但是影响复制胁迫下ATR-CHK1信号轴的激活。通过细胞和生化层面的实验证实,ASPM在RAD17的下游发挥功能。复制胁迫下ASPM被RAD17募集至阻滞的复制叉上,其N端(1-919 aa)作为平台募集TopBP1和RAD9至阻滞的复制叉,而后者是ATR激活的重要激活因子。发现复制胁迫下ASPM缺陷的细胞中阻滞复制叉上新合成DNA链被降解、阻滞的复制叉比率显著增加,而重启的叉明显减少。深入研究发现ASPM募集至阻滞的复制叉上可以拮抗核酸酶MRE11对新生链的降解。此外,还发现ASPM缺陷的细胞对复制胁迫药物羟基脲(HU)更为敏感,且显著增加了染色体畸变的比率。因此,ASPM对于复制叉稳态的维持对于后续DNA复制叉的重启和基因组稳定性的维持是至关重要的。
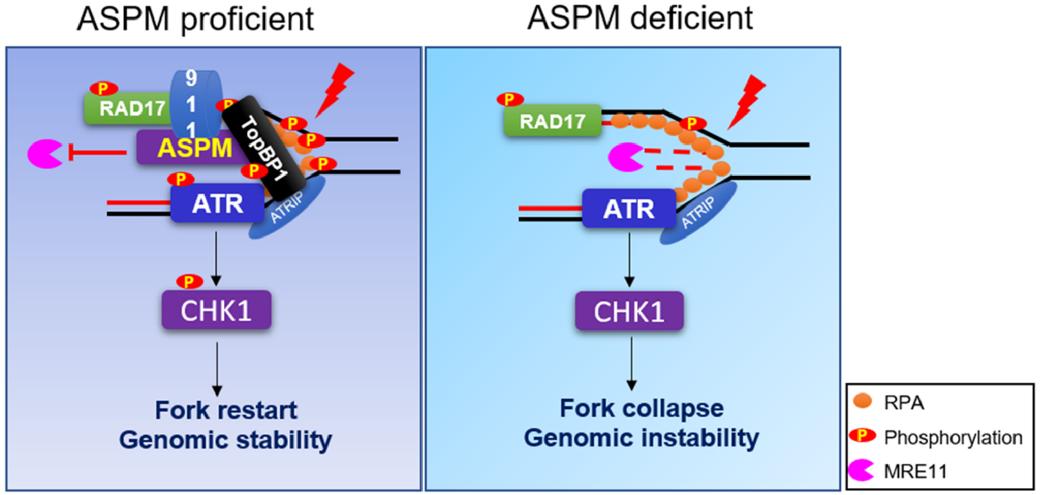
值得一提的是,哈佛大学医学院DNA复制胁迫领域国际著名教授Lee Zou在基因组稳定性专业杂志《Genome Instability & Disease》最新一期文章中,专门对该项工作发表了题为“Defective replication stress response linked to microcephaly”的评述(Kawale et al., 2022)。文中提到,ASPM不仅促进9-1-1复合物和TopBP1蛋白的募集,还保护了阻滞复制叉上新生DNA链不被降解。强调了复制胁迫的缺陷与先天性小头畸形致病机制存在关联。
许兴智教授团队长期致力于探讨先天性小头畸形致病基因的功能及其作用机制,首次揭示:1)MCPH1和ASPM是纺锤体蛋白(Zhong et al., 2005; Zhong et al., 2006);2)MCPH1通过调控BRCA1和CHK1而参与DNA损伤应答(Xu et al., 2004),ASPM通过调控BRCA1的稳定性而促进同源重组介导的DNA修复(Xu et al., 2021);3)ASPM促进ATR-CHK1检验点的信号传导并稳定阻滞的复制叉,从而避免复制叉的垮塌。基于这些开创性的研究成果,许教授团队提出基因组不稳定性是先天性小头畸形的核心致病机制(Xu et al., 2020)。
该课题组的研究依托深圳大学广东省基因组稳定性与疾病防治重点实验室、卡尔森国际肿瘤中心和马歇尔生物医学工程实验室,获得了国家基金委、广东省重点实验室和深圳市科创委的资助。
论文链接
doi: 10.1073/pnas.2203783119
原标题:《【学术前沿】PNAS | 深圳大学医学部许兴智教授/彭斌副教授团队发文揭示复制叉稳态维持的新机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。

- 教皇遗嘱公布
- 外交部:中方监督组见证缅北停火
- 神二十任务完成最后一次全区合练

- 【欧洲股市】欧洲三大股指22日全线上涨
- 【农产品】CBOT农产品期货主力合约收盘涨跌不一,大豆期货涨0.46%

- 约每76年环绕太阳一周的彗星,是人类首颗有记录的周期彗星
- 一部国产经典动画片,主人公是一只当警官的黑猫

- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司










