- +1
重庆大学罗忠/李孟桓团队:基于蛋白质的新型纳米激动剂可增强T细胞介导的抗肿瘤免疫应答
原创 转网 转化医学网

本文为转化医学网原创,转载请注明出处
作者:Mia
导读:cGAS-STING通路是一种重要的DNA传感机制,有望成为克服实体肿瘤免疫抗药性的靶点。最近,有研究团队开发了一种牛血清白蛋白(BSA)/铁蛋白nanoagonist,它结合了锰(II)离子和β-lapachone,能够协同激活树突状细胞(dc)中的cGAS-STING信号,从而引发强大的适应性抗肿瘤免疫。
9月28日,重庆大学生命科学学院团队在Nature Communications上发表了一篇题为“A protein-based cGAS-STING nanoagonist enhances T cell-mediated anti-tumor immune responses”的研究论文。该研究发现cGAS-STING纳米激动剂在体内增强了肿瘤特异性T细胞介导的免疫应答,能够对抗免疫原性差的实体肿瘤,为临床免疫治疗提供了一种强有力的方法。

https://www.nature.com/articles/s41467-022-33301-0
研究背景
01
免疫疗法是近年来引起广泛关注的抗肿瘤疗法,它是指刺激内源性免疫系统从而产生抗肿瘤作用的治疗方法。从机制上看,免疫疗法的治疗效果主要依赖于肿瘤特异性效应T细胞的动员。在此过程中,原始CD4和CD8 T细胞通过与抗原提呈细胞(APCs)上表达的抗原结合的II类和I类主要组织相容性复合体(MHC-II和MHC-I)相互作用而被激活。
然而,免疫疗法在实体肿瘤治疗中的应用始终具有挑战性。实体肿瘤能够在微环境中形成一种高度免疫抑制状态,以逃避T细胞介导的免疫消除。具体来说,肿瘤细胞通过抑制树突状细胞(DCs,人体内最强大的专职性抗原提呈细胞)的成熟和激活,深刻地干扰抗原呈递过程。由此产生的DC功能障碍将导致T细胞启动的失败,并最终导致免疫耐受。因此,恢复和刺激DC功能已成为重振T细胞介导的抗肿瘤免疫的重要策略。
环鸟苷单磷酸-腺苷单磷酸合酶-干扰素基因刺激因子(cGAS-STING)信号通路是人体内一种进化上保守的DNA传感机制,在调节肿瘤细胞与周围免疫细胞之间的相互作用中起着重要作用,是提高实体肿瘤免疫治疗有效性的一个有前景的靶点。然而,在临床试验中,几种STING激动剂的实际疗效并不显著,多种证据表明有必要在实体瘤DCs中合理选择STING激动剂和设计有效的cGAS-STING信号的治疗策略。
研究概述
02
研究人员报告了一种基于天然牛血清白蛋白(BSA)和铁蛋白的可被肿瘤微环境激活的纳米组件,通过利用Mn2+离子的cGAS-STING刺激功能,时空协调地将Mn2+传递到肿瘤树突状细胞,并诱导肿瘤细胞的免疫原性凋亡,从而导致树突状细胞中的cGAS-STING协同激活,引发强大的T细胞介导的抗肿瘤免疫。
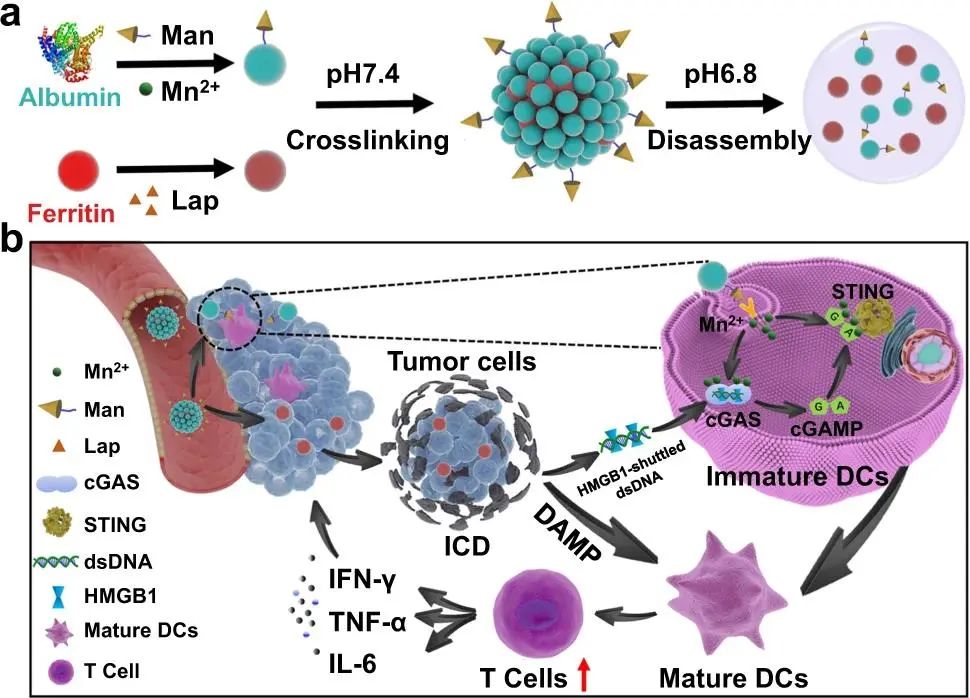
按需激活TME中的蛋白质纳米组件增强了免疫原性差的实体肿瘤的免疫反应
利用蛋白质结构中的多个修饰位点和金属结合位点,BSAs 首先用甘露糖(Man)基团功能化以靶向树突状细胞,然后通过简单的离子扩散方法(BSA-Man@Mn2+)装载Mn2+离子。同时,铁蛋白部分不仅能通过疏水相互作用将β-lapachone (Lap)包封在中央空腔(Ft-Lap)中获得高产,还能结合肿瘤细胞膜上过表达的转铁蛋白受体1 (TfR1),实现靶向Lap的传递。BSA-Man@Mn2+和Ft@Lap使用酸响应的席夫碱连接剂程序交联,以提供生理稳定的纳米组件(BSA-Man@Mn2+-Ft@Lap),它可以在微酸性的血管周围TME中迅速分解为高度扩散的单一蛋白单元,从而增强对实体肿瘤组织的渗透。
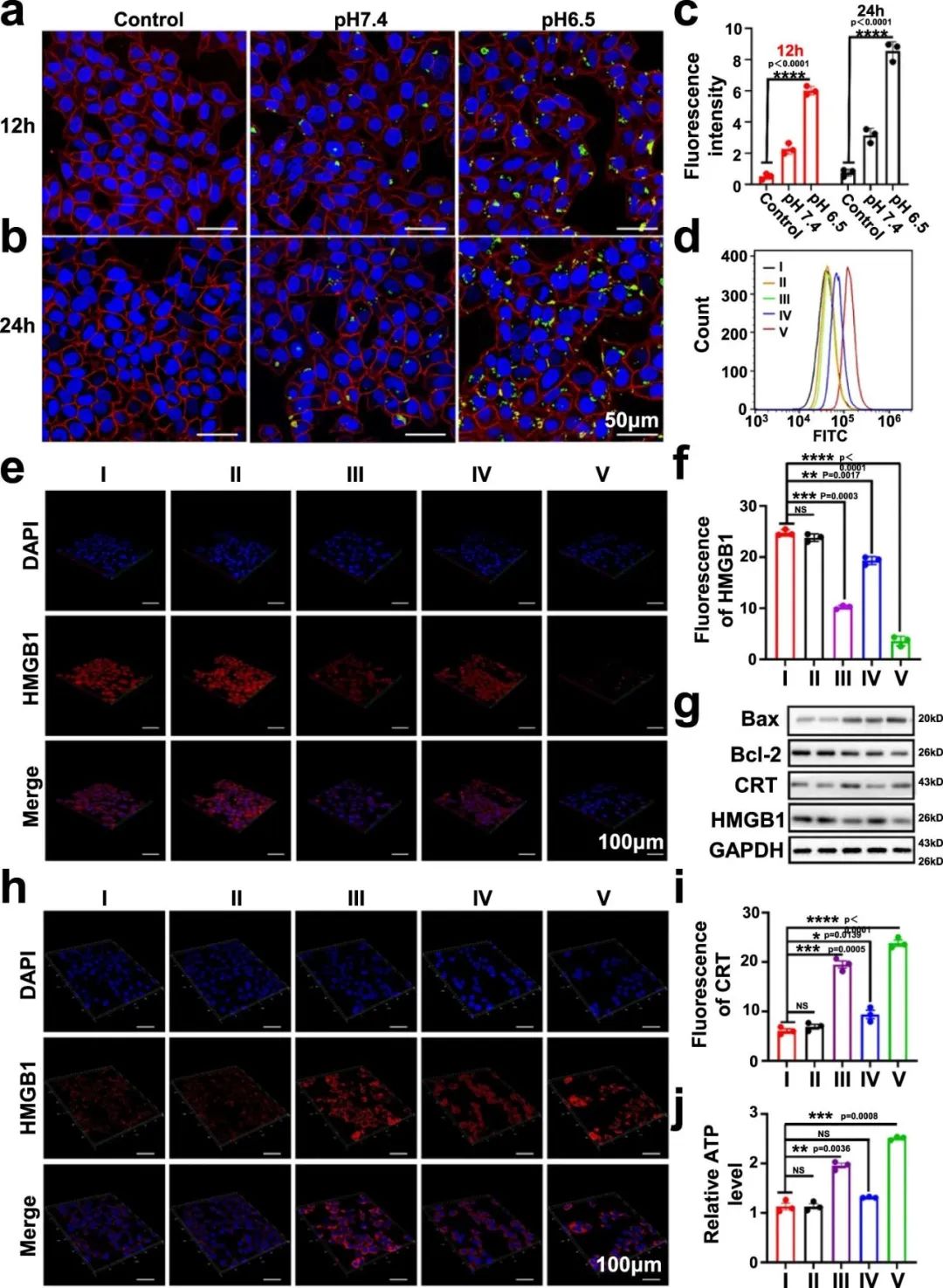
BSA-Man@Mn2+-Ft@Lap纳米组件通过Lap介导的化疗诱导肿瘤细胞免疫原性凋亡
具体而言,Ft@Lap通过TFR1介导的内吞作用被肿瘤细胞选择性摄取,诱导免疫原性凋亡,从而在DC中释放大量肿瘤源性dsDNA至TME中进行cGAS介导的DNA感知。而BSA-Man@Mn2+通过Man介导的配体-受体结合被DCs有效内化,经酶溶酶体降解释放Mn2+激活cGAS-STING轴,最终触发下游的免疫刺激转录活性。
研究总结
03
总之,本研究中基于蛋白质的cGAS-STING纳米激动剂可以协同作用于TME中DC介导的抗肿瘤效应T细胞的交叉启动,并改善免疫原性差的肿瘤模型的抗肿瘤免疫应答,为临床增强实体瘤免疫治疗适应症的疗效提供了新的机会。
参考资料:
https://www.nature.com/articles/s41467-022-33301-0
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




