- +1
首届顶科协奖解读|蛋白质核质转运机制研究,如何影响疾病诊疗
·核孔复合体不仅是艾滋、新冠等病毒攻击的对象,其蛋白突变还会导致自身免疫功能障碍、神经系统疾病、心血管疾病、癌症等疾病。
·针对importin等核转运蛋白的抑制剂被认为是抗肿瘤治疗的靶点。目前选择性的抑制核浆转运蛋白仍然具有很大的挑战,但是这也是有前景的方向。

2022年6月,Science杂志封面刊登核孔复合体近原子分辨率精细结构。
地球生命历经数十亿年演化,只有真核生物实现了向复杂多细胞生物的飞跃,细胞核的出现是个中关键的转折点。它是细胞的“控制中心”,存储和保护着遗传物质;在双层核膜的分隔下,基因在细胞核内转录,而后进入细胞质中转译,指挥相应蛋白质的组装生成。
所有细胞的生命活动,离不开核质之间频繁的物质交换和信息交流,而核膜上的核孔复合体(NPC)正是唯一的通道和“守门人”,严格把守着物质的输入与输出。核孔复合体不仅是艾滋、新冠等病毒攻击的对象,其蛋白突变还会导致自身免疫功能障碍、神经系统疾病、心血管疾病、癌症等疾病。因此对核孔复合体结构和功能机制的研究至关重要,延续了几十年仍有待新的突破。
1999年,因在“细胞内蛋白质输运的信号理论和分子机理”方面做出的杰出贡献,德裔科学家甘特·布洛贝尔(Günter Blobel)获得诺贝尔生理学或医学奖,他同时也是核孔复合体研究的先驱;
如今过了23年,奖金金额高达1000万元人民币的世界顶尖科学家协会奖“生命科学或医学奖”,刚刚授予又一位德国科学家迪尔克·格尔利希(Dirk Görlich),以奖励其“对于蛋白质在细胞质和细胞核之间运输的机理及其选择性的关键发现”。官方资料称,该奖项“旨在寻找那些在基础科学或医学领域做出开创性成果但却暂未得到认可的科学家遗珠”。

迪尔克·格尔利希获得首届世界顶尖科学家协会奖“生命科学或医学奖”。
格尔利希现年56岁,现任德国马克斯·普朗克多学科科学研究所(Max Planck Institute for Multidisciplinary Sciences)主任。
他在家乡德国哈勒市的马丁路德·哈勒维腾贝格大学获得生物化学硕士学位,之后加入细胞生物学教授Tom Rapoport在柏林的实验室攻读博士学位。1993年,他来到剑桥大学进行博士后研究,在英国细胞生物学家和癌症研究专家Ron. Laskey实验室工作期间,格尔利希首次发现了输入蛋白(importin),一种负责识别核蛋白信号并将蛋白质导入细胞核的媒介。
1996年,他成为海德堡大学ZMBH分子生物学中心的研究小组组长,随后在此任职教授。在此期间,他开发了RanGTP-梯度模型来解释核运输的方向性和能量。他的研究小组首次描述了输入蛋白的伴侣功能,并在发现和描述介导从细胞核中导出的输出蛋白方面发挥了作用。
更具原创性和重要意义的成果,则是他发现了本质上无序的核孔蛋白(FG域)可形成凝胶状相态,成为一个具有极强运输能力的高选择性的通透屏障。矛盾的是:一般的大分子会被“挡”在细胞核外,但如果这种大分子带有核输入信号并与输入蛋白结合,它穿越凝胶的流速会增加高达2万倍。他的团队至今仍在继续深入研究这种奇妙的特性,描绘FG结构域的相分离态和可溶态内聚力相互作用的动力学。
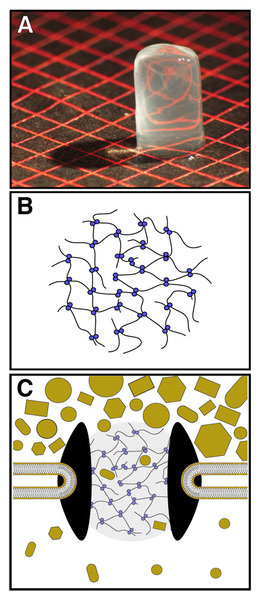
核孔蛋白的FG重复结构域在核孔内的局部浓度极高,形成一种高选择性的水凝胶,像一种三维筛子抑制惰性大分子的通过。
值得一提的是,近年来,格尔利希的研究小组还开发了纳米抗体作为细胞生物学工具,且能够被用于包括Covid-19、疟疾、细菌感染、败血症和自身免疫性疾病等疾病的治疗。这项技术可以替代传统的二级抗体,大幅减少用于抗体生产的动物数量,因而还为格尔利希及其同事赢得了德国联邦食品和农业部动物福利研究奖。
9月29日,澎湃科技连线同济大学附属东方医院转化医学研究中心副研究员徐亮,解读格尔利希在蛋白质核质转运机制研究方面的重要贡献。徐亮致力于研究心脏重大疾病的发病机制和治疗措施,研究兴趣为核孔蛋白与心脏疾病,曾揭示核孔蛋白特异调节离子通道的机制,明确了组织稳态失衡与疾病发生的因果关系。
对话
澎湃科技:细胞质和细胞核之间的蛋白质运输,重要性体现在哪里?核孔复合体在其中扮演了怎样的角色?
徐亮:真核细胞最显著的特征是存在内膜系统将细胞的亚结构分隔。这些亚结构之间的信息交流受到精细的调控。核孔是细胞核与细胞质之间交流的唯一通道,决定细胞内物质利用的精准配置。核孔复合体横跨核膜,由三十多种核孔蛋白形成。核孔复合体是由八个轴对称的结构组成,结构支架蛋白镶入其中,形成中央通道,在细胞质侧有细胞质环,与八个细丝结构相连,延伸到胞质内;在核侧有核环,与核篮结构相连。这些环状结构是核孔复合体基本结构单位,包含八个同轴的轮辐环,即膜环、内外环各两个、内外环间连接性核孔蛋白组成的环状结构,其中轮辐状的中心即为中央通道。
核孔蛋白大致分两类:第一类是牢固镶入核膜内的结构性支架核孔蛋白;第二类是外围元件核孔蛋白。FG(苯丙氨酸一甘氨酸)序列是核孔蛋白的特征之一。核孔复合体结构支架可与FG核孔蛋白结合,而FG核孔蛋白包含FG重复的结构域,可形成滤网样结构,选择性地与转运受体结合,参与选择性转运的调节。外围的细丝结构也存在FG重复的结构域,提示也起着选择性转运的作用。
核孔蛋白调控所有大分子物质的核质转运,精确且有选择性地调配各类RNA、蛋白质等物质的核浆分布。其参与或直接调控转录、复制、DNA损伤及修复、细胞有丝分裂、基因组稳定性、细胞衰老及死亡等各种重要细胞进程,对细胞生长、存活及疾病发生十分重要。
澎湃科技:在核质蛋白质运输的选择性机制研究方面,经历了哪些重要的阶段?
徐亮:大分子的转运需要有转运信号:核定位序列(NLS)用于底物转入核内,核输出序列(NES)则用于底物转出细胞核。这些信号由含有特异信号序列的转运因子识别。核转运蛋白就是这样的一类因子,包括importins 和 exportins,分别调节核输入和输出。
另一类重要的转运辅助因子是GTP结合蛋白Ran。核转运蛋白可与底物的定位序列结合,也能与FG核孔蛋白及 RanGTP酶结合。底物入核循环始于入核底物-核转运蛋白复合体的形成,随后复合体穿过核孔复合体到核内,核转运蛋白与RanGTP结合,使复合体解体。底物出核始于核转运蛋白-RanGTP二聚体与出核底物结合,穿过核孔复合体进入胞质,胞质中的RanGTP酶降解RanGTP,使复合体分离。核内外RanGTP浓度梯度差调控着核转运的进行。这样,核孔复合体通过对核质转运的严格调控,进而维持细胞稳态及调控细胞各种生理功能。
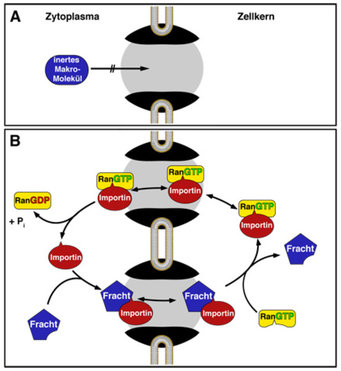
importin与RanGTP结合,在出入细胞核时释放运输的“货物”。
在核质蛋白质选择性运输的机制研究中,出现了好几个模型,比如虚拟门模型,可逆塌缩模型,Kap中心模型,森林模型和环圈模型。目前为止,格尔利希教授提出的选择性相模型最符合实验数据。该模型认为,核孔复合体具有显著的通透性透屏障。直径小于5纳米(或者小于30kDa)的分子可以自由渗透通过核孔。但随着扩散物质的直径越来越受到限制。直径接近或超过5 nm(或者大于30kDa)的分子只能在适当的核转运受体的帮助下,通过核孔。这些核转运受体在细胞核和细胞质之间不断穿梭,像货车一样,在细胞核膜的一侧搭载货物,以一定的方式穿过核孔屏障,在另一侧释放货物,并最终返回进行下一轮运输。
澎湃科技:格尔利希教授对于输入蛋白importin的发现,有着怎样的意义?目前对importin相关的致病机制有哪些认识和临床应用?
徐亮:输入蛋白(importin)是一类广泛分布于真核生物、相对保守的核转运蛋白,在胞质中结合具有核定位序列的蛋白,包括转录因子、剪接因子和其他蛋白等,通过核孔复合体运输到核内。importin的发现,对于了解蛋白质入核转运具有重大意义,是写进教科书的原创发现,对于生理、病理的调控提供了靶点。研究表明,importin与再生相关,在多种肿瘤,包括乳腺癌、肺癌、卵巢癌、胰腺癌、前列腺癌等表达上调。针对importin等核转运蛋白的抑制剂被认为是抗肿瘤治疗的靶点。目前选择性的抑制核浆转运蛋白仍然具有很大的挑战,主要是没法解决特异性问题,但是这也是有前景的方向。
澎湃科技:您怎么评价格尔利希教授对于核孔复合体的胶状相态的发现?它的意义是什么,目前还有哪些问题需要解决?
徐亮:核孔复合体大小约100 MDa,核心约120 nm宽,85 nm高,由核孔蛋白的FG重复序列构成类似“分子筛”的水凝胶结构,控制核孔的通透性。较大的核转运蛋白(货车)和蛋白(货物)形成复合体,通过与拮抗FG的相互作用,瞬时在局部打开一个小口,促使它们自己进入凝胶,最终从另一侧穿出。如果核转运蛋白和底物蛋白的比例不合适,核转运蛋白没有将底物蛋白覆盖或遮蔽,就会导致转运失败。
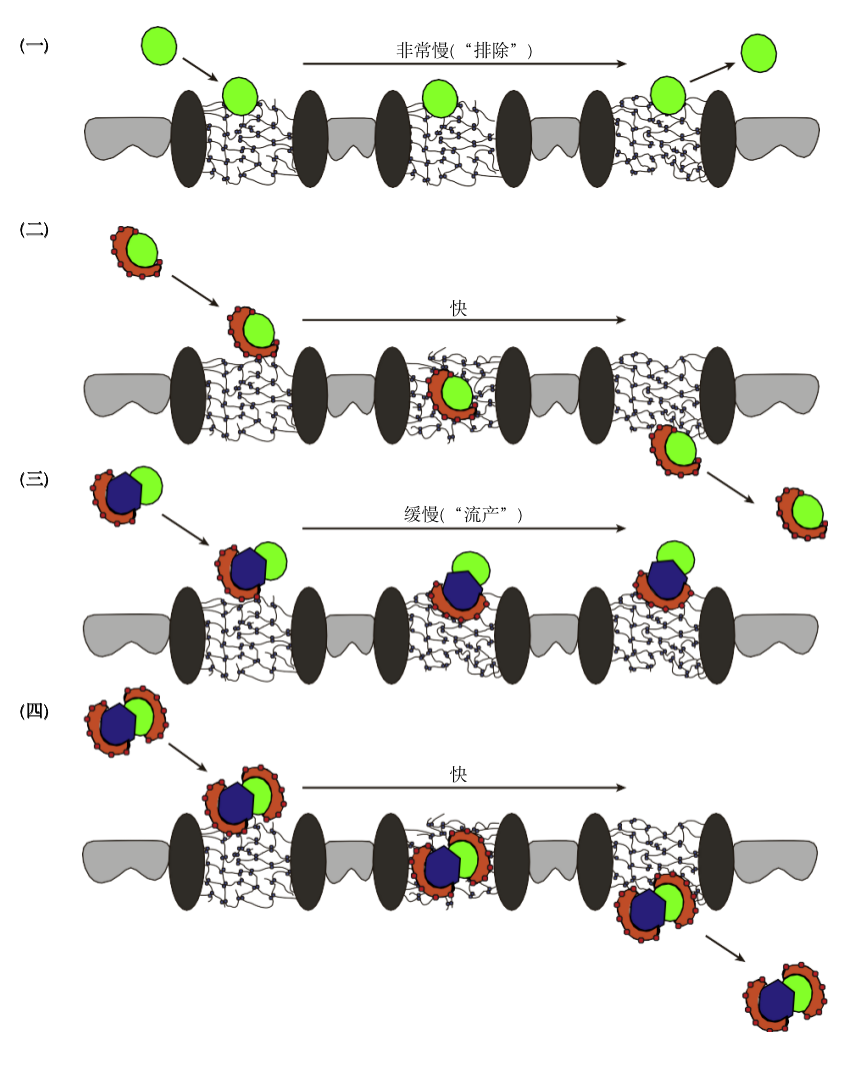
格尔利希提出的选择性相模型的核孔复合体通道。
格尔利希教授的理论很好解释了核孔复合体通透屏障的成因,核内RNA、小分子蛋白质的选择性通过核孔的机制。其原创性的发现深刻影响了后续的基础研究,以及相关的应用研究。目前仍有一些悬而未决的问题,比如FG序列是如何浓缩形成有效的核孔复合体屏障的?核转运蛋白是怎样不破坏核孔复合体的通透屏障而穿过去的?事实上,格尔利希教授在今年最新的研究中利用核孔蛋白Nup98仍在进行这些方面的研究。
澎湃科技:核孔复合体的结构被称作结构生物学的“圣杯”。今年6月初,Science杂志以封面专题形式发表了5篇相关蛋白结构解析的论文,从中有哪些新的发现?
徐亮:目前,我们已经能够以低分辨率显示整个核孔的结构,用高分辨率显示核孔组分的结构。但是利用这些信息将 30 多种不同的核孔蛋白正确组装,并构建高分辨率的三维结构一直是一项艰巨的挑战。最新的Science杂志关于核孔复合体结构解析的文章正是瞄准这一目标迎难而上。其中施一公团队报道了目前最高分辨率的非洲爪蟾核孔蛋白的细胞质环亚基。其他报道揭示了人类核孔蛋白的近乎原子的图片。这些研究采用了生化重组、X 射线晶体学、质谱、诱变和细胞生物学等传统方法,使用了改进的冷冻电子断层扫描重建了整个人类核孔复合体,引入了 AlphaFold 预测核孔蛋白的结构,并利用人工智能对组件进行准确建模。这些研究涉及的核孔复合体结构从核心支架到连接蛋白,从核膜锚定到胞质细丝,所揭示的分子组装丰富了我们对脊椎动物和人类核孔蛋白构建的理解,使我们对于核孔蛋白的认识达到了前所未有的高度。
澎湃科技:目前发现的核孔复合体相关的疾病有哪些?在这些疾病的诊治方面,目前药物开发的应用或前景如何?
徐亮:每个核孔复合体由约 1000 个蛋白质亚基组成,是嵌入核膜中的通道,可调节真核细胞核和细胞质之间大分子的运输。除了协调运输外,核孔复合体还组织重要的核和细胞质过程,例如转录、mRNA 成熟以及剪接体和核糖体组装。这些不同的角色使核孔复合体成为疾病相关突变和宿主-病原体相互作用的热点。核孔复合体相关的疾病在神经系统包括三联A综合征、额颞叶痴呆、肌萎缩侧索硬化症、帕金森病、亨廷顿病,病毒感染等。心血管疾病包括家族性房颤、内脏异位(一种先天性心脏病)、缺血性心肌病和扩张性心肌病等。
我们团队之前开发了一种核孔蛋白Nup54 腺病毒,应用于心肌损伤或急性心梗的治疗,已经在小鼠急性心梗模型中得到验证,可以维持和改善其心脏功能。其原理是:核孔蛋白Nup54定位于核孔复合物的中心通道位置,包含FG重复结构域和α-螺旋结构域,构成选择性通透屏障。通过干预核孔蛋白,调节重要功能基因mRNA的核浆转运,有助于短时间内动员mRNA存量,促进其蛋白翻译,从而发挥心肌保护作用。
有研究表明,核孔蛋白的表达具有一定程度的组织特异性、器官特异性和发育特异性,但是一个重要的问题是器官泛化表达的核孔蛋白如何发挥特异的功能?因此寻找时空特异表达的核孔蛋白,是认识核孔蛋白功能的重要方面,也是基于核孔蛋白药物开发的重要内容。同时,鉴定细胞特异和疾病特异的核转运相关调控因子,也是未来药物开发的一个方向。
获奖者个人简历
迪尔克·格尔利希(Dirk Görlich)
教育经历:
1989年,马丁路德·哈勒维腾贝格大学(哈勒/萨勒) 生物化学硕士
1990-1993年, 柏林MaxDelbrück分子医学中心(Max Delbrück Center)汤姆·拉波波特T.A. Rapoport柏林实验室 博士研究
1993年, 柏林洪堡大学 生物化学博士
工作经历:
1993年4月-9月,汤姆·拉波波特T.A. Rapoport实验室 博士后研究
1993年10月-1995年12月,英国剑桥大学威康信托/癌症研究行动研究所R.A. Laskey实验室 博士后研究员
1996-2007年,德国海德堡大学ZMBH分子生物学中心 研究小组组长
2001-2007年,德国海德堡大学 分子生物学教授
2005年至今,德国马克斯·普朗克生物物理化学研究所 科学成员、主任
2018-2019年,德国马克斯·普朗克生物物理化学研究所 常务主任
*2022年1月1日,位于哥廷根的两个研究所:马克斯·普朗克生物物理化学研究所和马克斯·普朗克实验医学研究所合并,成立为马克斯·普朗克多学科科学研究所。格尔利希教授在该研究所担任主任一职。
主要奖项和荣誉:
1993,德国生物化学学会卡尔·罗曼奖
1994,德国细胞生物学学会猎鹰奖
1997,欧洲分子生物学组织EMBO金奖
1997,欧洲分子生物学组织(EMBO)成员
1997,德国科学基金会 海因茨·迈尔·莱布尼茨奖
2001,阿尔弗里德·克虏伯大学青年教师奖(阿尔弗里德·克虏伯·冯·博伦和哈尔巴赫基金会)
2005,德国国家科学院院士
2018,德国联邦食品和农业部动物福利研究奖(与Tino Pleiner共同获得)
参考文献:
1. Dirk Görlich, Steffen Frey. Logistics on smallest possible space: Transport processes between cell nucleus and cytoplasm. Research report (imported) 2008 - Max Planck Institute for Multidisciplinary Sciences. https://www.mpinat.mpg.de/624111/research_report_456105
2. Schmidt HB, Görlich D. Transport Selectivity of Nuclear Pores, Phase Separation, and Membraneless Organelles. Trends Biochem Sci. 2016;41(1):46-61. doi:10.1016/j.tibs.2015.11.001
3. Najbauer EE, Ng SC, Griesinger C, Görlich D, Andreas LB. Atomic resolution dynamics of cohesive interactions in phase-separated Nup98 FG domains. Nat Commun. 2022;13(1):1494. Published 2022 Mar 21. doi:10.1038/s41467-022-28821-8





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




