- +1
武汉大学刘勇团队揭示代谢紊乱元凶之一:失活米色脂肪,抑制机体适应性产热
原创 转网 转化医学网

本文为转化医学网原创,转载请注明出处
作者:Lily
导读:大量研究表明,脂肪组织的产热效力与机体肥胖及相关代谢综合症具有明显的负相关性;而促进脂肪组织的产热活性将能够有效抑制例如肥胖和糖尿病等相关代谢性疾病的发展。内质网 (ER) 应激与肥胖和代谢疾病中的脂肪功能障碍有关。目前,人们尚不清楚脂肪细胞中的 ER 应激信号是否机械地介导产热脂肪的失调。近日,武汉大学刘勇团队在Nature Metabolism杂志发表最新研究成果,揭示了肌醇需求酶1α(inositol-requiring enzyme 1α, IRE1α)是一种关键的ER 压力传感器和信号传感器,IRE1α能通过抑制米色脂肪细胞活性,进而抑制机体的适应性产热,并在营养过剩的条件下促进肥胖及代谢紊乱的发展。
适应性产热与代谢稳态
01
脂肪组织是机体的重要代谢器官,它们对维持、调控全身能量稳态至关重要。进一步来看,脂肪组织细胞具有异质性,且能够根据环境线索来进行适应性重塑——白色脂肪组织(WAT),包括皮下和内脏 WAT,专门用于能量储存;棕色脂肪组织(BAT)专门用于耗散化学能以产生热量。
为响应外部刺激,例如冷暴露或 β3-肾上腺素能激动剂(例如儿茶酚胺),脂肪组织产热棕色脂肪细胞——表示为米色脂肪细胞——可以在称为“褐变”的过程中出现在 WAT 的特定区域内。米色脂肪细胞,类似于经典的棕色脂肪细胞,具有多房脂滴和高含量的线粒体和解偶联蛋白-1 (uncoupling protein-1, UCP1) ,以驱动产热。尽管两者具有相似的形态及生化特征,但是因为具有不同的发育起源和储存位置,米色脂肪和棕色脂肪细胞可能在其独特的组织微环境中具有不同的调节机制。
产热脂肪细胞不仅对能量消耗产生深远的影响,而且还调节整个脂肪组织的健康和全身代谢。鉴于其与脂肪组织功能障碍和代谢综合征的相关性,米色脂肪细胞的诱导募集在肥胖和 2 型糖尿病管理中的潜力是一个值得探索的领域。
内质网 (ER) 是一种膜结合的细胞器,不仅是蛋白质折叠和成熟的主要场所,也是营养传感和处理的主要场所。细胞代谢中蛋白质折叠的超载或扰动会引发 ER 应激,激活未折叠蛋白质响应 (unfolded protein response, UPR) 的三个典型分支,以维持 ER 完整性和细胞稳态——进化上高度保守的应激感应蛋白IRE1通路就是其中之一。
IRE1是定位于内质网的跨膜蛋白,其胞内段兼具核糖核酸内切酶和蛋白激酶的活性。在内质网应激条件下,IRE1蛋白发生寡聚化并通过自身磷酸化激活其核糖核酸内切酶活性,通过非常规剪接(Non-conventional Splicing)产生下游具有转录活性的转录因子XBP1s,同时通过mRNA降解(Regulated IRE1-dependent mRNA decay, RIDD)下调特定的基因表达水平,从而管控细胞的内质网应激状况。
在哺乳动物中,IRE1α能够在不同代谢组织细胞中感应机体的营养代谢状况,参与调节多种糖脂代谢过程。在营养过剩引发的肥胖过程中,脂肪组织会发生显著的内质网应激状况;但在脂肪细胞中,人们仍不清楚IRE1α信号通路是否及如何促发脂肪组织的功能异常。
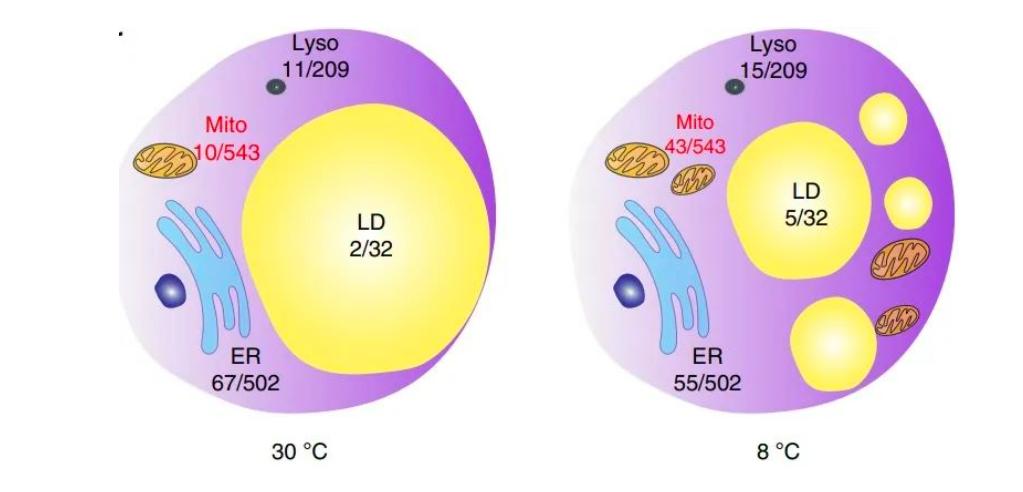
在 30 °C 或 8 °C 下,IRE1α缺失改变表达的基因数量与细胞器功能相关。(图源来源:Nature Metabolism )
IRE1α抑制米色脂肪细胞活性
02
武汉大学生命科学学院刘勇团队多年致力于探索内质网应激响应与代谢紊乱的机制关联。该团队前期的研究曾发现脂肪组织中IRE1α能够通过抑制抗炎巨噬细胞的M2极性活化,进而导致脂肪组织的代谢性炎症和能量消耗的异常,在肥胖和相关代谢紊乱的发生过程中发挥重要的促进作用。而在肝脏组织中,IRE1α又通过促进IKKβ和STAT3通路的双重机制,在肥胖背景下加剧脂肪性肝炎和肝细胞癌的发生发展进程。因此,在不同的病理生理学过程中,不同组织中IRE1α发挥的调控功能具有细胞特异性的机制特征。
9月19日,刘勇团队在Nature Metabolism 杂志发表了题为“Adipocyte IRE1α promotes PGC1α mRNA decay and restrains adaptive thermogenesis”的研究论文。该研究表明,肌醇需求酶1α(inositol-requiring enzyme 1α, IRE1α)是一种关键的ER 压力传感器和信号传感器,IRE1α能通过抑制米色脂肪细胞活性,进而抑制机体的适应性产热,并在营养过剩的条件下促进肥胖及代谢紊乱的发展。

https://www.nature.com/articles/s42255-022-00631-8
为了进一步研究内质网应激与产热脂肪功能异常之间的机制关联,研究团队通过动物模型发现:在冷刺激后,皮下白色脂肪和棕色组织中IRE1α通路被显著激活;这表明IRE1α蛋白可能参与调节脂肪组织的产热性重塑。
通过构建脂肪细胞中IRE1α特异性敲除小鼠(AKO)模型,发现在冷刺激下AKO小鼠具有更强的体温维持能力,即产热水平;其皮下腹股沟白色脂肪组织的棕色化程度也明显增强。
此外,在肾上腺素受体激动剂处理后AKO小鼠具有更高的机体代谢速率,它们皮下脂肪组织的脂解速率与棕色化速率也显著升高。进一步的体外研究结果表明,IRE1α蛋白缺失的米色脂肪细胞具有更高的UCP1蛋白表达水平、线粒体活性和脂质氧化能力。
利用转录组学等生物学技术检测技术,,研究团队解析了IRE1α调节脂肪组织棕色化的分子机制——IRE1α通过RIDD下调转录共激活因子PGC1α的表达水平,来制相关产热基因的表达程序。
治疗肥胖及相关代谢疾病的潜在干预靶点
03
随后,研究团队在高脂诱导的肥胖小鼠模型中发现,高脂饮食能够明显激活脂肪细胞中IRE1α的核糖核酸内切酶活性,同时显著下调PGC1α的表达水平。这些结果表明,在营养过剩的条件下,IRE1α-PGC1α通路可能促进了肥胖及代谢紊乱的发生发展。
进一步的代谢表型研究显示,AKO小鼠能够抵御高脂饮食诱导的肥胖及糖脂代谢紊乱,而且IRE1α核糖核酸内切酶的小分子抑制剂也能够显著缓解高脂诱导的肥胖进程,改善肥胖小鼠的葡萄糖代谢功能。这些结果表明,脂肪细胞中的IRE1α核糖核酸内切酶是治疗肥胖及相关代谢疾病的潜在干预靶点。
此项研究结果证实了脂肪细胞中IRE1α在脂肪组织代谢重塑中的重要功能,揭示了IRE1α-PGC1α信号轴对米色脂肪细胞活化的负反馈调控作用,为靶向IRE1α核糖核酸内切酶抑制肥胖及相关代谢性疾病提供了进一步的原理验证。
参考资料:
https://www.nature.com/articles/s42255-022-00631-8
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




