- +1
余发星团队发现Hippo通路细胞表面调控元件及肿瘤治疗新靶点
原创 Cell Press CellPress细胞科学

生命科学
Life science
2022年8月30日,复旦大学生物医学研究所/附属儿科医院余发星研究员团队在Cell Press细胞出版社期刊Cell Reports上发表了一篇题为“Transmembrane protein KIRREL1 regulates Hippo signaling via a feedback loop and represents a therapeutic target in YAP/TAZ-active cancers”的研究论文。该研究报道了跨膜蛋白KIRREL1不仅是Hippo信号通路的调控蛋白,同时也是该通路效应蛋白YAP/TAZ转录因子的靶基因,从而提出了Hippo信号通路相关肿瘤的靶向治疗新策略。复旦大学临床医学院八年制博士生顾远为本论文第一作者,余发星研究员为通讯作者。

Hippo Surfaced 河马浮出水面(图片由研究团队提供)
Hippo信号通路在肿瘤发生发展中起关键作用,其下游的YAP/TAZ转录因子在多种肿瘤中被显著激活,是肿瘤发生发展重要驱动因素。因此,靶向Hippo信号通路的肿瘤治疗策略具有巨大的临床转化前景。然而,目前Hippo通路靶向策略主要集中在通路核心激酶和YAP/TAZ转录活性方面,并且尚无相关药物进入临床用于肿瘤治疗。近年来,基于抗体和细胞的靶向治疗蓬勃发展,如果能鉴定出一种体现细胞Hippo信号通路活性的细胞表面蛋白标志物,将为Hippo信号通路靶向治疗带来全新的突破口。
在此背景下,该研究团队通过一种整合临床数据与蛋白相互作用组(interactome)的筛选策略,发现跨膜蛋白KIRREL1是Hippo信号通路全新调控元件。研究发现:1)KIRREL1同时结合Hippo通路核心元件LATS1/2及SAV1,有效介导Hippo信号传递;2)KIRREL1过表达显著抑制YAP/TAZ活性及遗传小鼠胆管癌发生,说明KIRREL1有较好的抗癌功能;3)YAP/TAZ直接调控KIRREL1基因转录,因此KIRREL1可以作为YAP/TAZ活性的细胞表面标志物以及生物大分子药物靶点。
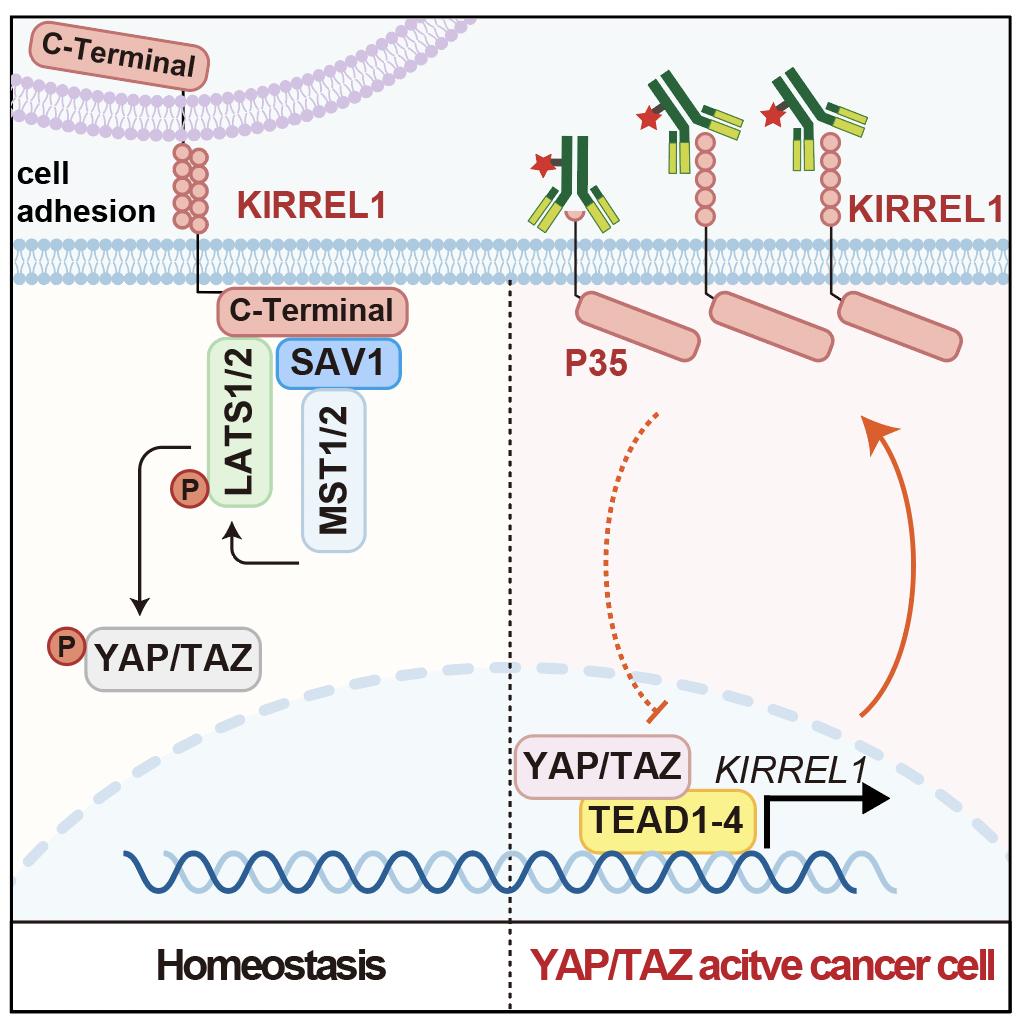
KIRREL1在Hippo信号网络中的作用与机制示意图
该研究发现了Hippo信号通路全新调控蛋白KIRREL1对于该通路精细的负反馈调控作用,并由此提出了Hippo信号通路新的靶向治疗策略。研究结果将有助于实现对YAP/TAZ活性依赖的肿瘤进行特异性识别与靶向治疗。本研究得到科技部重点研发项目,国家自然科学基金委面上项目,上海市科委、卫健委等项目及基金的支持。
作者专访
Cell Press细胞出版社公众号特别邀请余发星研究员代表研究团队接受了专访,请他为大家进一步详细解读。
CellPress:
Hippo通路核心成员大都是通过果蝇遗传筛选鉴定出来的,为何进化保守的KIRREL1直到现在才被发现?
余发星研究员:
KIRREL1是Hippo信号网络的一个负反馈机制,在正常组织中,YAP/TAZ活性受到严格抑制,多种细胞并不表达KIRREL1,因此在正常组织中敲除KIRREL1可能没有显著表型。相反,我们的研究主要基于肿瘤组织和细胞,在很多肿瘤组织和体外培养细胞中,YAP/TAZ呈现活化状态,导致KIRREL1表达。只有在这种前提条件下,KIRREL1的功能才被挖掘出来。我们戏称KIRREL1是Hippo通路的“隐形的翅膀”。该研究也体现出不同研究系统的优越性。
CellPress:
KIRREL1可能是第一个跨膜的Hippo信号通路调控元件和靶基因,这意味着什么?
余发星研究员:
KIRREL1是一个跨膜蛋白,其胞外段蛋白序列是理想的治疗靶点。KIRREL1的mRNA水平及蛋白水平在多种肿瘤中显著上升,并且同YAP/TAZ的活性高度正相关。这意味着针对KIRREL1的治疗性抗体或细胞能够实现对YAP/TAZ激活肿瘤的特异性识别及杀伤。
CellPress:
KIRREL1是抑癌因子,而临床肿瘤数据显示KIRREL1高表达与患者不良预后有关,如何解释这个看似矛盾的现象?
余发星研究员:
KIRREL1既是YAP/TAZ上游的调控蛋白,也是其下游靶基因。KIRREL1过表达在小鼠模型中抑制肿瘤形成,这体现出KIRREL1作为YAP/TAZ上游的调控蛋白,抑制YAP/TAZ活性的作用。临床数据显示KIRREL1高表达与患者不良预后有关,这是因为KIRREL1是YAP/TAZ下游靶基因,其高表达体现了YAP/TAZ高活性,而肿瘤中YAP/TAZ的过度激活与患者不良预后有关。需要指出的是,基因表达水平同预后的关系并不能说明该基因是oncogene还是tumor suppressor,这一点在后cancer genomics时代需要特别注意。
CellPress:
近期还有两篇研究论文报道了KIRREL1是Hippo信号通路的新调控蛋白,您对此有何评价?
余发星研究员:
我们非常高兴地看到, Novartis的Feng Cong与MD Anderson Cancer Center的Junjie Chen团队近期也分别报道KIRREL1是Hippo信号通路上游新的调控元件。多个团队报道新的调控元件,这在Hippo信号通路的研究中很常见。很开心能由多篇独立研究将KIRREL1引入Hippo信号通路,我们也期待后续会有更多研究者关注KIRREL1在Hippo信号通路中的功能及应用。
CellPress:
KIRREL1 p35的发现有什么意义?
余发星研究员:
KIRREL1 p35可能是一个可变翻译产生的变体,这是一个我们独有的发现。KIRREL1 p35不仅是保留了全长对Hippo信号通路的负反馈调节作用,其表达水平受到Hippo信号通路活性紧密的调控——其对YAP/TAZ活性的响应与Hippo信号通路最敏感的靶基因CTGF及CYR61类似。这意味着针对KIRREL1 p35的特异性治疗性抗体或细胞,能够实现对YAP/TAZ激活肿瘤更具特异性的靶向治疗。KIRREL1 p35在Hippo信号通路中有连接细胞内外的作用,类似于潜水艇的潜望镜,我们打算将其命名为“PeriHippo”。
CellPress:
KIRREL1同你们团队最近报道的SuperHippo有何异同?
余发星研究员:
SuperHippo是我们近期开发的一种同WWC家族蛋白相关的迷你基因,在抗肿瘤方面具有卓越的有效性和特异性。KIRREL1和WWC家族蛋白发挥功能的机制非常相似,都是同时招募LATS1/2和SAV1,介导Hippo激酶信号传递。WWC家族蛋白在器官发育过程中发挥重要作用,但是KIRREL1在正常条件下可能是“隐形的”,主要在病理条件下发挥功能。
CellPress:
后续将会继续开展哪些工作?
余发星研究员:
我们后续工作将聚焦基于KIRREL1的肿瘤标志物和抗癌药物开发工作。将会针对KIRREL1和KIRREL1 p35的胞外氨基酸序列开发特异性抗体及细胞治疗方法,并尝试在体内模型中进行靶向治疗的临床前研究。同时,我们目前正在进行多项小鼠实验,进一步检测KIRREL1在体内的作用,期待相关研究结果可以尽快与大家见面。

作者介绍

余发星
研究员
复旦大学生物医学研究院暨附属儿科医院研究员,博士生导师,上海高校特聘教授,中国高被引学者。课题组主要专注于发育疾病及肿瘤发生的分子病理机制研究,2015年迄今已在Cell, Molecular Cell, Cell Research, Cell Reports, Protein & Cell, EMBO Reports等高水平期刊发表多篇通讯作者论文。课题组目前承担国家自然科学基金、科技部重点研发及上海市科委等多项国家或省部级项目。

顾远
博士生
顾远,复旦大学临床医学八年制博士生。主要研究方向为:1)Hippo信号通路机制及转化研究;2)消化道肿瘤综合治疗。主要研究成果发表于Cell Reports(x2), Front Cell Dev Biol, Cell Signal等学术期刊。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Cell Reports上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Transmembrane protein KIRREL1 regulates Hippo signaling via a feedback loop and represents a therapeutic target in YAP/TAZ-active cancers
▌论文网址:
https://www.cell.com/cell-reports/fulltext/S2211-1247(22)01116-0
▌DOI:
https://doi.org/10.1016/j.celrep.2022.111296
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




