- +1
中山大学吴钧团队iScience:非编码RNA在骨组织工程中的应用之进展、挑战与策略
原创 Cell Press CellPress细胞科学 收录于合集#Cell Press论文速递 293 个 #iScience 48 个

交叉学科
Interdisciplinary
2022年7月20日,中山大学吴钧团队在Cell Press细胞出版社期刊iScience上发表了题为“Non-coding RNA delivery for bone tissue engineering: progress, challenges and potential solutions”综述。随着全球人口老龄化的加剧,骨关节炎、骨折、骨质疏松症等骨退行性疾病在全球范围内引起广泛关注。曾经被认为是基因“转录噪声”的Non-coding RNA(ncRNA)被报道在基因表达调控、个体发育和疾病的发展中发挥重要作用。将某些ncRNA高效递送至骨缺损部位调控基因表达可增强骨形成和骨髓间充质干细胞的成骨分化,因此成为一种潜在的治疗选择。文章对ncRNAs,如miRNAs、siRNAs、piRNAs和circRNAs的成骨调控机制进行了总结,并回顾了目前广泛使用的RNA递送载体或支架。另外,还讨论了RNA递送载体在骨组织工程应用中所面临的挑战和解决策略,为今后的临床应用提供理论基础。
ncRNA介导的成骨信号调控机制
miRNAs是一类长度为18-24个核苷酸的非编码单链RNA分子,由内源基因编码,在真核细胞的大多数细胞过程中发挥重要的调节作用。成熟的miRNAs与由Dicer酶、反式激活应答RNA结合蛋白(TRBP)和Argonaute蛋白组装形成的RNA诱导沉默复合体(RISC)结合,形成沉默复合物miRISC,通过识别靶mRNA并与其3'UTR或5'UTR结合发挥转录后调控功能。根据miRISC与靶mRNA的互补程度,当miRISC与靶mRNA完全互补结合时,靶mRNA被切割;当miRISC以不完全互补的方式与靶mRNA结合时,mRNA的翻译过程会受到抑制。
siRNA是一种长度为19-30个核苷酸的双链RNA,由正义链和反义链组成。利用递送载体将siRNA导入细胞后,其会与RISC中的Argouate 2组分相互作用,导致正义链的降解。随后反义链将RISC与siRNA形成的复合物引导至靶mRNA并以完全互补的方式与其结合,接着在结合位点精确切割mRNA分子,导致mRNA的降解,从而使编码mRNA的基因沉默。
在文章中,除了对上述两种研究较为广泛的非编码RNA进行了综述,还概括总结了piRNAs和circRNAs的成骨调控机制。其中,piRNAs能够与PIWI家族亚蛋白特异性结合形成piRNA/PIWI复合物(piRC),通过PIWI蛋白的引导识别并沉默靶mRNA来调控基因表达过程。而circRNAs主要是作为miRNA海绵间接调控miRNA下游靶基因的表达。所谓miRNA海绵,就是指circRNAs中含有大量miRNA的结合位点,可以与RISC竞争性结合胞质中游离的具有特定RNA结合域的miRNA,起到类似于海绵的miRNA吸收作用,从而调控miRNA下游靶基因的表达。上述几种ncRNAs可通过调控多种信号通路如WNT、TGF-β、PI3K/AKT等的下游靶点,促进骨髓间充质干细胞的成骨分化和骨形成。
用于骨组织工程的ncRNA递送载体
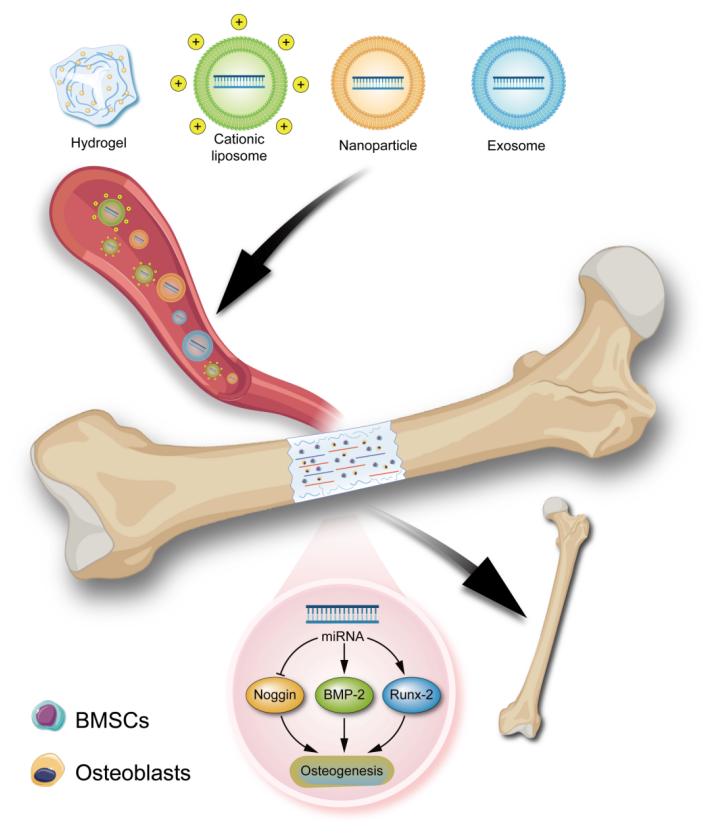
图1 用于骨缺损修复的ncRNA递送策略
由于ncRNAs在组织和细胞中容易被核酸酶降解,且静电斥力的存在会阻碍其进入细胞膜内。因此,开发能够高效负载ncRNAs并减少其脱靶效应的多功能载体具有重要意义。病毒载体的免疫原性等问题限制了其在基因治疗中的应用,而非病毒载体可用于大规模生产且具有较高的重现性。因此,文章对几种非病毒载体用于ncRNA的递送进行了详细的总结,如阳离子脂质体、合成纳米颗粒、外泌体、水凝胶等。
阳离子脂质体
脂质体是一种具有脂双分子层结构的封闭囊泡,大小在20 nm-1000 nm之间,通常会在制备过程中加入适量的胆固醇等成分使膜流态化。由于ncRNAs带负电荷,阳离子脂质体与ncRNAs络合后能够稳定ncRNAs并增强其对核酸酶的抵抗力,因此是应用最为广泛的ncRNA药物非病毒递送系统。此外,由于细胞膜带负电,这种静电吸引力促进了阳离子脂质体对细胞膜的吸附以及膜的内吞作用。然而,由永久性正电荷的阳离子脂质组成的递送系统可能会由于静电作用破环细胞膜,造成细胞毒性。因此,在血液循环中不带电但能够通过表面电荷转换在细胞内带正电荷的可电离脂质是未来阳离子脂质体的发展方向。此外,为了增强阳离子脂质体的柔顺性和亲水性,常常采用聚乙二醇(PEG)修饰的方式。PEG为脂质体提供了一个聚合物层,能够降低脂质体在体内与血浆蛋白的相互作用,延长在体内的循环时间并提高药物的稳定性。
尽管如此,脂质体递送的缺点仍然存在。由于脂质体的物理性能不稳定,因此难以控制药物释放的方式与时间。如何更好地针对靶细胞实现药物的高效递送及尽可能地减少细胞毒性是未来需要继续努力的方向。
水凝胶
水凝胶是一类由天然或合成聚合物组成的极为亲水的三维网络结构凝胶。由于其具备生物相容性、可生物降解性,且能够实现ncRNA治疗药物的持续释放,因此水凝胶是一个很有前途的ncRNA治疗药物递送平台。Kim等(Kim et al., 2021)利用磺基乙酸修饰壳聚糖制备了一种磺酸盐水凝胶,靶向Noggin的siRNA通过可见蓝光的照射与磺酸盐水凝胶共价结合。磺酸盐水凝胶-siRNA结合物能够显著延长siRNA的释放时间以持续抑制Noggin,从而增强成骨分化。
为了保护ncRNAs免受核酸酶的降解及提高水凝胶中ncRNAs的转染效率,一些策略已经被研发出来,如以水凝胶作为支架材料,将ncRNAs包裹在纳米颗粒中或以RNA复合物的形式进行递送。Wang等(Wang et al., 2017)开发了一种混合型纳米颗粒(NP)/水凝胶系统,水凝胶通过控制包载的siRNA/NP复合物的释放实现药物的持续递送,而NP能够高效转染siRNA并提供保护。
对于骨组织工程而言,一系列研究表明水凝胶具备将ncRNA治疗分子递送至骨缺损部位实现基因治疗的潜力。然而,ncRNA治疗药物在水凝胶中的释放需要进一步的调控,以促进水凝胶作为ncRNA递送平台用于骨组织工程的进一步发展。
外泌体
生物体内的所有细胞都会分泌细胞外囊泡(EVs),而外泌体是一种起源于内体的纳米级EV。内体与经内质网分类和高尔基体处理后的分子融合后形成多泡内质体,当多泡内质体成熟并与质膜融合后,其内容物作为外泌体释放到细胞外。外泌体携带核酸、蛋白质、脂质和一些代谢物,能够靶向受体细胞并通过膜融合或内吞作用被细胞摄取。此外,外泌体具有穿越体内天然屏障,如血脑屏障的能力,是一种体内的天然载体。近年来,外泌体已作为一种非病毒载体用于ncRNAs的递送,并展现出高生物相容性、低清除率且适合靶向细胞等特点。
此外,通过对外泌体表面蛋白质的“工程化”可以实现对特定部位的选择性靶向,避免在非靶向部位的积聚,从而降低ncRNA药物的毒副作用。从临床应用的角度,应当谨慎地对待目前出现的与外泌体相关的研究成果。其原因主要是目前没有普适的外泌体分离纯化方法,当前的分离纯化技术会导致一些其他组分不可避免地与外泌体混合,且没有一个统一的外泌体分离标准。因此,需要对外泌体的相关实验进行标准化以方便后续的科学研究。
合成纳米颗粒
纳米颗粒是粒径在10-1000nm的固体颗粒,已被用作ncRNA治疗药物的递送载体。比较常见的用于ncRNA递送的纳米颗粒通常含有阳离子组分,用于与RNA复合并通过静电相互作用吸附在细胞膜上促进细胞的摄取。目前,用于ncRNA递送的纳米颗粒可分为有机和无机纳米颗粒。
在体内,非特异性蛋白质的吸附是纳米颗粒用于临床ncRNA递送的一个挑战,会造成单核吞噬细胞系统(MPS)介导的清除率较高,往往需要增大剂量才能达到治疗效果(Stefan et al., 2016)。因此,如何设计纳米颗粒的结构尽可能避免体内非特异性蛋白质的吸附是一个亟待后续解决的重要问题。
除了上述四种ncRNA递送载体外,其他类型的载体也在文章中被提及,如纳米纤维、微球等。
总结与展望
WNT/β-catenin、PI3K/AKT和TGF-β等信号通路是调节骨形成和骨分化的重要生物学途径,ncRNAs通过靶向下游分子调节成骨、破骨细胞的动态平衡及干细胞的次级分化,进一步调控骨代谢和骨再生。多种递送载体可以进一步增强ncRNA的靶向性并避免RNA酶干扰,有望成为临床应用的新型治疗手段。其中以水凝胶为首的生物弹性载体支架不仅作为ncRNA的递送载体,同时为骨重建提供相应的结构支撑及血管、神经交互网络。其次,阳离子脂质体以及人工合成纳米粒因其较精确的结构调控可通过多种方式稳定ncRNA并提高靶细胞的摄取与吸收而同样被广泛用于ncRNA递送。近年来,新兴的天然外泌体由于具备较为优异的生物相容性,细胞靶向性及高生物活性,在ncRNA递送领域引起广泛关注和研究。
因此,对ncRNA的深入理解有助于基因递送载体的进一步设计。未来研究应着重探索ncRNAs的生物学功能及其在成骨信号传导中的调控机制。然而,ncRNA的不稳定性、脱靶效应和不良预后在一定程度上限制了ncRNA递送载体的设计及其临床应用。随着生物学、医学和工程学的不断发展,“精准”定制ncRNA递送载体将成为新型骨缺损修复材料的热点之一。
本论文完成人来自中山大学吴钧课题组,通讯作者为吴钧,第一作者为管世遥、张桢。
本文参考文献(可划动查看)
Kim, S., Fan, J., Lee, C.S., Chen, C., and Lee, M. (2021). Sulfonate Hydrogel-siRNA Conjugate Facilitates Osteogenic Differentiation of Mesenchymal Stem Cells by Controlled Gene Silencing and Activation of BMP Signaling. ACS Appl Bio Mater 4, 5189-5200.
Stefan, W., Anthony, J.T., Qin, D., Seiichi, O., Julie, A., Harold, F.D., and Warren, C.W.C. (2016). Analysis of nanoparticle delivery to tumours. Nature Reviews Materials.
Wang, Y., Malcolm, D.W., and Benoit, D.S.W. (2017). Controlled and sustained delivery of siRNA/NPs from hydrogels expedites bone fracture healing. Biomaterials 139, 127-138.
作者简介

吴钧
教授
吴钧,中山大学生物医学工程学院教授/博士生导师,国家青年特聘专家,广东省生物医学工程学会第十届常务理事。主持国家自然科学基金面上项目、国家卫计委科技重大专项(课题负责人)、广东省省级科技计划项目、广州市科技计划项目以及深圳市科技计划项目等多项科研项目。作为核心成员参加国家自然科学基金重点国际(地区)合作研究项目、广东省“珠江人才计划”创新创业团队等科研项目。
以第一作者或通讯作者在国际高水平期刊上发表约200篇高水平论文,其中超过50篇发表于影响因子大于10的领域主流顶级期刊Angew. Chem. Int. Ed.、Adv. Funct. Mater.、PNAS、Adv. Sci、Nano. Lett.、ACS Nano、Small。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊iScience上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Non-coding RNA delivery for bone tissue engineering: progress, challenges and potential solutions
▌论文网址:
https://www.cell.com/iscience/fulltext/S2589-0042(22)01079-3
▌DOI:
https://doi.org/10.1016/j.isci.2022.104807
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




