- +1
人类早期胚胎发育过程中H3K9me3的重编程图谱
原创 Cell Press CellPress细胞科学

生命科学Life science
作为世界领先的全科学领域学术出版社,细胞出版社特与“中国科学院青年创新促进会”合作开设“青促会述评”专栏,以期增进学术互动,促进国际交流。
2022年第二十二期(总第106期)专栏文章,由中国科学院动物研究所副研究员 中国科学院青促会会员 谭生军,就Cell Stem Cell中的论文发表述评。

从单细胞到多细胞生物,这是物种进化的一次重大突破,而受精过程也被认为是自然界最伟大的壮举之一。多细胞生物不同细胞都来源于最初的那个受精卵细胞。在此过程中,表观遗传的重塑对细胞命运决定至关重要,其中必然需要一个精确的调控网络来发挥作用,逐步形成一个全能的胚胎。异染色质修饰H3K9me3是一种抑制性的组蛋白修饰,通常被认为是细胞间命运转换的壁垒。在早期胚胎发育过程中,H3K9me3修饰经历大规模的重编程,介导了异染色质的重塑,从而完成后续的胚胎发育和细胞分化。
转座子元件广泛存在于真核生物中,它们可自由跳转到基因组新的位置,为物种进化提供原动力。但转座子自由跳转的特性也会造成基因组不稳定,威胁生命安全。基因组中大部分转座子通常会被表观遗传所沉默,主要包括DNA甲基化和组蛋白H3K9me3修饰两种方式。在人类和小鼠的合子基因组激活过程中发生了DNA去甲基化,大量的转座子,包括MERVL/HERVL类型的LTR逆转座子被激活,因此需要转换至H3K9me3修饰来沉默这些LTR逆转座子。然而,H3K9me3在人类早期胚胎发育过程中是如何重新编程的仍不清楚。
针对这一问题,近日来自同济大学的高绍荣教授团队利用CUT&RUN技术,首次在全基因组水平上描绘了人类植入前胚胎中H3K9me3重编程的高精度图谱,揭示了依赖于H3K9me3的异染色质的逐步建立过程,并且多种调控因子参与了8-细胞和囊胚期特异的H3K9me3修饰,同时阐释了H3K9me3修饰对人类早期胚胎发育中逆转座子沉默的重要机制,这将加深我们对组蛋白修饰和基因时空调控关系的理解。相关结果于2022年7月7日发表在Cell Press 旗下期刊Cell Stem Cell上。
在本研究中,作者首先检测了人类植入前胚胎发育过程卵母细胞、4-细胞、8-细胞、囊胚四个时期中,全基因组的组蛋白修饰信息(图1A-B)。H3K4me3和H3K27me3修饰主要集中在基因区间,只有H3K9me3修饰位于逆转座子区域(图1B-C),暗示了后者才是重要的调控因子。另外,与H3K4me3和H3K27me3修饰的剧烈变化不同,H3K9me3修饰在人类早期胚胎发育中是逐步建立的过程(图1D-E)。
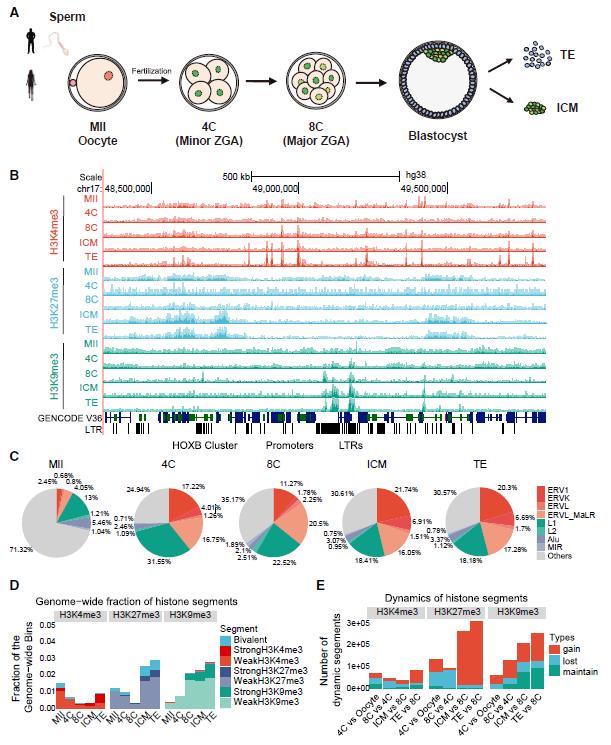
▲图1 人类早期胚胎组蛋白修饰的动态变化过程。
(A)人类植入前胚胎各个阶段样本提取。(B)UCSC Genome Browser快照显示H3K4me3、H3K27me3和H3K9me3修饰信号。(C)H3K9me3结构域在不同转座子中的分布。(D)三种组蛋白结构域在基因组上的占比。(E)三种组蛋白修饰在不同时期的动态变化。
为了进一步研究H3K9me3修饰在此过程中如何重编程,作者将H3K9me3结构域分为四组,分别代表从卵母细胞到囊胚四个时期特异的修饰情况(图2A)。总体而言,卵母细胞特异的H3K9me3结构域只占很小一部分;4-细胞和8-细胞特异的H3K9me3结构域主要集中在LTR逆转座子区域,但该修饰只是短暂地出现在这两个时期,只有少量继承到囊胚期;而囊胚特异的H3K9me3修饰出现在基因和远端区域,代表了成熟的异染色质,将启动谱系分化(图2A-B)。作者也发现,在LTR逆转座子区域,DNA甲基化与H3K9me3修饰呈负相关关系,即DNA甲基化逐步转换至H3K9me3修饰来实现LTR逆转座子的沉默(图2C)。可以发现8-细胞期特异的H3K9me3修饰只是短暂地出现,那它对LTR逆转座子的调控是否有那么重要的影响呢?结合DNA甲基化和表达数据,作者发现这些修饰针对的主要是ERVL-MaLR和ERV1家族的LTR逆转座子,它们在4-细胞期被激活,有表达信号,随后在8-细胞期被上述H3K9me3修饰所沉默;而囊胚期特异的H3K9me3修饰针对的主要是ERV1和ERVK家族的LTR逆转座子,它们则在4-细胞和8-细胞有活性,随后在囊胚期被沉默(图2D-E)。因此,不同时期特异的H3K9me3修饰能够保证不同类型的LTR逆转座子先后被沉默。
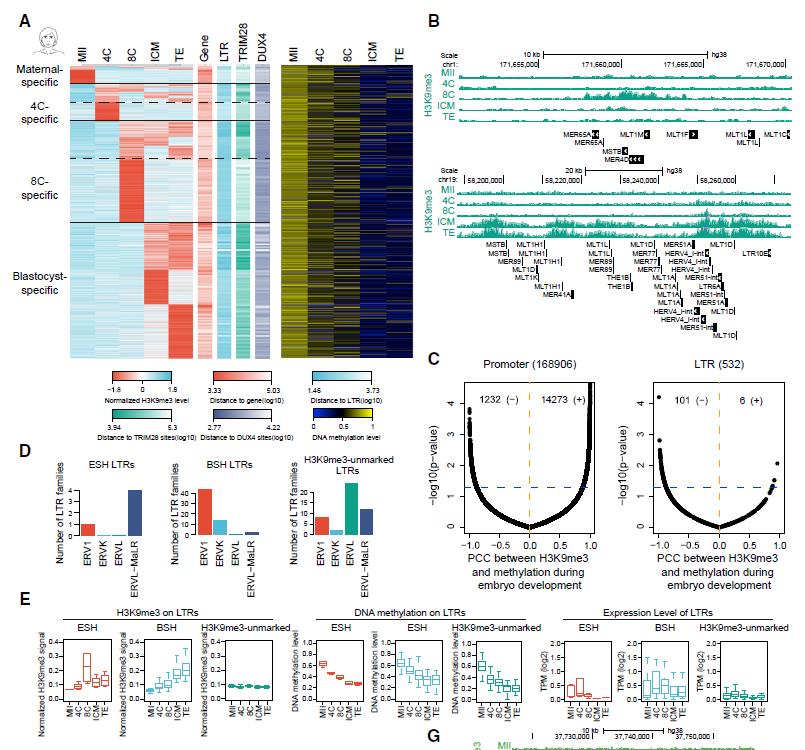
▲图2 H3K9me3与DNA甲基化对人类早期胚胎LTR逆转座子表达的组合调控。
(A)热图显示H3K9me3与DNA甲基化在不同时期的动态变化。(B)UCSC Genome Browser快照显示8-细胞、囊胚期特异的H3K9me3修饰。(C)启动子和LTR逆转座子区域的H3K9me3修饰和DNA甲基化水平的相关系数。(D-E)被8-细胞期(ESH)、囊胚期(BSH)特异的H3K9me3标记或未被H3K9me3标记的LTR逆转座子数量分布、H3K9me3修饰、DNA甲基化和表达水平。
随后,作者想探究是哪些调控因素导致LTR逆转座子被如此精确地沉默。借助ChIP-seq数据,作者发现SETDB1、TRIM28和KRAB-ZNF是H3K9me3修饰介导LTR逆转座子沉默的重要调控因子,它们的表达谱也主要分布在8-细胞和囊胚时期,与H3K9me3修饰的时期特异性相符(图3A-B)。进一步研究发现,TRIM28、SUMO2、KRAB-ZNF主要调控囊胚期的LTR逆转座子沉默;DUX4、EOMES、CHD2负责8-细胞期的LTR逆转座子(图3C-D);不同KRAB-ZNF家族成员对应不同LTR逆转座子,导致它们在早期胚胎发育不同时期的阶段性沉默(图3E)。在小鼠早期胚胎中敲除Dux或敲低Zfp51这两种ZNF的实验,也证实了它们确实参与调控了时期特异的H3K9me3修饰。
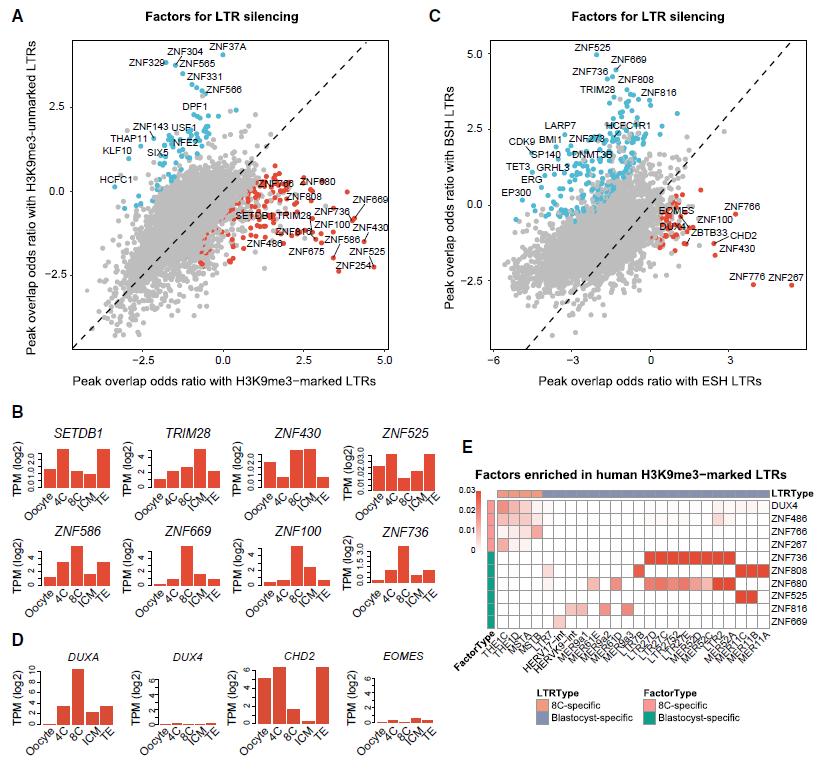
▲图3 8-细胞和囊胚期特异的H3K9me3修饰LTR逆转座子的调控因子。
(A)转录调控因子与H3K9me3标记或H3K9me3未标记的LTR逆转座子重叠的比值比。(B)SETDB1、TRIM28、ZNF430、ZNF525、ZNF586、ZNF669、ZNF100、ZNF736在人类胚胎中的表达水平。(C)转录调控因子与ESH或BSH特异标记的LTR逆转座子重叠的比值比。(D)DUXA、DUX4、CHD2、EOMES在人类胚胎中的表达水平。(E)热图展示在ESH和BSH特异标记的LTR逆转座子中DUX4和ZNF的富集峰。
总而言之,这项研究利用CUT&RUN技术首次绘制了人类早期胚胎发育过程中H3K9me3介导的异染色质重编程图谱。H3K9me3修饰在此过程中逐步建立并加强,实现了对不同LTR逆转座子的沉默。这一研究也首次揭示了LTR逆转座子衍生的增强子被H3K9me3介导的异染色质所沉默可能早在合子阶段就已开始,并且在人类和小鼠中高度保守。最后,这一研究揭示了人类合子基因组激活和第一次谱系分化过程中独特而保守的H3K9me3重编程过程,并解锁了人类植入前胚胎发育中异染色质重组的黑匣子。
有趣的是,Cell Stem Cell同日发表了另一项类似的研究。来自中山大学的王继厂教授团队利用AULiChIP-seq技术检测了人类植入前胚胎发育不同时期的H3K9me3修饰的动态变化。类似的,作者发现H3K9me3修饰显著地富集在逆转座子区域。不同的是,作者重点关注了一类人科特异的non-LTR类型的逆转座子SVA。在这项研究中,作者探讨了H3K9me3修饰在人类早期发育中发挥的两个重要作用:一方面,在8-细胞时期,H3K9me3重编程帮助SVA衍生的增强子与某些相关基因在时空的相互作用,促进了合子基因组激活;另一方面,H3K9me3修饰抑制了较为年轻、仍有活性的non-LTR逆转座子(包括L1和SVA_D/F),保护了基因组完整性并调节发育基因的表达。这两项工作使用不同技术,全面地描绘了H3K9me3修饰如何对不同LTR和non-LTR逆转座子实现沉默,帮助我们综合理解人类早期胚胎发育的表观遗传调控网络是如何进化的这一重要科学问题。
论文摘要
异染色质修饰H3K9me3对细胞命运决定而言至关重要。然而,在人类早期胚胎发育过程中,H3K9me3重编程是如何实现的并不清楚。在这项研究中,作者分析了人类卵母细胞和早期胚胎中全基因组水平的H3K9me3修饰情况,发现在8-细胞、囊胚时期,逆转座子重复元件LTR上存在时期特异的H3K9me3修饰:8-细胞期特异的H3K9me3修饰是暂时性地出现,而囊胚期特异的H3K9me3修饰则更稳定地存在。经鉴定,DUX和多种KRAB-ZNF是构建8-细胞、囊胚期特异的H3K9me3修饰的潜在因子。有趣的是,在小鼠早期胚胎中敲除Dux或敲低Zfp51会削弱这种时期特异的H3K9me3修饰变化情况。此外,作者在人类囊胚中观察到H3K4me3/H3K9me3和H3K4me3/H3K27me3二价染色质结构域,这为谱系分化提供了启动条件。总体而言,这些数据揭示了在人类植入前胚胎发育过程中,从DNA甲基化到H3K9me3的表观遗传转换保证了对逆转座子的精确调控。
H3K9me3, as a hallmark of heterochromatin, is important for cell fate specification. However, it remains unknown how H3K9me3 is reprogrammed during human early embryo development. Here, we profiled genome-wide H3K9me3 in human oocytes and early embryos and discovered stage-specific H3K9me3 deposition on long terminal repeats (LTRs) at the 8-cell and blastocyst stages. We found that 8-cell specific H3K9me3 was temporarily established in enhancer-like regions, while blastocyst-specific H3K9me3 was more stable. DUX and multiple KRAB-ZNFs were identified as potential factors for establishing 8C- and blastocyst-specific H3K9me3, respectively. Intriguingly, our analysis showed that stage-specific H3K9me3 allocation was attenuated by either Dux knockout or Zfp51 knockdown in mouse early embryos. Moreover, we observed the existence of H3K4me3/H3K9me3 and H3K4me3/H3K27me3 bivalent chromatin domains in human blastocysts, priming for lineage differentiation. Together, our data unveil that the epigenetic switch from DNA methylation to H3K9me3 ensures the precise regulation of retrotransposons in human preimplantation embryos.
中文内容仅供参考,请以英文原文为准
述评人简介

谭生军
中国科学院动物研究所副研究员
中国科学院青促会会员
tanshengjun@ioz.ac.cn
谭生军,中国科学院青促会会员,中国科学院动物研究所副研究员。主要研究方向:新基因的演化,新基因的产生机制,转座子,进化基因组学和计算基因组学等。从事的研究发现了LTR转座子和TIR转座子介导基因重复的新机制,推动突变机制如何影响适应性进化过程;同时,利用进化学理论探索了转座子的转化应用,开发转座子载体工具。目前在Nature Communications, Genome Research, Genetics等杂志发表多篇论文。
Shengjun Tan is an associate professor in the Institute of Zoology, Chinese Academy of Sciences. He has been the member of Youth Innovation Promotion Association, Chinese Academy of Sciences since 2018. His research interests include the evolution of new genes, mechanisms to generate new genes, transposon, evolutionary genomics and computational genomics. His studies have identified two novel mechanisms of LTR retrotransposon and TIR transposon-mediated gene duplication, and how these mutational mechanisms influence adaptive evolution. He has also developed the transposon-based vectors to transfer genes using the evolutionary theory. He has published several important papers in Nature Communications, Genome Research, Genetics and other journals.
向下滑动阅览英文简历
相关论文信息
原文刊载于CellPress细胞出版社
旗下期刊Cell Stem Cell上,


中国科学院青年创新促进会(Youth Innovation Promotion Association,Chinese Academy of Sciences)于2011年6月成立,是中科院对青年科技人才进行综合培养的创新举措,旨在通过有效组织和支持,团结、凝聚全院的青年科技工作者,拓宽学术视野,促进相互交流和学科交叉,提升科研活动组织能力,培养造就新一代学术技术带头人。
Youth Innovation Promotion Association (YIPA) was founded in 2011 by the Chinese Academy of Science (CAS). It aims to provide support for excellent young scientists by promoting their academic vision and interdisciplinary research. YIPA has currently more than 4000 members from 109 institutions and across multiple disciplines, including Life Sciences, Earth Science, Chemistry& Material, Mathematics & Physics, and Engineering. They are organized in 6 discipline branches and 13 local branches.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




