- +1
Cell:天津医大总医院刘强课题组发现骨髓造血异常驱动多发性硬化进展
原创 Cell Press CellPress细胞科学 收录于合集#Cell Press对话科学家 167 个 #Cell 75 个

生命科学
Life science
2022年6月15日,天津医科大学总医院神经内科刘强教授课题组在Cell Press细胞出版社期刊Cell《细胞》上,在线发表了题为“Bone marrow hematopoiesis drives multiple sclerosis progression”的论文。课题组使用单细胞测序、谱系分析和流式细胞术,系统分析了MS患者在疾病活动期骨髓造血系统的特征。研究结果提示MS患者骨髓异常髓系增生,可促进T细胞发生克隆扩增。
▲长按图片识别二维码阅读原文
多发性硬化(Multiple sclerosis, MS)是一种由自身免疫机制所导致的中枢神经系统炎性脱髓鞘疾病,具有终身性、进行性和致残性的临床特点。MS大多数患者在20-40岁首次发病,是导致青壮年残疾的最主要病因,对患者家庭造成沉重的经济和心理负担。
MS患者的自身免疫反应主要由外周免疫器官产生的自身反应性T细胞介导,造成中枢神经系统炎性损伤。既往对于MS患者的研究,局限于外周血和脑脊液的自身反应性T细胞。骨髓作为中枢免疫器官,是成人主要的造血器官,产生各种免疫细胞,对启动和维持机体免疫应答具有核心作用。然而,当前还不知道,骨髓造血系统在T细胞自身免疫反应起源与演变的过程中具有哪些作用?对MS疾病进展又有什么影响?
天津医科大学总医院神经内科刘强教授课题组使用单细胞测序、谱系分析和流式细胞术,系统分析了MS患者在疾病活动期骨髓造血系统的特征。单细胞测序和流式细胞分析表明,MS患者骨髓造血系统上游的造血干细胞(Hematopoietic stem cells, HSCs)发生活化,出现髓系偏倚现象,即骨髓髓系前体细胞生成明显增多。通过谱系分析发现,MS患者HSCs上调髓系转录因子,引起HSCs后续向髓系前体细胞分化增加,进而导致下游的单核细胞和中性粒细胞等髓系细胞明显增加。这是一个意外的发现,因为传统观点认为MS主要由淋巴细胞的增生驱动。为了评估髓系增生对自身反应性T细胞的影响,课题组使用T细胞受体测序,发现MS患者骨髓T细胞的TCR克隆数量和比例明显增高,提示MS患者骨髓内的T细胞发生克隆扩增,T细胞的多样性明显增加。这些发现揭示MS患者骨髓造血系统发生髓系偏倚,单核细胞和中性粒细胞等髓系细胞生成增加。提示MS患者骨髓异常髓系增生,可促进T细胞发生克隆扩增。
为了明确骨髓出现髓系增生的原因,课题组通过蛋白质组筛选发现,MS小鼠模型骨髓微环境的趋化因子CXCL12,可趋化神经抗原特异性T细胞迁移至骨髓。Nano-string RNA测序显示,神经抗原特异性T细胞归巢至骨髓后高表达CCL5,可作用于表达CCR5的造血干细胞,导致HSCs发生髓系偏倚。为了揭示骨髓发生异常髓系增生对中枢神经系统炎性损伤的作用,课题组使用谱系示踪技术追踪了MS小鼠模型骨髓造血干细胞分化产生的新生细胞命运图谱。结果显示,骨髓造血干细胞分化生成的髓系细胞多分布在骨髓和中枢神经系统。使用骨髓嵌合体小鼠,结合四聚体识别神经抗原特异性T细胞的结果显示,MS小鼠骨髓异常髓系增生可在骨髓和脑内扩增神经抗原特异性T细胞,加重神经炎症和脱髓鞘损伤。这些发现表明,骨髓异常髓系增生对T细胞自身免疫和多发性硬化进展具有驱动作用(图1)。
这项研究发现了MS患者的骨髓造血系统存在异常病变,揭示了骨髓异常髓系增生可驱动MS神经炎症和自身免疫反应进展的新机制。在这些新发现的基础上,课题组提出了“通过再平衡骨髓造血系统,回归机体免疫稳态,从而减轻中枢神经系统自身免疫和炎性损伤”的新理论。该研究的完成,是基于神经免疫疾病临床实践中所面临的问题,通过基础研究发现新机制,提出新理论。这些工作体现了“源于临床,归于临床”的医学研究范式,为脑疾病的创新治疗提供了新思路。近期,课题组主持开展了基于“骨髓免疫调节”理论新疗法的多中心临床研究(NIH临床试验登记号:NCT05154734,NCT05369351)。课题组正在研究靶向骨髓造血系统的免疫干预,能否使MS患者的免疫系统回归稳态。
近年间,刘强课题组系统研究了免疫系统在脑卒中、多发性硬化和脑衰老等不同类型脑疾病中的病理作用,以及临床免疫干预手段。考虑到神经炎症是多种重大脑疾病中的共性机制和脑疾病的高发病率特点,这些研究成果面向脑疾病领域未满足的临床医疗需求,具有广阔的临床应用潜力,有望减轻脑疾病造成的沉重社会经济负担。
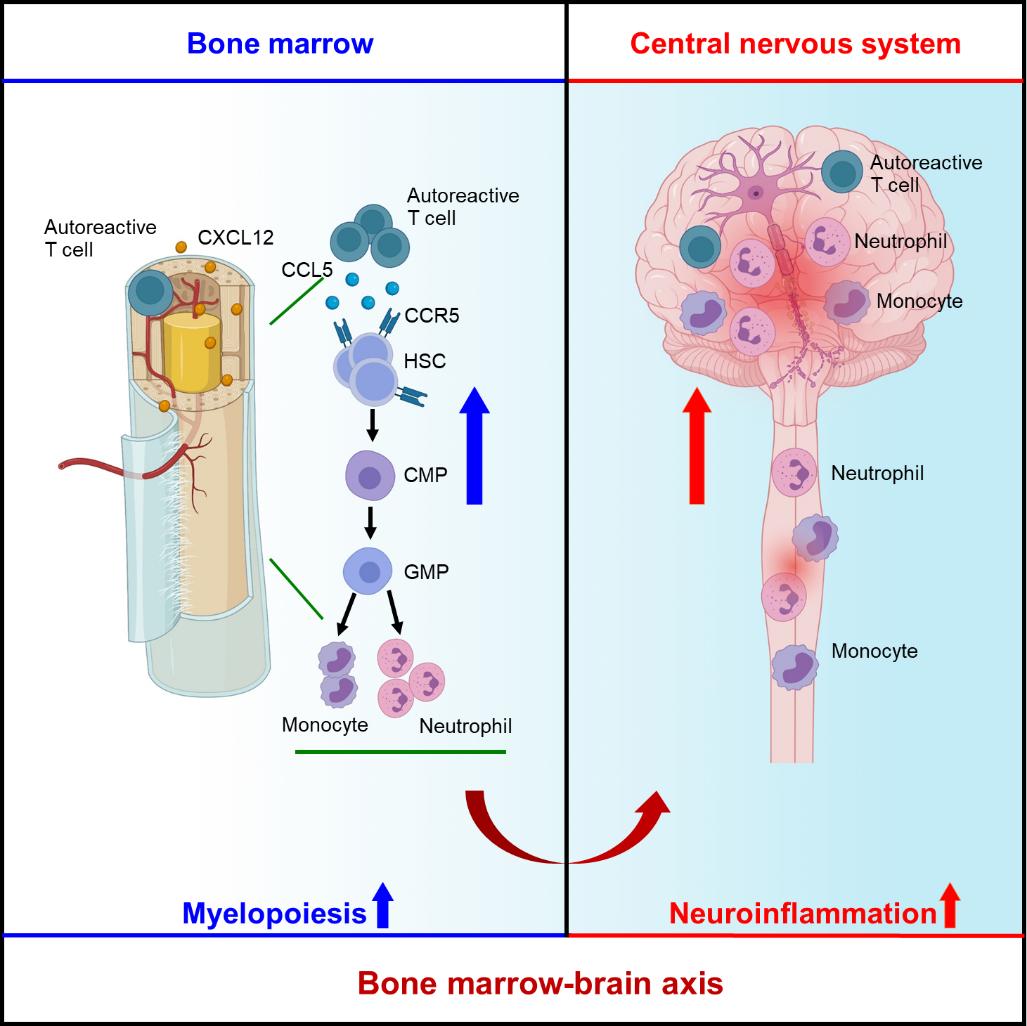
图1. 骨髓异常髓系增生驱动多发性硬化进展的模式图。
MS患者的自身免疫性T细胞在CXCL12等趋化因子的引导下归巢至骨髓。自身免疫性T细胞在骨髓内高表达CCL5,引起骨髓造血干细胞(HSCs)及其下游的髓系祖细胞(CMP,GMP)活化增殖,从而造成骨髓异常髓系增生,生成大量单核细胞和中性粒细胞。这些骨髓新生的髓系细胞,可驱动T细胞自身免疫反应,并迁移至中枢神经系统造成炎性损伤。
作者专访
Cell Press细胞出版社公众号特别邀请刘强教授代表研究团队接受了专访,请他为大家进一步详细解读。
CellPress:
多发性硬化症(MS)是一种中枢神经系统(CNS)的自身免疫性疾病。当前对于髓系细胞与MS中自身反应性T细胞的潜在相互作用尚不清楚,请问目前主要存在哪些难题?
刘强教授:
MS具有终身性、进行性和致残性的临床特点,对患者家庭造成沉重的经济和心理负担。当前没有治愈MS的疗法,控制疾病进展的药物疗效也仍有很多不足。这些未满足的临床需求,源自当前对MS这一疾病的免疫机制仍不完全清楚。特别是,对MS患者自身反应性T细胞的研究既往局限于血液和脑脊液,然而针对决定T细胞自身免疫发生启动和演变的部位、因素,以及这些因素对MS疾病进程的影响,当前仍认识不足。骨髓作为中枢免疫器官,主要产生髓系细胞和其他各种免疫细胞,也是机体免疫应答的核心场所,然而当前并不知道骨髓和骨髓内的髓系细胞在T细胞自身免疫活化中的作用,以及是否影响MS的进展。
CellPress:
请问自身反应性T细胞是如何迁移到骨髓的?
刘强教授:
骨髓内富含其特有的多种环境因子,由髓内包括基质细胞在内的多种细胞所产生,其中包括CXCL12等趋化因子。这些免疫因子作用于自身反应性T细胞所表达的趋化因子受体,从而吸引外周其他部位的自身反应性T细胞来到骨髓。
CellPress:
请问骨髓生成与髓系细胞的输出之间存在怎样的联系?
刘强教授:
为了明确骨髓新生的髓系细胞对髓系细胞输出和分布的影响,我们使用谱系示踪技术追踪了MS小鼠模型骨髓造血干细胞分化产生的髓系细胞的命运。结果显示,MS小鼠骨髓新生的髓系细胞可分布在骨髓、外周血、中枢神经系统等脏器。我们注意到MS小鼠中枢神经系统内的来自骨髓新生的髓系细胞数量明显增加,表明MS小鼠骨髓可输出髓系细胞到中枢神经系统。
CellPress:
请问髓系细胞的输出会对中枢神经系统的炎症损伤产生怎样的影响?
刘强教授:
骨髓输出的髓系细胞如单核/巨噬细胞等具有抗原递呈功能,可在骨髓等器官通过抗原递呈等作用加速自身反应性T细胞克隆扩增,加重T细胞自身免疫造成的神经损伤。此外,骨髓输出的髓系细胞也可入侵中枢神经系统,加重神经炎性损伤。
CellPress:
请问本研究旨在解决哪些科研难题?本研究的成果能够为治疗多发性硬化症和其他自身免疫性疾病提供怎样的帮助?
刘强教授:
MS这一未满足的临床需求,源自于当前对MS免疫机制认识的欠缺。既往对于MS机制的理解局限于淋巴结等外周免疫器官产生的自身免疫T细胞,而长期忽视了骨髓这一中枢免疫器官在MS发病中的潜在作用。我们课题组的这项研究,揭示了MS活动期患者骨髓造血功能的异常表现,及其对神经病变的驱动作用,开拓了“骨髓免疫与MS等神经免疫疾病”这一领域。我们的部分研究结果提示,靶向骨髓异常髓系增生具有延缓MS等神经免疫疾病进展的潜力。为今后对MS等神经免疫疾病的治疗提供了新的途径。
CellPress:
请问您下一步的研究重点将会放在哪里?
刘强教授:
我们课题组已开展“靶向骨髓免疫,减轻神经炎症”的临床研究。此外,我们也发现了MS等神经免疫疾病中造成骨髓异常造血的一些细胞和分子靶标。在此基础上,我们在研发新的细胞治疗或药物治疗手段。未来我们将持续推进后续临床和转化研究,希望今后的工作能为神经免疫疾病的临床治疗提供新的方法,最终能使患者获益。

作者介绍

刘强
教授
刘强,教授,博士生导师。于南京医科大学获得临床医学学士和硕士学位,美国Barrow神经病学研究所获得博士学位,相继完成免疫学博士后研究。回国后,到天津医科大学总医院神经内科从事临床和科研工作,担任天津市神经病学研究所神经退行性疾病研究室主任、中华医学会神经病学分会脑血管病学组委员。主要研究方向为脑疾病的免疫机制和临床干预。获得中国卒中学会“论文最佳引用奖”、“天津市自然科学一等奖”等奖励。近五年,以通讯作者在Cell、Nature Neuroscience、Immunity、Science Translational Medicine、Journal of Experimental Medicine等期刊发表SCI文章20篇。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Cell上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Bone marrow hematopoiesis drives multiple sclerosis progression
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(22)00651-1
▌DOI:
https://doi.org/10.1016/j.cell.2022.05.020
▲长按图片识别二维码阅读原文
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




