- +1
港大生物学家揭示巨噬细胞促进卵巢癌腹膜转移的新机制
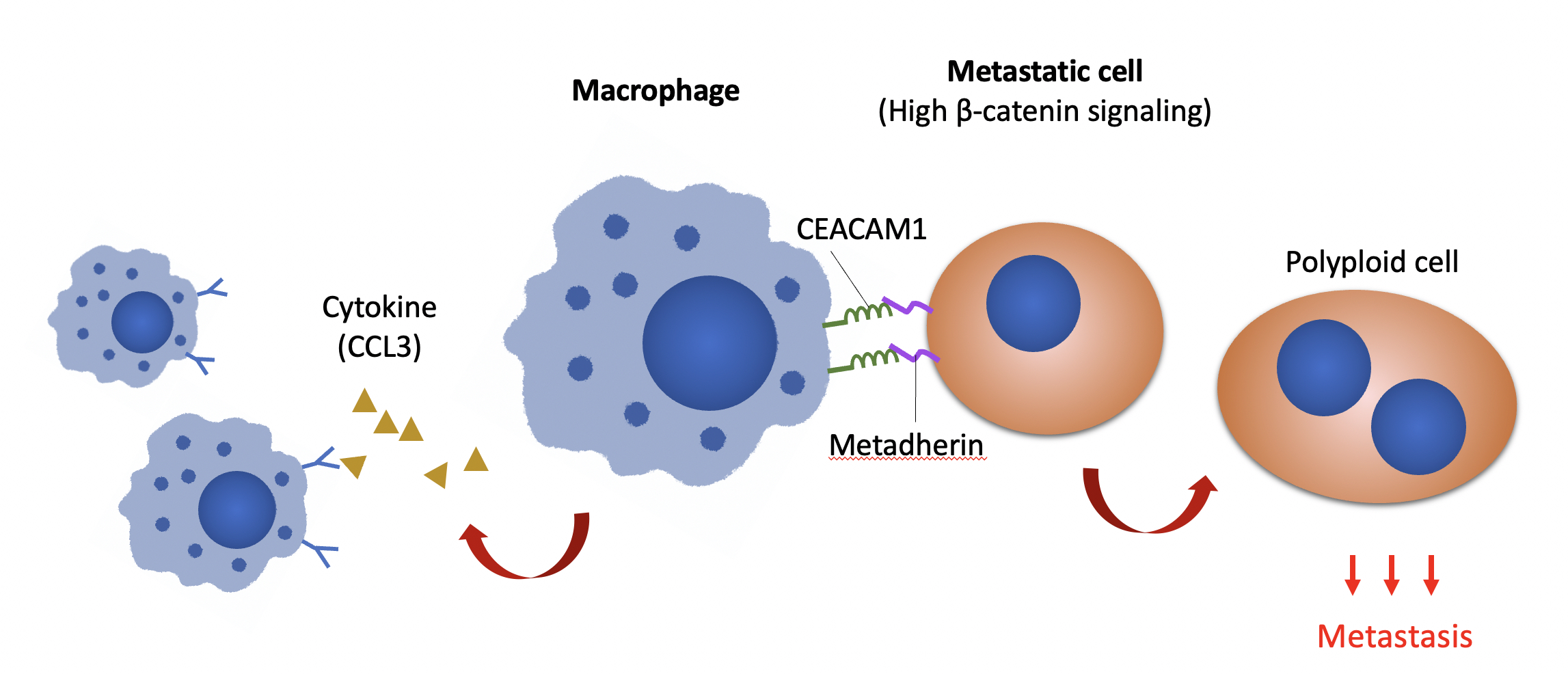
港大研究团队发现,通过抑制 metadherin 或 CEACAM1 来阻断巨噬细胞与癌细胞的通讯,能有效减少在免疫细胞中的腹膜转移。(图片修改自 Adv. Sci. (Weinh) 2022; e2103230)
(原新闻稿已于5月16日发布)
香港大学(港大)生物科学学院的研究小组发现,癌细胞能利用与肿瘤相关巨噬细胞之间一种新的相互作用来促进卵巢癌的腹膜转移。这些研究结果为卵巢癌的治疗策略提供了重要的见解,并已于国际著名科学期刊《先进科学》(Advanced Science)上发表。
研究背景
卵巢癌患者的死亡率位列众多妇科癌症中之首,原因是超过七成患者在罹病晚期才得到诊断,此时癌细胞多已在腹腔扩散,难以治疗。
基于肿瘤的异质性(tumour heterogeneity),个别癌细胞的形态和表型特征都各有不同,而癌细胞与肿瘤微环境(tumour microenvironment)之间存在多层的互动,都令治疗卵巢癌的腹膜转移变得非常困难。
在腹膜转移的过程中,研究细胞和分子机制是找出治疗方法的关键,但缺乏合适的实验模型为研究带来重重障碍。另外,传统的细胞实验普遍采用批量检测,因此科学界对于单个不同的癌细胞亚克隆(subclone)和肿瘤微环境之间独特的相互作用仍不甚了解。
研究方法和成果
主要发现:团队通过观察人源化小鼠模型发现,Wnt/β-catenin信号通路提升转移卵巢细胞表面的metadherin蛋白,进而通过巨噬细胞表达的CEACAM1传递信号。因此,通过抑制metadherin或CEACAM1来阻断巨噬细胞与癌细胞的通讯,能有效减少在免疫细胞中的腹膜转移。
研究团队早前基于癌细胞的异质性,建立了一个可以模拟卵巢癌自发转移的等基因实验模型。研究人员利用该模型加上基因测序及生物信息学分析后,发现Wnt/β-catenin信号通路在具有高转移能力的卵巢癌细胞中有所上调。Wnt/β-catenin信号通路在胚胎发育和保持组织的恒定状态,以至癌症中皆扮演重要角色;信号的上调会增加其他致癌基因的表达而造成癌细胞的扩散。
巨噬细胞具有协调先天免疫和适应性免疫反应的关键作用,亦是卵巢癌肿瘤微环境中数量最多的免疫细胞。团队运用「活细胞实时成像」分析单个细胞的活动行为时,发现转移细胞在与巨噬细胞共同培养的情况下,有一部分转移细胞会较容易转型成为「多倍体」,即一种可以促进肿瘤侵略性和治疗抗性的表型。另一方面,实验显示转移细胞可将巨噬细胞极化为与肿瘤相关的表型,相应有助转移细胞形成多倍体。后续的分子分析显示β-catenin信号通路可上调癌细胞表面的metadherin蛋白,进而通过巨噬细胞表达的CEACAM1传递信号。团队将人类卵巢癌细胞移植到免疫系统人源化小鼠(immune humanized mice)上,证明通过抑制metadherin或CEACAM1来阻断巨噬细胞与癌细胞的通讯,能有效减少腹膜转移。由于metadherin和CEACAM1这两种蛋白是位于细胞的表面,因而非常适合用作追踪癌细胞和临床靶向。
研究意义
多倍体和基因组不稳定性是癌病的标记。此项研究的重点在于发现了转移细胞与巨噬细胞的直接相互作用是导致多倍体和基因组不稳定性的潜在驱动机制,即造成癌细胞扩散的原因之一。而当中揭示的分子信息通路有助研发抑制转移细胞多倍体形成的治疗策略,以控制卵巢癌的腹膜扩散。
领导此研究的港大生物科学学院院长(暂任)黄思齐教授认为这项研究极具启发性:「到目前为止,我们对调节癌症多倍体的机制所知甚少,而我们的研究提供了一种分子机制原理,说明以β-catenin或其下游信号分子为靶点,或许能阻止与预后(Prognosis)不良相关的腹膜扩散。」研究团队计划更深入地探索在转移细胞中驱动多倍体形成的信号传导机制,这将大大增进我们对卵巢癌基因组不稳定的理解。
研究团队
此项研究由黄思齐教授(港大生物科学学院)和史珏副教授(香港浸会大学(浸大)物理系)共同领导。杜洁欣博士(港大生物科学学院博士后研究员)为此研究的第一作者,并由邓纪旋博士(InnoHK创新香港研发平台「合成化学暨化学生物学实验室」博士后研究员、港大生物科学学院荣誉副研究员)和童寅博士(港大病理系博士后研究员)协助。其他参与研究的合作者包括张江文副教授(港大生物科学学院)、陈嘉伦医生(港大妇产科学系临床副教授)及叶品正医生(港大病理系临床副教授)。
鸣谢
此项研究获得香港研究资助局基金(17104820、17141216、C4041-17G及C2006-17E)及香港特别行政区创新科技署Health@InnoHK「合成化学暨化学生物学实验室」资助。黄思齐教授为裘槎基金会高级研究基金获奖者。
期刊论文链结: https://doi.org/10.1002/advs.202103230
图片下载和说明:https://www.scifac.hku.hk/press
了解更多关于黄思齐教授的工作和研究团队: https://www.awonglab.com/
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




