- +1
周春课题组《PNAS》发文揭示SIN1蛋白调控Ras通路的分子机制
摘要
近日,浙江大学医学院公共卫生学院周春课题组在《PNAS》上在线发表了题为Structural insights into Ras regulation by SIN1的研究论文,初步揭示了SIN1蛋白调控Ras通路的分子机制。
Ras家族小G蛋白在细胞内起着信号转导分子开关的作用,它们能将细胞外生长因子的信号传递到下游如MAPK通路,控制多种细胞功能,特别是细胞增殖和分化。Ras基因突变和多种类型的癌症发生密切相关。
mTORC2复合物是另一个调控细胞生长的重要中枢,SIN1是mTORC2复合物的组成部分,具有CRIM、RBD和PH结构域。SIN1可以通过RBD结构域与Ras相互作用, 然而SIN1/mTORC2-Ras相互作用的分子机制及具体的功能仍不清楚。
在该研究中,研究人员首先利用X射线晶体衍射的技术解析了HRas/KRas-SIN1 RBD复合物的高分辨率结构,揭示了该复合物的相互作用界面(图1)。突变相互作用界面的关键氨基酸残基可以消除Ras-SIN1的互作;而缺乏PH结构域的SIN1亚型与Ras的结合强于全长SIN1亚型, 显示SIN1 PH结构域对Ras-SIN1的结合具有抑制作用。在SIN1敲除的细胞中,研究人员证明Ras-SIN1的互作可以促进mTORC2的底物SGK1的活性但抑制胰岛素诱导的ERK活化。通过结构比较、竞争性的荧光共振能量转移(FRET)以及生化分析,研究人员发现胰岛素或者EGF刺激产生不同的效应可能是由于在胰岛素刺激下SIN1-Ras的互作竞争性抑制了Ras对PI3K的促进作用(图2)。此外, 通过晶体界面分析研究人员发现了一个新的Ras二聚化界面,该界面可能与Ras寡聚化相关。上述研究结果加深了我们对突变的Ras或mTORC2蛋白致病机制的理解,为进一步的机制研究和药物设计提供了支撑。
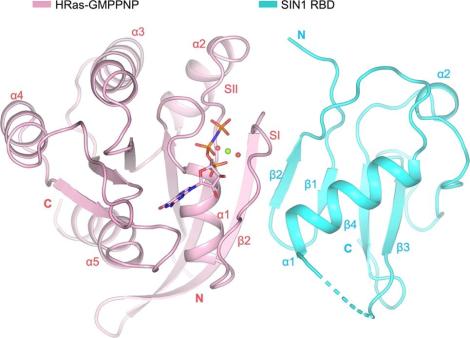
图1 HRas-GMPPNP与SIN1 RBD的结合方式
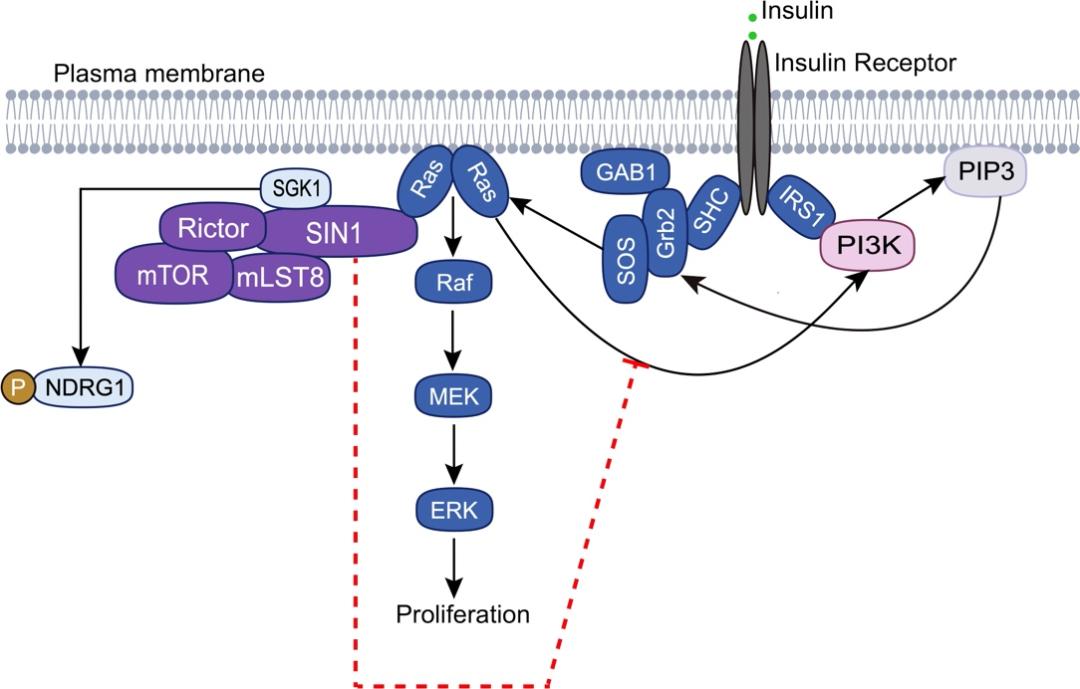
图2 SIN1-Ras互作促进SGK1活化但抑制胰岛素介导的ERK激活
浙江大学医学院博士生郑郁媛、丁蕾为论文的共同第一作者;浙江大学医学院公共卫生学院周春研究员,澳大利亚新南威尔士大学杨光研究员为共同通讯作者,悉尼大学David E. James教授课题组,浙江大学医学院孙洁课题组对研究提供了帮助。晶体数据收集得到上海同步辐射光源的大力支持。此研究得到了国家自然科学基金, 澳大利亚国家健康和医学研究委员会项目以及浙江大学-悉尼大学国际合作种子基金的资助。
原文链接:DOI: 10.1073/pnas.2119990119
医视野宣传中心
来源 | 周春课题组
原标题:《周春课题组《PNAS》发文揭示SIN1蛋白调控Ras通路的分子机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




