- +1
脂代谢的生物节律系列(一)
以下文章来源于脂在线 ,作者脂在线
脂在线.
聚焦脂代谢与动脉粥样硬化,追踪前沿科学动态,传递最新指南共识,陪您一“脂”学习。
脂代谢的生物节律
生物节律,又称昼夜节律,正日益引起公众的广泛关注。据统计,中国有超过3亿人存在睡眠障碍,近40%成年人存在失眠。睡眠障碍是生物节律紊乱的常见原因之一。伴随工作节奏和学业负担的影响,光照与进食的节律发生紊乱的可能性大大增加,引起生理与代谢系统的紊乱。研究表明,生物钟紊乱导致糖脂代谢紊乱,增加肥胖、糖尿病与冠心病、卒中等发病风险。未来几期的专栏就来与大家聊一聊脂代谢的生物节律及其紊乱造成的健康影响,本期我们简单介绍生物钟理论,以脂肪组织与肥胖的关系为例看看脂代谢的生物节律紊乱带来的麻烦。主要内容也在学术期刊发表,参见拙著1。
引用自OxfordSparks
一
生物钟的基本构造
昼夜节律是一个大约 24 小时的细胞自主周期,由特定基因的转录-翻译反馈回路驱动 (图1),这些基因被称为“生物钟基因”2。在哺乳动物中,位于下丘脑视交叉上核的主生物钟控制着外周生物钟(图2)3。昼夜节律存在于几乎所有的生物过程。通常认为各个外周生物钟是简单并列的扁平结构,通过特异性的输出通路调节行为、生理和代谢,产生昼夜节律。然而最近我们的研究以及稍后以色列威斯曼研究所的盖德-阿萨尔的研究结果支持一个新的猜想 4, 5。这就是主生物钟调节外周生物钟,而各个外周生物钟是阶梯网格式的复杂结构,存在不同的响应生物钟的主要调节信号,即光照和进食,的能力,存在互通时间的通讯机制(图3)。这个“外周生物钟层级结构”猜想发表在2021年国际著名学术期刊Trends in Cell Biology 3。这样看来,生物钟与环境节律共同调节器官的脂代谢过程,产生器官特异性的昼夜节律 2。
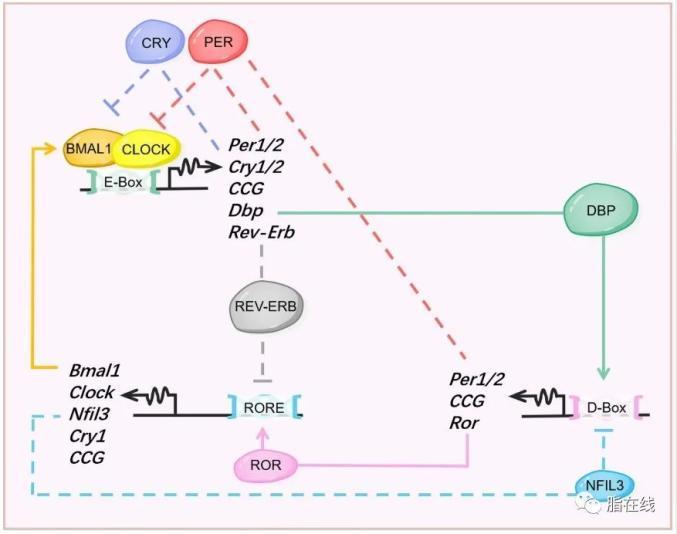
图1 细胞生物钟的分子机制
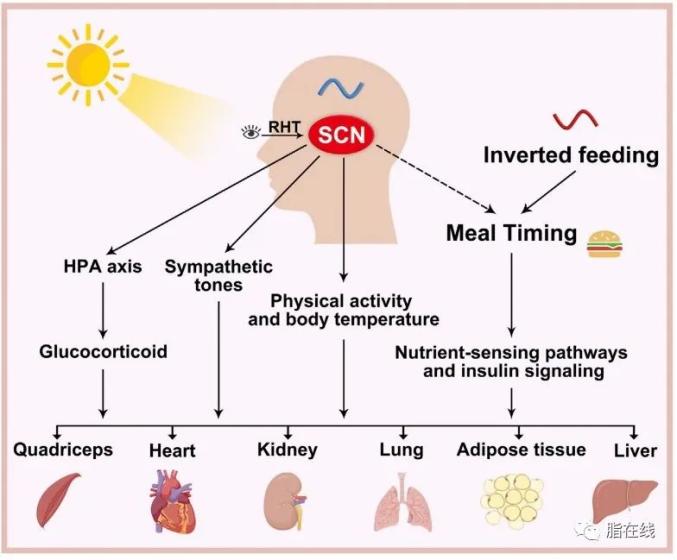
图2 哺乳动物昼夜节律系统的经典结构。位于下丘脑的主生物钟调节外周生物钟,但各个外周生物钟是简单并列的扁平结构。
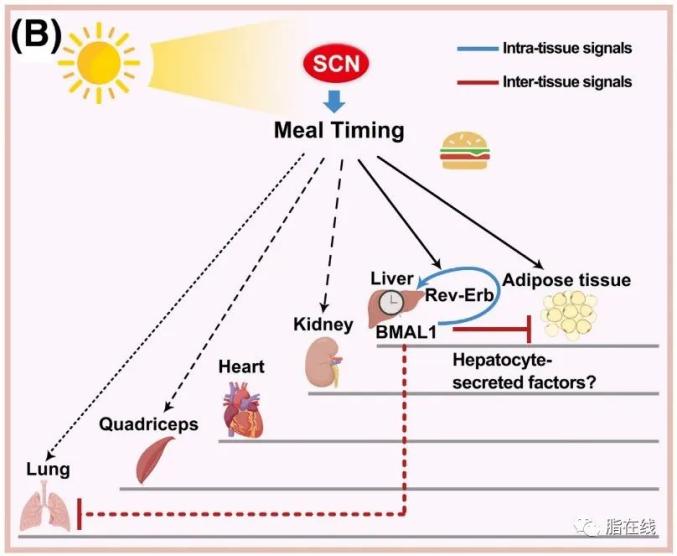
图3 哺乳动物昼夜节律系统的猜想结构。位于下丘脑的主生物钟调节外周生物钟。各个外周生物钟是阶梯网格式的复杂结构,存在不同的响应生物钟的主要调节信号,即光照和进食,的能力,存在互通时间的通讯机制。
二
白色脂肪组织
白色脂肪组织是储存脂质的专门组织,是参与能量代谢稳态和炎症的内分泌器官。转录组学和代谢组学研究表明,脂肪组织中的脂质代谢表现出昼夜节律。脂肪分解主要由肾上腺素能信号通路和胰岛素控制,并由生物钟微调。脂解和旁分泌信号由昼夜节律基因调节。脂肪分泌的内分泌因子,如瘦素和脂联素,表现出受光和食物调节的昼夜节律。
生物钟的遗传破坏和环境破坏都使啮齿动物容易出现饮食诱导的肥胖。生物钟基因的突变引起小鼠的自发肥胖或高脂饲料诱发的肥胖。CLOCK是第一个被克隆的哺乳动物的生物钟基因(图1),它有一个非常奇怪的全名,仅仅为了让首字母看起来是CLOCK。做好准备,CLOCK的全称是Circadian Locomoter Output Cycles Kaput。在某些实验室,研究生必须顺利说出全称才能毕业。一天,一个研究生骄傲的向她的导师宣称,她一看见小鼠就知道哪个是突变体,因为她在饲养Clock突变小鼠时发现几乎所有的突变体小鼠很胖!这下就有一篇Science重磅论文6,当然这事儿发生在近20年前。
另一个重要的生物钟基因是CLOCK的好伙伴BMAL1。脂肪细胞如果没有BMAL1,小鼠会在高脂诱导下变得肥胖,带来脂肪肝和糖尿病等各种代谢性疾病。有趣的是,BMAL1缺乏不会改变任何 Period 基因的表达,这可能可以用另一个感知营养信号的转录因子CREB的代偿贡献来解释。BMAL1调节许多脂代谢基因的表达,比如SCD1、ELOVL6与CES1D等。这些脂代谢基因的表达改变引起脂肪组织超长脸脂肪酸合成与分泌的下降,从而让能量代谢变得更弱,有利于脂肪的储存与积累。但这可能不是唯一的机制。例如,抑制BMAL1-CLOCK功能的生物钟基因PER2同时控制核受体PPARγ的脂肪生成活性。通常认为,生物钟调节脂肪组织的脂代谢与内分泌功能,从而调节全身能量代谢稳态。
三
产热脂肪组织
产热脂肪组织代谢脂肪酸以产生热量响应寒冷,清除循环中的甘油三酯,并通过分泌因子调节全身代谢。产热脂肪组织包括棕色脂肪组织和可诱导的米色脂肪组织。这些产热组织主要依靠线粒体中解偶联蛋白 1 (UCP1) 的表达和调节来产生热量。此外,还有大量的备用机制与 UCP1 联合进行产热,例如让每个健美人士疯狂的“肌酸循环”。适应性产热表现出夜间节律(夜间高峰)。
小鼠在耐寒性方面表现出昼夜差异,在夜间/活动阶段达到峰值,在白天/禁食阶段达到低谷7。这种耐寒的昼夜模式与生物钟基因Rev-ErbA表达是反相的。Rev-ErbA通过抑制棕色脂肪组织中 UCP1 的表达来调节这种适应性产热的昼夜节律。然而,经典的 Rev-ErbA 辅助阻遏物 HDAC3 从 PGC-1α 中去除乙酰基并增加雌激素相关受体 (ERR)α 的转录活性。 HDAC3 对棕色脂肪组织中 UCP1和氧化代谢基因的表达至关重要。冷诱导的肾上腺素能信号激活对于激活棕色脂肪组织功能至关重要。然而,肾上腺素能信号不参与Rev-ErbA和HDAC3 的冷应激相关变化。相反,Rev-ErbA 和 HDAC3以细胞自主方式发挥作用。最近获得诺贝尔奖的TRP通道可能也参与其中。冷感知瞬时受体电位 (TRP) 通道 TRPV1 和 TRPM8 调节棕色脂肪组织中的生物钟。脂肪细胞可以感知冷并激活产热以不依赖肾上腺素信号的方式表达基因。表达 TRP 的神经脂肪回路或单独的脂肪细胞可能是与肾上腺素能信号传导平行的新的产热调节轴。
脂肪酸摄取和氧化的昼夜节律是产热脂肪组织的一个关键特征。有人提出,棕色脂肪组织是从循环中吸收脂质的主要组织。无论光照时间长短,产热脂肪组织的脂肪酸摄取在活动/夜间阶段开始时达到峰值,这与循环中脂质的清除率增加有关。禁食会改变脂肪酸摄取的昼夜节律,然而,肾上腺素能信号似乎是可有可无的。啮齿动物和人类都存在血脂水平的每日变化。该机制尚未完全确定,但很容易推测依赖 Rev-ErbA和 HDAC3而非肾上腺素能信号传导的细胞自主生物钟对于产热脂肪组织中脂肪酸摄取和氧化的昼夜节律至关重要。
四
肥胖及如何干预生物节律防治肥胖
生物节律紊乱在肥胖中很常见,轮班工作会增加人群肥胖的风险。肥胖受试者表现出在夜间吃大量食物的倾向。前面也提到生物钟基因突变的小鼠容易肥胖。在实验室小鼠中,通过持续的光照或慢性时差来破坏昼夜节律,导致瘦素抵抗和肥胖。生物钟基因突变会破坏昼夜节律的饮食行为,并在休息时诱发食欲过盛。确实, 在休息时间进食会导致饮食诱导的肥胖小鼠的整体摄食过多,并扰乱时钟之间的同步。这些研究结果驱动生物钟学者思考,是否通过恢复环境节律可以重塑肥胖躯体已经紊乱的节律。
前面提到过,用餐时间(进食节律)是调节外周生物钟的重要时间信号。俗话说“马无夜草不肥”,养生家会说“过午不食”。于是把进食节律限制在机体活跃的时间段似乎是减重的好办法,至少在小鼠上真有效。研究结果发表在著名学术期刊,引起一股“限时进食”热 8, 9。但也有很多临床结果表明,限时进食其实是主要是因为限制了总热量的摄入。最近的一项重量级研究来自中国学者,发表在著名医学期刊《新英格兰医学杂志》10。然而小鼠的研究却又提供了新的说法,限时进食可以增强热量限制延长健康寿命的效果11。和稀泥的说法是限时进食与热量限制都重要,结合起来更好12。仔细看《新英格兰医学杂志》的论文,还真不得不认为这稀泥和得有道理,也许增加受试者数目,统计学不显著就能变显著,而且差异不小。但另一方面,限时进食在小鼠与人类存在不同减重效果的根源在于不可比性,毕竟小鼠饿一天就相当于人饿一周(小鼠的单位体重能量代谢率超过人类的7倍)2。
其实往后几期我们会看到,限时进食的益处不应该只盯着BMI和体重计,过多的脂肪在脂肪组织是肥胖,存储在内脏就成了脂肪肝、动脉粥样硬化、糖尿病并发症。
专家简介
李旻典
中国人民解放军陆军军医大学第一附属医院心血管内科研究员、教授、博士生导师、“代谢生物钟与心血管病中心”学术负责人。研究方向为生物钟的表观与代谢调控机制。在Cell Metabolism等期刊发表论文24篇,在Trends in Cell Biology(2021)、Trends in Molecular Medicine(2022)撰文提出“外周生物钟系统的层级网络”猜想及限时进食的分子机制——“时钟调制检查点(clock-modulated checkpoint, CCP)”新概念。
参考文献:
1. Z. Zhang, H. Xin, M.-D. Li, Circadian Rhythm of Lipid Metabolism in Health and Disease. Small Methods. 4, 1900601 (2020).
2. M.-D. Li, Clock-modulated checkpoints in time-restricted eating. Trends Mol. Med. 28, 25–35 (2022).
3. Z. Zhang, G. Shui, M.-D. Li, Time to eat reveals the hierarchy of peripheral clocks. Trends Cell Biol. 31, 869–872 (2021).
4. H. Xin, F. Deng, M. Zhou, R. Huang, X. Ma, H. Tian, Y. Tan, X. Chen, D. Deng, G. Shui, Z. Zhang, M.-D. Li, A multi-tissue multi-omics analysis reveals distinct kinetics in entrainment of diurnal transcriptomes by inverted feeding. iScience. 24, 102335 (2021).
5. G. Manella, E. Sabath, R. Aviram, V. Dandavate, S. Ezagouri, M. Golik, Y. Adamovich, G. Asher, The liver-clock coordinates rhythmicity of peripheral tissues in response to feeding. Nat. Metab. 3, 829–842 (2021).
6. F. W. Turek, C. Joshu, A. Kohsaka, E. Lin, G. Ivanova, E. McDearmon, A. Laposky, S. Losee-Olson, A. Easton, D. R. Jensen, R. H. Eckel, J. S. Takahashi, J. Bass, Obesity and Metabolic Syndrome in Circadian Clock Mutant Mice. Science (80-. ). 308, 1043–1045 (2005).
7. Z. Gerhart-Hines, D. Feng, M. J. Emmett, L. J. Everett, E. Loro, E. R. Briggs, A. Bugge, C. Hou, C. Ferrara, P. Seale, D. A. Pryma, T. S. Khurana, M. A. Lazar, The nuclear receptor Rev-erbα controls circadian thermogenic plasticity. Nature. 503, 410–413 (2013).
8. M. Hatori, C. Vollmers, A. Zarrinpar, L. DiTacchio, E. A. Bushong, S. Gill, M. Leblanc, A. Chaix, M. Joens, J. A. J. Fitzpatrick, M. H. Ellisman, S. Panda, Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab. 15, 848–860 (2012).
9. A. Chaix, S. Deota, R. Bhardwaj, T. Lin, S. Panda, Sex- and age-dependent outcomes of 9-hour time-restricted feeding of a Western high-fat high-sucrose diet in C57BL/6J mice. Cell Rep. 36, 109543 (2021).
10. D. Liu, Y. Huang, C. Huang, S. Yang, X. Wei, P. Zhang, D. Guo, J. Lin, B. Xu, C. Li, H. He, J. He, S. Liu, L. Shi, Y. Xue, H. Zhang, Calorie Restriction with or without Time-Restricted Eating in Weight Loss. N. Engl. J. Med. 386, 1495–1504 (2022).
11. V. Acosta-Rodríguez, F. Rijo-Ferreira, M. Izumo, P. Xu, M. Wight-Carter, C. B. Green, J. S. Takahashi, Circadian alignment of early onset caloric restriction promotes longevity in male C57BL/6J mice. Science (80-. ). 0297, 2003–2005 (2022).
12. B. Laferrère, S. Panda, Calorie and Time Restriction in Weight Loss. N. Engl. J. Med. 386, 1572–1573 (2022).
“脂在线”平台由著名脑血管病专家王拥军教授发起,国家神经系统疾病临床研究中心-脂代谢与动脉粥样硬化中心承办,旨在建立以脂代谢与动脉粥样硬化性疾病为核心的临床科研学术交流平台。平台将聚焦脂代谢最新热点,分享国内外前沿资讯,解读血脂异常管理指南,通过整合多媒体视听资源,致力于更加便捷的知识共享。
文稿:李旻典,郭黎
排版配音:程爱春,冯致远
原标题:《脂代谢的生物节律系列(一)》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




