- +1
癌细胞也会断臂求生,主动激活自身DNA断裂,逃脱治疗引起的杀伤作用
原创 生物世界 生物世界 收录于合集 #癌症研究 237个

撰文 | 王聪
编辑 | 王多鱼
排版 | 水成文
基因毒性癌症疗法(Genotoxic Cancer Therapy)通过造成广泛的 DNA 损伤来杀伤癌细胞。其中,放疗(Radiation Therapy,RT)是应用最广泛的基因毒性癌症疗法,当辐射穿过细胞时,其携带的能量会触发广泛的 DNA 损伤,包括 DNA 的双链断裂(DSB)、单链断裂(SSB)、链间交联(Interstrand Crosslinks),从而引发细胞的死亡或细胞周期停滞。
然而,在临床治疗中,放疗后仍有一些癌细胞会存活下来,从而导致治疗后的癌症复发。癌细胞对放疗的抵抗是有效控制癌症发展的一个巨大障碍,我们对于癌细胞通过哪些机制来减轻放疗的杀伤作用,仍不完全清楚。
近日,丹麦根本哈根大学 Claus Sørensen 等人在 Science 发表了题为:Cancer cells use self-inflicted DNA breaks to evade growth limits imposed by genotoxic stress 的研究论文。
该研究发现,癌细胞能够激活半胱天冬酶激活的DNA酶(CAD)的表达,并在基因组中特定位点诱导 DNA 断裂,触发癌细胞在细胞分裂间期的 G2 期停滞,从而保护癌细胞免于因治疗引起的 DNA 损伤而死亡。
该研究进一步发现,抑制 CAD 酶,能够增加癌细胞对放疗的敏感性,而不影响正常细胞,为将来提高放疗等癌症疗法的效果提供了新的靶点。

正常细胞会通过激活细胞分裂周期中 G1 期检查点基因来保护自己免受基因毒性伤害,但这些检查点基因通常在癌细胞中失活,因此,癌细胞是通过其他方式来逃逸基因毒性伤害。
在这项研究中,研究团队发现,癌细胞在辐射期间会出现一些神秘缺口(DNA单链断裂),这些神秘缺口在辐射后大约12到18小时出现。接下来,他们发现,半胱天冬酶激活的DNA酶(Caspase-activated Dnase,CAD)会在辐射导致的外源性 DNA 损伤后促进一波内源性 DNA 断裂,也就是这些神秘缺口。
半胱天冬酶激活的DNA酶(CAD),也被称为 DNA 裂解因子40,是在细胞凋亡过程中引起 DNA 发生片段化的一种双链特异性核酸内切酶。
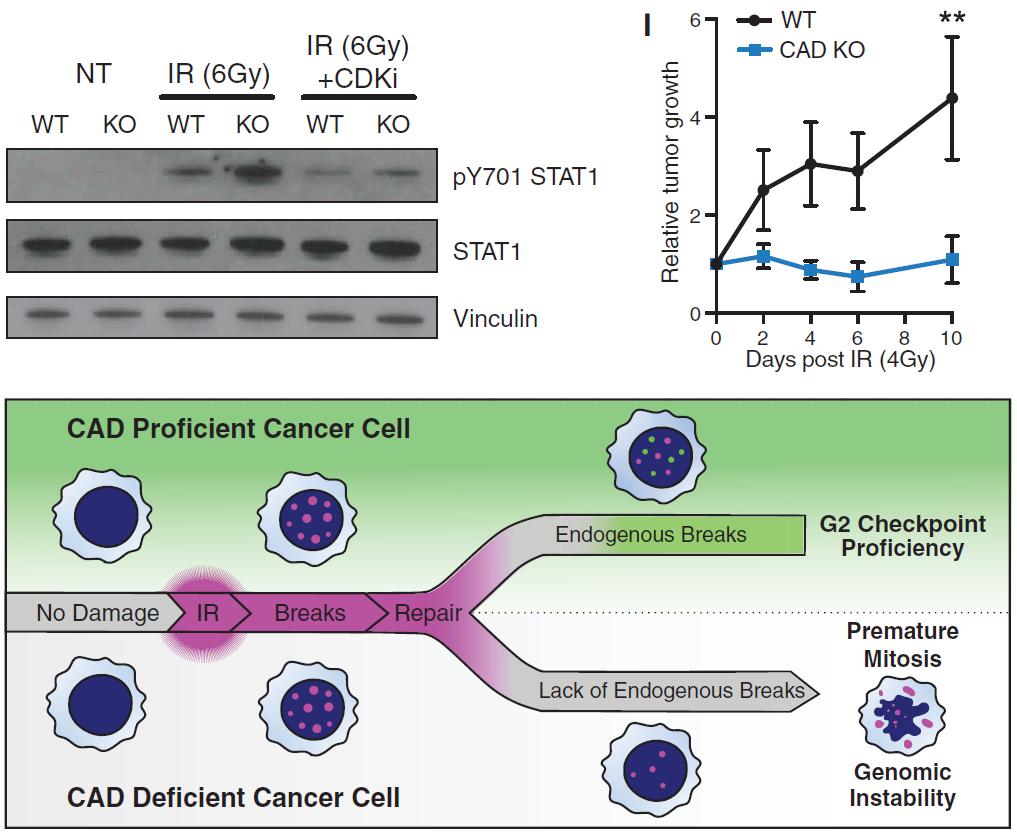
为了验证这一点,研究团队在癌细胞中敲除了 CAD 基因,结果这些敲除 CAD 基因后的癌细胞对辐射更加敏感,也比之前更早进入细胞分裂期。接下来,研究团队将人类肿瘤细胞移植到小鼠体内,发现增加 CAD 水平后,这些肿瘤细胞能够更好地抵抗放疗。
在放疗压力下,癌细胞激活 CAD 表达,导致在基因组特定位点有限的 DNA 断裂,这些自我诱导的内源性 DNA 断裂触发癌细胞在细胞分裂间期 G2 期停滞,防止癌细胞进一步分裂,并在此期间修复放疗导致的 DNA 损伤,从而避免癌细胞的死亡。
该研究的通讯作者 Claus Sørensen 教授表示,在遭遇放疗导致的 DNA 损伤压力下,癌细胞会激活内源核酸酶 CAD 并引发全基因组中 DNA 断裂。虽然持续的 DNA 断裂对细胞来说通常是个坏消息,但在放疗情况下,这种方式导致的内源性 DNA 断裂会导致癌细胞停止其旺盛的细胞分裂,在有丝分裂间期的 G2 期暂停,从而获得足够的时间来修复放疗带来的 DNA 损伤。
该研究的共同作者、卡罗林斯卡医学院 Jiri Bartek 教授进一步解释了这种令人惊讶甚至违反直觉的癌细胞自救机制,癌细胞是如何通过给自身带来更大伤害的方式来增加放疗下的存活机会?正在细胞在遭遇放疗等基因毒性作用时通常会在 G1 期暂停细胞分裂,但这种机制在癌细胞中是失活的。因此,癌细胞选择了在 G2 期暂停细胞分裂,防止在放疗时继续分裂可能导致的致命染色体断裂。而且 CAD 带来的 DNA 断裂通知了癌细胞立刻开始修复放疗导致的危险 DNA 损伤,同时也修复了虽然大量但易于修复的 CAD 带来的 DNA 单链断裂。
此外,研究团队还绘制了 CAD 带来的 DNA 单链断裂的位点,结果发现,这些位点并非随机分布于基因组中,而是集中在基因组中的少数区域,这也揭示了这种内源性 DNA 断裂并未导致给癌细胞带来明显伤害。此外,该研究还证实了这种现象是癌细胞所特有的,因为敲除 CAD 基因会使癌细胞在放疗时更易被杀伤,而正常细胞并不受影响。
论文作者 Jan Benada 通过一幅漫画形象地描绘了亦正亦邪的 CAD,CAD 本是消除身体不需要的细胞的守护者,但在癌细胞中却变成了保护它们逃脱放疗杀伤的帮凶。

总的来说,该研究发现并证实了癌细胞在面对放疗压力时启动的一种独特的生存机制,即通过半胱天冬酶激活的DNA酶(CAD)来主动造成自身 DNA 断裂,从而导致癌细胞在细胞分裂间期 G2 期停滞,为修复放疗导致的 DNA 损伤增加时间。
该研究还进一步发现,抑制 CAD 功能,能够让癌细胞对放疗更加敏感,而不影响正常细胞,这为将来改善放疗治疗效果提供了新的靶点。
论文链接:
https://www.science.org/doi/10.1126/science.abi6378
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




