- +1
重新设计Cas9蛋白,解决脱靶问题,让基因编辑更安全
原创 生物世界 生物世界 收录于话题#新型基因编辑工具 11 个 #CRISPR&基因编辑 111 个
撰文 | 王聪
编辑 | 王多鱼
排版 | 水成文
CRISPR-Cas9基因编辑技术,通过向导RNA(gRNA)将Cas9酶靶向目标DNA序列,Cas9酶切割目标DNA双链,造成DNA双链断裂,DNA在非同源末端连接(NHEJ)修复时出错,从而实现基因敲除。
然而,CRISPR-Cas9存在较为严重的脱靶效应,可能会在错位的基因位点切割DNA双链,从而导致潜在风险,这也是限制CRISPR-Cas9基因编辑临床应用的一大因素。目前,国内外已开始进行多项基于CRISPR-Cas9基因编辑的临床试验,降低其脱靶效应是一个亟待解决的问题。
2022年3月2日,美国德州大学奥斯汀分校的研究团队在 Nature 期刊发表了题为:
Structural basis for mismatch surveillance by CRISPR–Cas9 的研究论文。
研究团队首先发现了CRISPR-Cas9基因编辑系统中脱靶背后的结构机制,在此基础上重新设计了Cas9蛋白——SuperFi-Cas9,其脱靶概率降低了数千倍,且编辑效率与原始版本的Cas9蛋白相同。

CRISPR-Cas9基因编辑,通过向导RNA(gRNA)将Cas9酶靶向目标DNA序列,Cas9酶切割目标DNA双链,造成DNA双链断裂,从而实现基因编辑,其中,向导RNA(gRNA)长度为20bp,通过与目标DNA的碱基互补配对来识别需要编辑的位点,然而,有时候在第18-20个碱基不匹配时,Cas9酶仍能进行编辑,从而导致脱靶效应。
研究团队使冷冻电镜来观察Cas9与错配的DNA序列相互作用时候的结构变化,从而解析错配时Cas9的激活机制。
研究团队惊讶地发现,当向导RNA(gRNA)在第18-20个碱基错配时,这时的配对结构较为松散,但Cas9酶并没有放弃前进,而是通过一个手指状结构紧紧抓住了错配区,从而稳定了RNA-DNA双链,使其表现的像是正确配对,为Cas9对DNA的切割铺平道路。论文的第一作者 Jack Bravo 表示,这种情况就像一把椅子,其中一条腿断了,用胶带粘上,这时候它仍然可以作为椅子使用,但是有些摇摆不定。
俗话说,眼见为实,该论文的通讯作者 David Taylor 表示:如果不是通过冷冻电镜看到了Cas9在向导RNA(gRNA)错配时出现的这种手指状结构,自己在脑海里永远也想不到Cas9是通过这种机制增加了错配时的结构稳定性,从而出现脱靶效应。
基于这一开创性发现和见解,研究团队重新设计了Cas9酶,这一新版本的Cas9酶——SuperFi-Cas9,它的手指状结构部分被改造成远离DNA,从而在错配时,不会用来稳定错配结构,因此Cas9酶就不再在错配位点切割和编辑DNA序列。
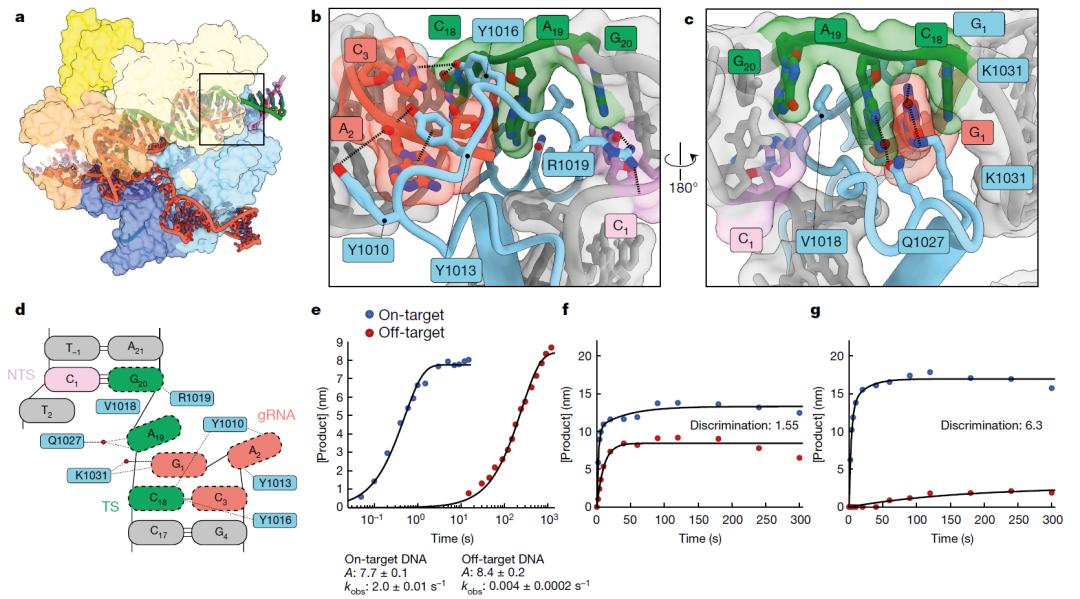
更重要的是,重新设计的SuperFi-Cas9,可以像天然Cas9酶一样高效编辑DNA,但脱靶概率下降了约4000倍,因此安全性得到了大幅提升。
目前,已经有其他实验室通过重新设计Cas9来降低其脱靶效应,但所有这些Cas9版本都通过牺牲基因编辑效率来提高准确性。
对于这种现状,这篇 Nature 论文的第一作者 Jack Bravo 做了一个形象的比喻:不同实验室开发的不同Cas9版本就像不同型号的自动驾驶汽车,大多数都很安全,但它们的最高速度只有10英里/小时,虽然安全性提高了,但实用性也消失了。而SuperFi-Cas9则是一辆可以全速行驶且非常安全的自动驾驶汽车,SuperFi-Cas9的脱靶概率比原始版本Cas9要降低4000倍,而且编辑效率一样高。
目前,研究团队已经证明了SuperFi-Cas9在试管中对DNA的编辑,在活细胞中测试的实验正在进行中,他们还在同步开发更安全、更高效的Cas9新版本。
据悉,研究团队已经对这项技术申请了专利,德州大学奥斯汀分校技术商业化办公司也正在寻找帮助这一技术实现转化应用的合作伙伴。
CRISPR-Cas9基因编辑技术,除了可能的脱靶效应外,Cas9酶自身的大尺寸也是限制其更广泛应用的一大难题。近年来,许多实验室致力于开发尺寸更小的Cas9酶,从而实现更好递送。
例如,斯坦福大学亓磊团队于2021年9月在 Molecular Cell 期刊发表论文【2】,重新设计一款全新的迷你CRISPR系统——CasMINI,它就像“瑞士军刀”一般,小巧玲珑却又功能众多,更容易传递到哺乳动物细胞中,因此可以更好地应用于CRISPR基因编辑的临床治疗。
详情:

而CRISPR先驱、诺奖得主 Jennifer Doudna 教授共同创立的基因编辑公司 Mammoth Biosciences 也在研究和开发小型Cas酶,包括Cas14和Casɸ。该公司于2021年9月获得1.95亿美元新融资,估值超过10亿美元。
论文链接:
https://www.nature.com/articles/s41586-022-04470-1
https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00648-1
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




