- +1
科学家首次发现致病大肠杆菌会往肠细胞中注射新型毒素,破坏肠细胞DNA,促进癌症的发生
原创 奇点糕 奇点网 收录于话题 #肠癌 2个

不要贴贴,不要贴贴,贴贴危险,还是密接。
我们的肠上皮细胞是真的不想和致病菌发生密切接触。
近日,来自约翰霍普金斯大学的Fangyi Wan教授及其团队,在著名期刊Cancer Discovery上发表了一项重要研究成果[1]。
他们发现肠道中的黏附型致病菌可以通过其3型分泌系统(T3SS)与肠上皮细胞连接,并注入基因毒素(genotoxin)UshA破坏宿主肠上皮细胞中的DNA,导致细胞癌变以及肠癌的发生。

论文首页截图
每个人的肠道里免不了会有一些致病菌在伺机而动搞破坏。服用抗生素、吃了奇怪的食物或者旅行过程中我们容易出现腹泻的现象,就是由于肠道菌群平衡被打乱,致病菌借机大量复制,扰乱了肠上皮细胞的紧密连接和代谢活动。
更值得注意的是,在全球每年新发结直肠癌患者中,有200万人曾有过轻度到中度的腹泻、呕吐等食物中毒症状。这些患者的食物中毒症状是由哪些致病菌引起的?食物中毒和肠癌的发生有没有直接关联?搞清楚这些问题可能会对癌症的早期诊断起到重要作用。
实际上,已经有一些肠道菌上了科学家们的“致癌”黑名单。有研究表明,脆弱拟杆菌、具核梭杆菌以及大肠杆菌能够表达聚酮化合物合酶,干扰细胞周期,诱发癌症或者加速肠癌的恶化[2]。
尤其是肠致病性大肠杆菌(EPEC)和肠出血性大肠杆菌(EHEC)这两种大肠杆菌,是造成腹泻、出血的两大元凶,也具备潜在的致癌能力。它们可以穿过凝胶样的黏液层,黏附甚至侵入肠上皮细胞,直接靶向攻击宿主细胞,造成肠道损伤。然而关于这两类大肠杆菌致癌的具体分子机制我们还知之甚少。
为了解决这一难题,Wan教授及其团队利用柠檬酸杆菌(Citrobacter rodentium,CR)小鼠感染模型模拟人体EPEC、EHEC感染,来评估黏附型致病菌诱导肠癌的能力。
科学家已经知道,CR、EHEC和EPEC都是通过3型分泌系统(T3SS)这个蛋白复合物和肠道上皮细胞连接的[3]。Wan教授团队在动物实验中发现,当缺失了这一分泌系统后,CR突变株仍能在无菌小鼠的肠道中正常增殖,但是大部分无法锚定在肠道上皮细胞上,而且这一突变株感染的小鼠肠上皮细胞DNA结构未检测到损伤。
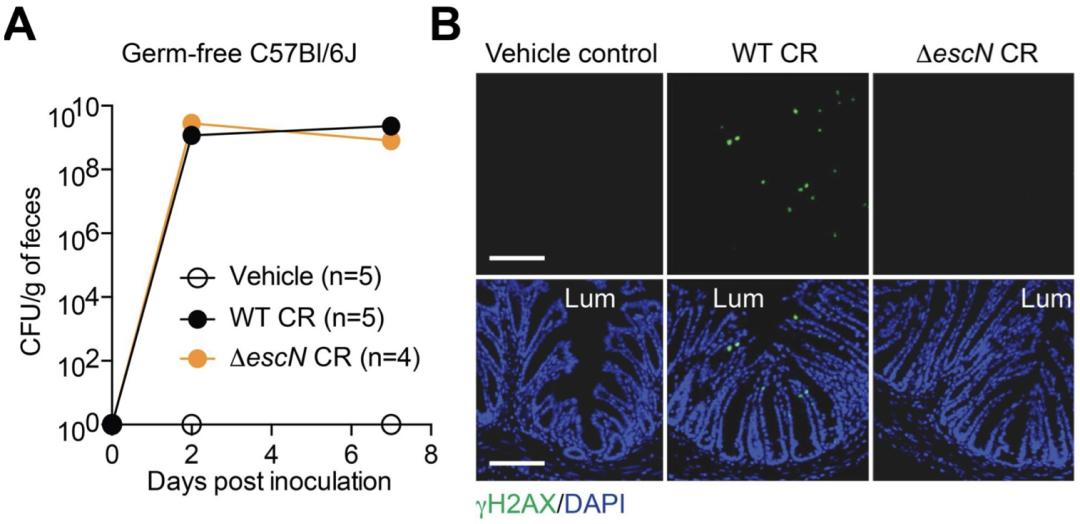
野生型CR菌株和T3SS缺陷的CR菌株感染小鼠后不同时间点在粪便中的活菌量(左)以及在小肠上皮的黏附情况(B)
由这一实验结果研究人员们想到,CR可能是借助T3SS这一金字塔型的通道结构,向上皮细胞里分泌了某些破坏DNA的毒力蛋白。借助氨基酸同位素标记和质谱检测的方法,科研人员们获得了T3SS所分泌的蛋白库,并分析了每种蛋白的分泌量、潜在功能,发现其中具备消化或破坏DNA结构的能力的蛋白多达11种。
科研人员们进一步合成了这些蛋白,分别将每种蛋白与Lambda DNA在体外共孵育,以验证它们对DNA的破坏能力。其中UshA这一蛋白凭一己之力就导致超过50%的DNA损伤(以脱氧核糖核酸酶Dnase I消化的DNA为100%)。
而且UshA这一蛋白在表达T3SS的黏附型致病菌相当保守,CR、EHEC、EPEC这三种致病菌都表达高度同源的UshA。科研人员对这些菌株的UshA基因分别进行了敲除和回补,并用野生菌株、UshA缺陷菌株和回补UshA后的菌株感染同一细胞系SW480,发现只有表达UshA的菌株才能破坏细胞系的DNA。
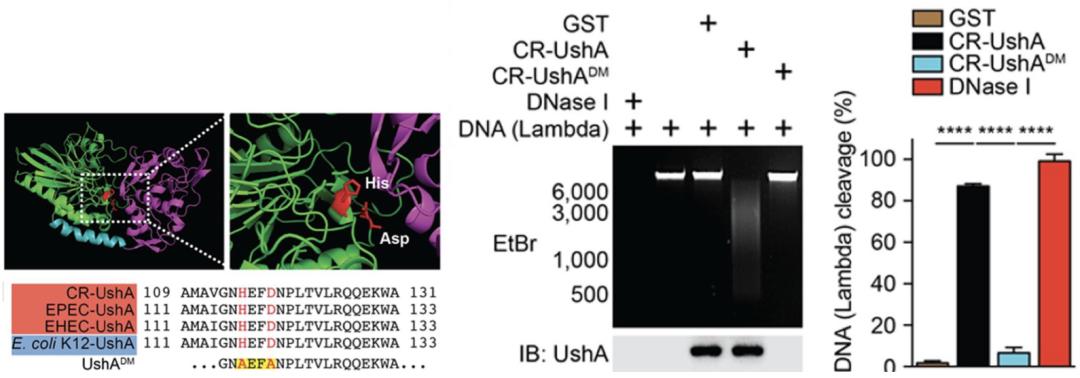
Lambda DNA分别与CR表达的UshA蛋白、UshA基因点突变后的缺陷蛋白UshADM或DNA酶共孵育20分钟后DNA的消化百分率
接下来的一步,就是验证CR在小鼠体内是否仍然依靠UshA破坏宿主细胞DNA。与UshA突变株相比,CR野生型或携带UshA回补基因的CR菌株,对小鼠肠上皮细胞造成了更为显著的基因毒性损伤,这说明UshA在小鼠体内同样是破坏肠上皮细胞DNA的元凶。
众所周知,肠上皮细胞的DNA损伤积累到一定程度会引起肿瘤的生发。
Wan教授团队选择使用ApcMinΔ716/+这一小鼠模型(一种对环境变化诱发的癌症更为敏感的基因突变小鼠),检验UshA在肠上皮细胞中引发的DNA损伤,经过长期积累会不会诱发肿瘤的出现。
CR野生型、UshA突变株以及回补UshA后的CR菌株感染ApcMinΔ716/+小鼠后,肠道中的CR细菌载量在第4天达到最高峰,在感染35天后已被完全清除。
然而当Wan教授团队对比感染后3个月的肠道结构时发现,CR野生株感染过的ApcMinΔ716/+小鼠体内出现了大量肿瘤,肠道炎症和结构损伤严重。而感染UshA突变株的小鼠肠道内肿瘤的大小虽然与感染野生型CR的小鼠差别不大,但肿瘤数量却远远低于后者。而回补UshA的CR菌株感染后诱发的肿瘤数量和CR野生型感染组的肿瘤数量类似。
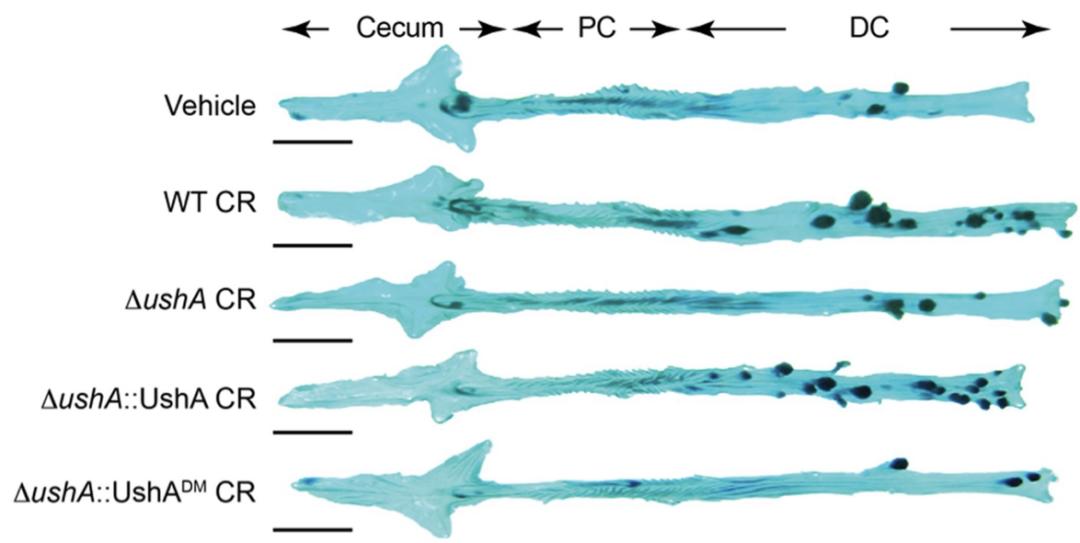
野生型CR、UshA基因缺陷的CR菌株以及回补UshA后的CR菌株感染小鼠56天后对直肠进行亚甲蓝染色,深色代表肿瘤部位
总而言之,这类T3SS致病菌黏附、放毒、致癌这一整个大动作可以说是非常“不讲武德了”。哪怕宿主免疫系统再厉害,把病原物清干净了,但是病原物诱导的DNA损伤还是可以持续积累,让宿主患癌风险增加。
这也提醒我们,面对这种“无赖”致病菌,清除只是一方面,探测它们是否引起了肠上皮细胞中的点突变并及时干预,是阻止后续肿瘤发生的关键。
虽然体内实验仅使用了小鼠模型,但UshA诱导的小鼠肠癌细胞基因中的单碱基取代模式和结肠癌病人癌细胞中的基因突变模式有一定的重合,因此这一研究对细菌感染引发人结肠癌的生发和发展也有一定的指导意义。

参考文献
1. Liu Y, Fu K, Wier EM, et al. Bacterial Genotoxin Accelerates Transient Infection-Driven Murine Colon Tumorigenesis. Cancer Discov. 2022;12(1):236-249. doi:10.1158/2159-8290.CD-21-0912.
2. Nougayrede JP, Homburg S, Taieb F, Boury M, Brzuszkiewicz E, Gottschalk G, et al. Escherichia coli induces DNA double-strand breaks in eukaryotic cells. Science 2006;313(5788):848-51 doi 10.1126/science.1127059.
3. Deng W, Puente JL, Gruenheid S, Li Y, Vallance BA, Vazquez A, et al. Dissecting virulence: systematic and functional analyses of a pathogenicity island. Proceedings of the National Academy of Sciences of the United States of America 2004;101(10):3597-602 doi 10.1073/pnas.0400326101.


责任编辑丨BioTalker
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




