- +1
Nature系列综述:RNA疗法的递送系统,及其成功的六大特征
来源 | 药明康德
基于RNA的疗法不但能够调节基因表达,而且可生产治疗性蛋白或激发免疫反应的抗原,从而治疗包括传染病、癌症、免疫疾病和遗传疾病在内的多种疾病类型。然而,基于RNA的疗法分子量较大,它们携带的阴离子电荷,以及容易被RNA酶降解的特征,让这些分子难于进入细胞中行使它们的功能。
为了克服这一障碍,科学家们已经开发出多种基于病毒和非病毒的递送系统,近日 Nature Reviews Genetics 上发表的一篇综述对非病毒递送系统进行了盘点。作者还指出了进一步优化RNA递送系统开发的机会,并总结了成功RNA递送系统的六大特征。

不断扩展的RNA疗法
近年来,基于RNA的疗法类型不断扩展。综述作者将这些疗法分为两大类:第一类疗法通过递送分子量较小的RNA分子,它们包括siRNA,反义寡核苷酸(ASO),和能够招募内源性RNA编辑酶ADAR酶的寡核苷酸。这些分子量较小的RNA分子的共同特征是可以使用化学合成在特定位置进行化学修饰,从而改变疗法的稳定性、药代动力学特征以及激发免疫系统反应的可能性。
此外,这些RNA分子都使用真核细胞中已有的酶来行使它们的功能,不需要另外递送分子量更大的酶进入细胞。
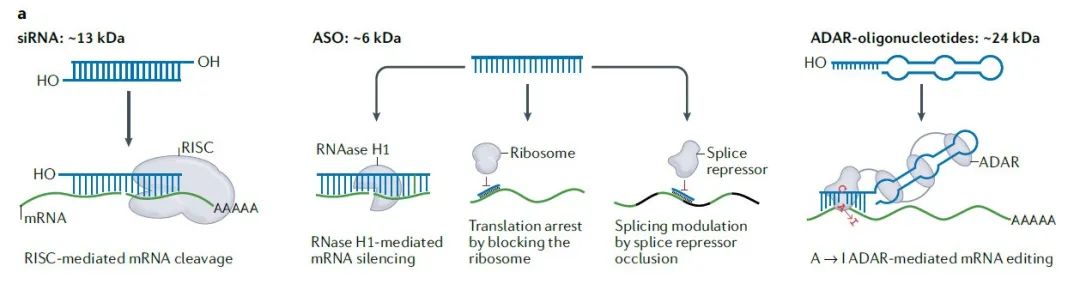
分子量较小的RNA疗法
另一种RNA疗法的类型是mRNA,它们可以编码具有治疗活性的蛋白或者引起免疫反应的抗原。mRNA还可以用于暂时表达锌指核酸酶,Cas核酸酶等旨在修改DNA的核酸酶。这些修改DNA的核酸酶尤其适合使用mRNA进行表达,因为它们表达的蛋白只存在几个小时或几天,但是表达的DNA核酸酶可以产生长效的基因编辑结果。
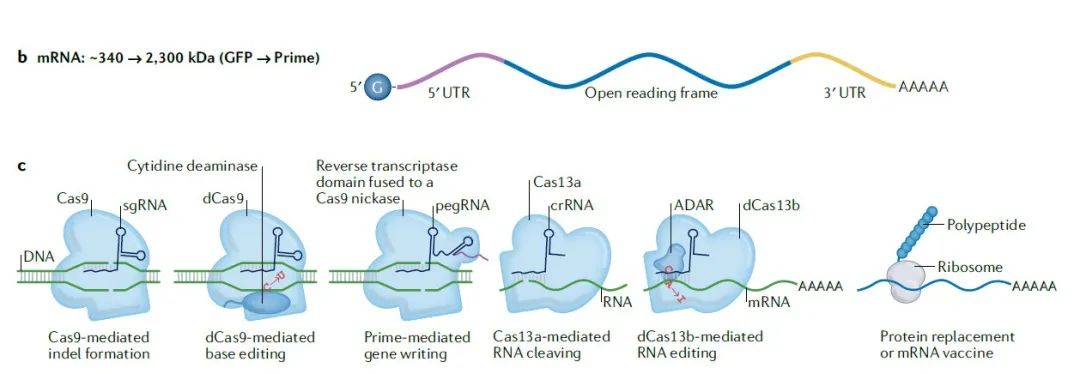
分子量大的mRNA疗法
RNA递送系统
虽然不同的RNA疗法类型具有不同的作用机制,但是它们都需要被递送到正确的组织中,而且不能激发有害免疫反应。迄今为止,科学家们已经开发出多种RNA递送系统。
基于脂质的递送系统
基于脂质的递送系统包括胶束(micelles),脂质体(liposome)和脂质纳米颗粒(LNP)。胶束由单层脂质分子构成,脂质体由双层脂质分子构成,而LNP则包含多层脂质,并且携带由脂质和核酸结合成的微域。目前FDA批准的脂质递送系统均包含4种基本成分:胆固醇、辅助脂质、PEG修饰脂质和阳离子或可电离脂质。
由于脂质的结构可以影响递送,而且脂质可以通过化学反应简易合成,因此科学家们已经创建了包含上万种化学结构迥异的脂质递送系统库。这些努力和更为理性的脂质分子设计相结合,已经大幅度提高了向肝脏递送RNA疗法的效率,在小鼠模型中,将向肝脏递送的siRNA所需的剂量降低了500倍。
此外,改变LNP的脂质组分或者添加新的脂质分子,可以促进LNP递送到肝脏以外的组织。Intellia Therapeutics和Beam Therapeutics公司都已经分享了将mRNA递送到造血干细胞和祖细胞中的LNP信息,它们带来了开发靶向体内造血干细胞疗法的希望。
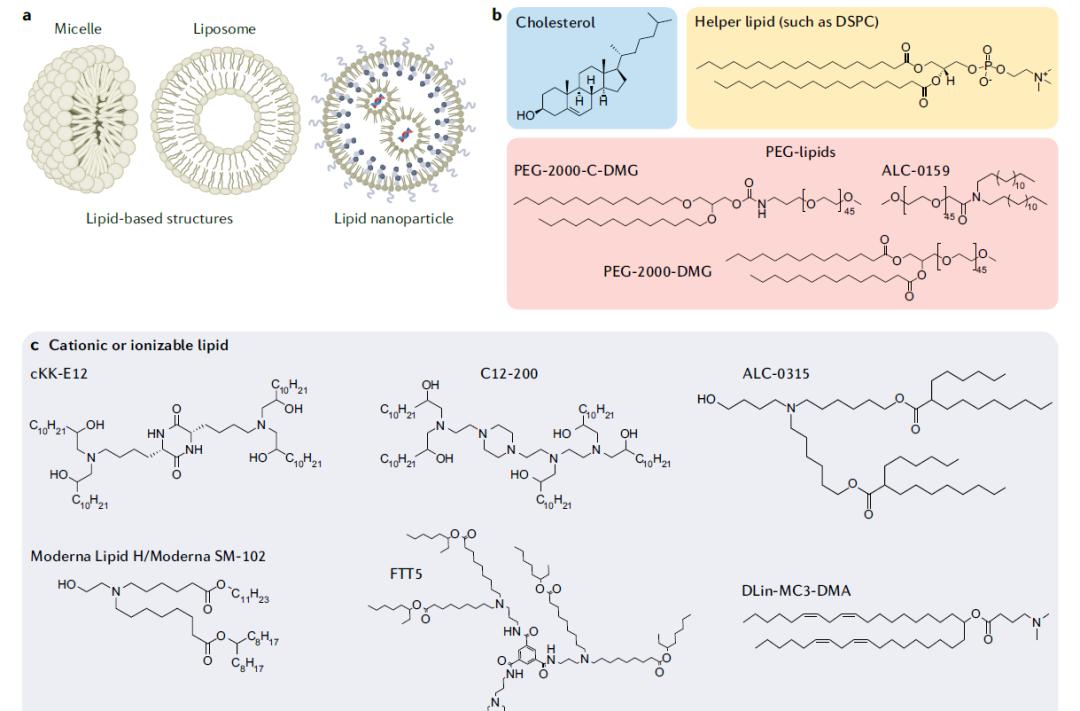
基于脂质的RNA递送系统
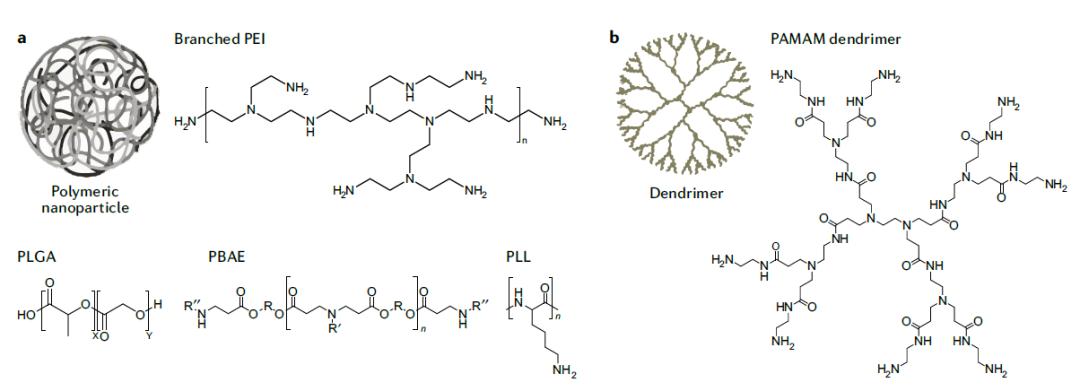
聚合物和基于聚合物的纳米颗粒
很多非病毒递送系统使用聚合物和基于聚合物的纳米颗粒。化学家可以调节聚合物的极性、降解性和分子量,来改变聚合物递送RNA进入细胞的效率。比如,携带胺基的聚合物可以呈阳性,它们可以与RNA分子通过静电作用相结合,帮助递送它们进入细胞。有些聚合物分子携带可以被生物降解的酯键,它们可以改善聚合物的生物降解性和细胞毒性。
对聚合物的研究已经发现了一些设计有效聚合物的原则,这让高通量化学合成聚合物库,然后通过高通量药物递送研究筛选候选递送系统成为可能。这一策略也可以用于开发脂质纳米颗粒。
基于聚合物的RNA递送系统
另一类递送RNA的聚合物称为树枝状大分子(dendrimers)。这些大分子以一个核心分子为中心,通过重复增长反应合成具有高度分支的聚合物(见上图b)。携带阳离子基团的树枝状大分子可以与RNA生成复合物。已有研究显示,它们可以将RNA递送到中枢神经系统,将siRNA递送到肝脏内皮细胞中,还能用于通过肌肉注射,递送针对埃博拉病毒和流感病毒的疫苗。改造树枝状大分子的结构可以保护核苷酸不被酶降解。
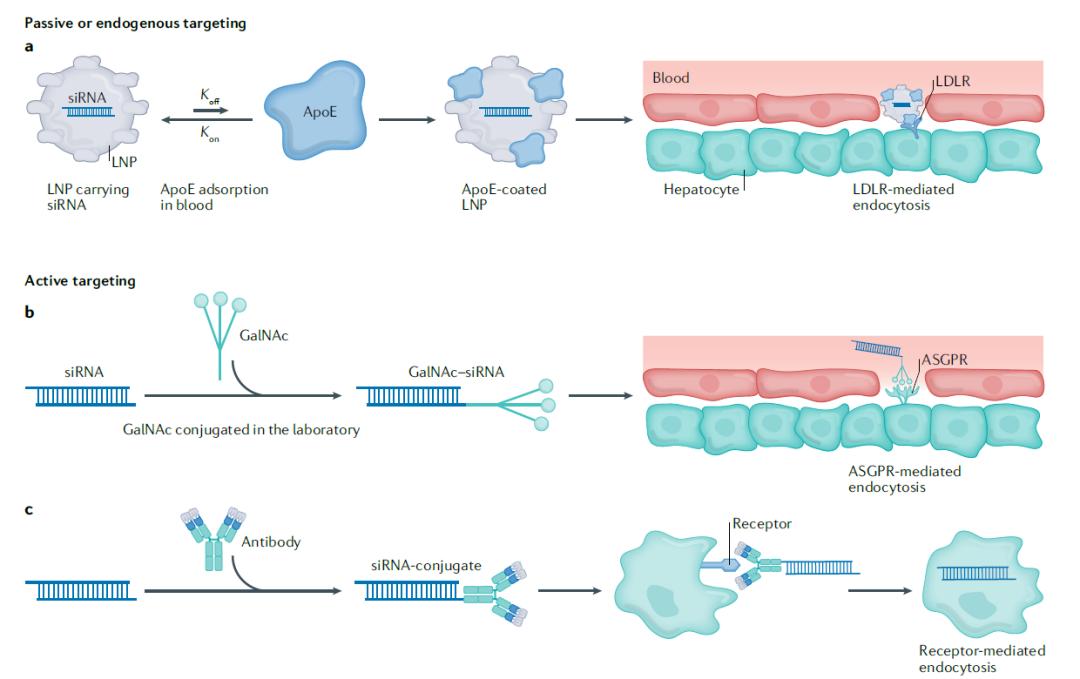
主动和被动靶向递送
递送RNA的载体可以通过两种机制到达它们靶向的细胞或组织。一种机制依赖纳米颗粒表面吸附的生物分子(被动靶向)。纳米颗粒由于体积很小,它们的表面积/体积比非常高。当纳米颗粒被引入生物环境中(比如进入血液循环),环境中的很多生物分子会结合在纳米颗粒表面,这些结合在纳米颗粒表面的化学和生物分子会改变纳米颗粒与免疫细胞和靶标组织的相互作用。
比如,载脂蛋白E(ApoE)的吸附对可电离脂质递送siRNA进入肝细胞至关重要,它导致LNP通过低密度脂蛋白受体(LDLR)被肝细胞吸收。
主动和被动靶向策略
主动靶向策略将能够与特定生物分子结合的配体加入到递送系统中。目前临床验证最为充分的例子是GalNAc偶联的siRNA和ASO,FDA批准的疗法givosiran、lumasiran和inclisiran都采用了这种策略。GalNAc能够与去唾液酸糖蛋白受体(ASGPR)结合,ASGPR是一个主动靶向的理想受体,它在肝细胞表面高度表达,不在其它细胞类型中表达,与GalNAc结合后迅速引起内吞,然后可以迅速回收,重新回到细胞表面。这一受体和优化配体的结合,显著减少了皮下注射siRNA和ASO的毒性。
将其它小分子或者抗体/抗体片段与RNA偶联在一起,可以将RNA递送到肝脏以外的组织中。比如,使用抗CD71抗体或抗体片段可以将siRNA递送到心肌和骨骼肌中,导致长期基因沉默。基于这一策略, Avidity Biosciences已经启动1/2期临床试验,检验治疗I型强直型营养不良的siRNA疗法的功效。
ASO和siRNA由于分子量较小,可以通过直接偶联小分子或抗体达到主动靶向的效果。而mRNA的分子量太大,因此它们的主动靶向递送策略依靠在装载mRNA的纳米颗粒表面装饰抗体。比如,研究人员已经开发出一套依靠在LNP中携带的脂蛋白递送siRNA或mRNA的系统。这一系统利用固定在LNP表面的脂蛋白与抗体的Fc端相结合,改变抗体的可变区就可以让LNP靶向不同的细胞。这一系统已被用于靶向肝外细胞,治疗炎症性肠病。
提高RNA递送系统开发效率的机会
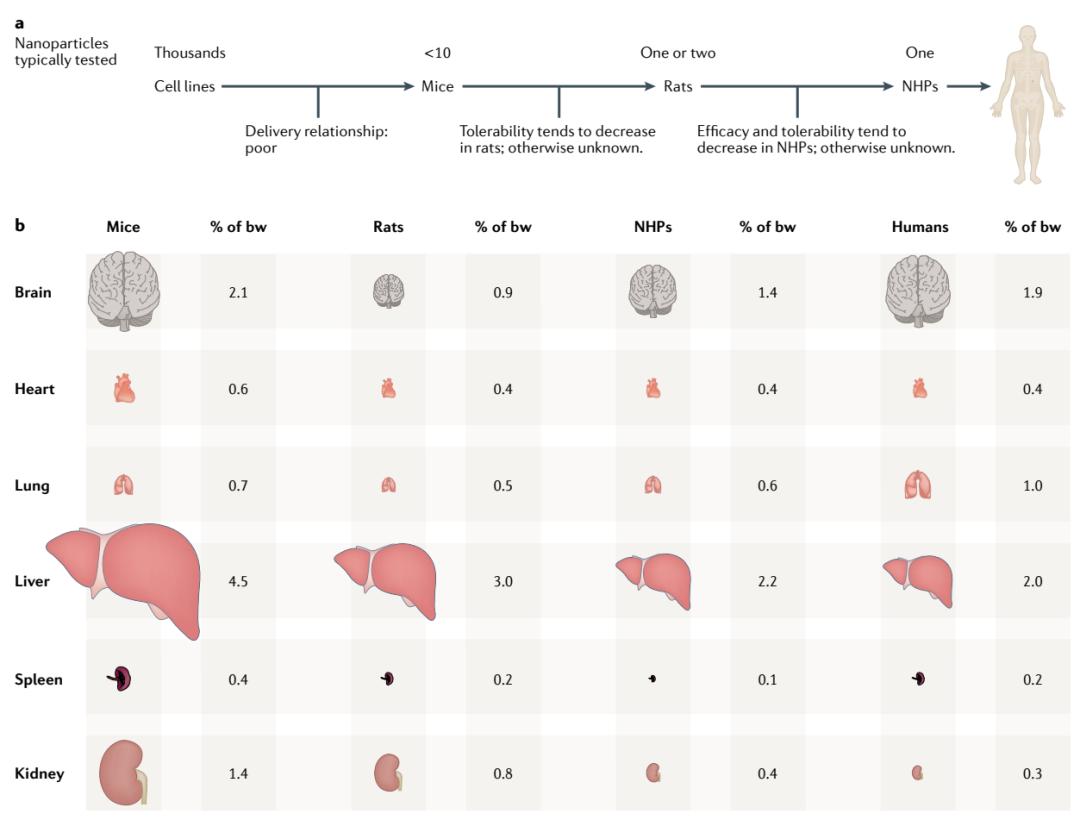
作者指出,不管使用哪种靶向机制和化学结构,基于纳米颗粒的RNA递送系统需要经过一系列临床前实验的筛选。这些实验通常从基于细胞系的高通量筛选开始,最初可能需要检验上千种纳米颗粒,然后一小部分被选出进行小鼠实验,更少的几种被用于进行非人灵长类动物实验。只有在非人灵长类实验中表现出足够安全性的纳米颗粒才有可能进入临床开发阶段。
临床前纳米粒子发现流程
这一流程虽然已经开发出成功递送RNA的纳米颗粒,但是仍然有进一步提高开发效率的空间。比如,化学家可以合成上千种纳米颗粒,但是同时在上千只小鼠中进行实验验证它们的体内递送效率并不现实。因此,最初的纳米颗粒评估通常在细胞系中进行,然而细胞培养环境下的递送结果不能有效预测体内递送的效率。
为了解决这个问题,科学家已经开发出DNA条形码系统,让在动物体内同时检测上千种纳米颗粒成为可能。在这一系统中,不同的LNP虽然携带同样的RNA,但是配方中加入了不同的DNA条形码。科学家们可以将携带不同条形码的LNPs混在一起注射到小鼠体内,然后收集靶标组织或细胞,分离并且检测所有条形码的水平。这一策略已经被用于开发不需要靶向配体就能将RNA递送到非肝细胞组织的纳米颗粒。
另一条改进纳米颗粒开发效率的途径是理解哪些小动物模型能够最好地预测在非人灵长类动物中的递送效果。不同物种间的差异,比如基础代谢率、血清脂质种类,器官体重比等等,都可能影响递送的效率。比如,与非人灵长类相比,小鼠和大鼠肝脏与体重的比例更高,这可能增强小鼠和大鼠中肝脏对RNA的摄入。综述作者表示,发现能够最大限度预测在非人灵长类动物中递送效果的小动物模型将是推动整个RNA疗法领域的重要进展之一。
成功RNA递送系统的特征
根据FDA已经批准的RNA药物递送系统,综述作者总结了它们共享的主要特征,它们是:
合成手段使用可扩展的化学手段并且通常可以被生物降解。比如,在可电离脂质中引入酯键可以改善LNP的安全性。
化学合成途径足够简单,能够支持在人类中使用的生产规模。
药物递送系统需要有可以接受的靶向和脱靶递送比率。靶向和脱靶递送需要同时使用生物分布和功能化指标来衡量。因为95%的RNA可能被保留在内体(endosome)中,生物分布并不见得能够预测RNA的功能性递送。
产生疗效的RNA剂量必须显著低于可能产生毒性的剂量。理想情况下,毒理研究应该在非人灵长类动物中进行。
药物的活性应该在不同批次之间保持一致。
在大多数临床环境下,重复给药不会导致疗效或安全性的丧失。
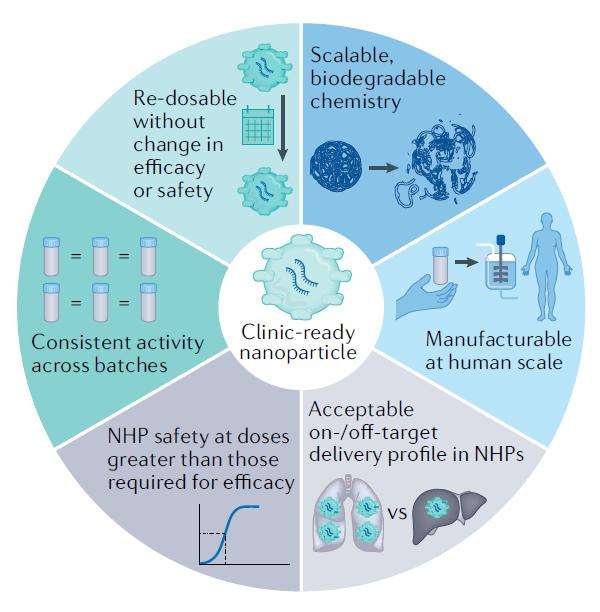
适合在临床环境下使用的递送系统的特征
作者指出,遵循这些在早期开发阶段就可以评估的特征,能提高药物递送系统的开发成功几率。
原文链接:
https://www.nature.com/articles/s41576-021-00439-4
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




