- +1
北大团队升级RNA编辑技术:安全效率大幅提升,离临床更近一步
近年来,以CRISPR/Cas9为代表的基因组编辑技术在生物医学等领域的研究和转化尝试如火如荼。但对大多数科学家来说,修改人类“生命密码本”的工作仍在小心翼翼地进一步完善中。
RNA(核糖核酸)编辑即是近年来兴起的一项新型基因编辑技术,并且国际药企已经在该技术上进行布局。其中一项被命名为“LEAPER”的技术,系北京大学生命科学学院教授魏文胜团队自主创新的RNA编辑技术。此前的2019年7月,魏文胜团队在国际学术期刊《自然-生物技术》(Nature Biotechnology)上报道了LEAPER技术。北京时间2月11日凌晨,该研究团队再次在《自然-生物技术》上报道了升级版LEAPER 2.0技术。

“与以CRISPR为基础的DNA或者RNA编辑技术不同,LEAPER仅需要在细胞中表达特殊设计的RNA(ADAR-recruiting RNA, arRNA)即可招募细胞中内源脱氨酶ADAR,实现靶向目标RNA中腺苷A→肌苷I(鸟苷G)的编辑。”魏文胜在接受澎湃新闻(www.thepaper.cn)记者采访时表示,由于无需引入外源编辑酶或效应蛋白,避免了由此引起的基因组和转录组上的脱靶效应、递送负担以及相关的免疫原性等问题。
值得注意的是,LEAPER完全摆脱了对CRISPR系统的依赖,是具有自主知识产权的底层核心技术,具有重要的原始创新意义。
魏文胜同时提到一点,作为RNA精准编辑工具,“LEAPER不会引起基因组序列改变,在安全性方面具有优势。”在这项最新的研究中,研究团队对LEAPER的编辑效率和脱靶问题进行了进一步优化升级。
值得关注的是,《自然-生物技术》也同期刊发了加利福尼亚大学圣迭戈分校(UCSD)助理教授Prashant Mali团队的一项研究,Mali等人同样发现,运用可招募细胞内源ADAR脱氨酶的环形RNA能够提高RNA编辑的效率。ADAR1脱氨酶是一类在人体内各组织中广泛表达的腺苷脱氨酶,能够催化目标RNA分子中腺苷A→肌苷I(鸟苷G)的转换。
“虽然目前全世界大部分的RNA编辑技术的研究处于实验室阶段,但距离临床应用已经越来越近了。” 魏文胜谈到,在技术层面上,利用内源机制实现更安全的RNA编辑,“我们在国际上处于领先梯队内,在这个研究领域具有竞争优势。”
解决LEAPER两大局限问题
以CRISPR/Cas9为代表的基因组编辑技术目前仍存在着一系列问题,其在临床治疗应用中也遭遇瓶颈。在魏文胜等人看来,问题的根源之一在于当前的基因编辑体系依赖于细菌或病毒来源的编辑酶或效应蛋白的表达,比如细菌中的Cas9核酸酶。
这一依赖会导致多重问题。例如蛋白分子量过大使得通过病毒载体进行装载及人体内递送十分困难、由蛋白过表达引起的DNA/RNA水平的脱靶效应、由外源蛋白表达引起的机体免疫反应及损伤、机体内的预存抗体使外源编辑酶或效应蛋白被抗体中和从而导致基因编辑失败等。
魏文胜等人的解决思路是利用细胞中天然存在的机制。他们在此前的研究中首次发现,只需转入一种特殊设计的ADAR-recruiting RNAs (arRNAs),就能够通过招募细胞内源的ADAR1脱氨酶对靶向基因转录本上特定的腺苷产生高效精准的编辑,并不需要引入任何外源效应蛋白。这种新型RNA编辑技术即被命名为LEAPER (Leveraging Endogenous ADAR for Programmable Editing on RNA)。
研究团队此前证明,LEAPER能对RNA分子上绝大多数的腺苷酸位点进行精准编辑。在人的原代细胞-包括肺成纤维细胞、支气管上皮细胞及T细胞中,LEAPER的编辑效率最高可达80%。
“尽管LEAPER在科研和疾病治疗中具有可观的潜力,该技术还存在一定的局限。”魏文胜谈到两点,一是LEAPER利用的是内源编辑酶,其编辑效率会因此受限;另外,具有一定长度的arRNA可能使目标编辑位点邻近的碱基发生脱靶编辑。
在这项最新的研究中,他们首先发现通过优化表达载体中的启动子增强arRNA表达可以显著提升LEAPER系统的编辑效率,“表明arRNA在细胞中的丰度对于编辑效率十分关键。”
另一个关键点在于,由于线性arRNA在细胞内容易被降解,团队想到了利用环化方式。环形RNA由于没有5’或3’末端,可以避免核酸外切酶的切割,在细胞内相比于线性RNA具有更好的稳定性和更长的半衰期。
“我们设计了工程化的环形arRNA(circ-arRNA)。”魏文胜表示,研究发现,circ-arRNA能够维持较长时间的高水平表达。在多个内源转录本位点中,circ-arRNA平均编辑效率相比于线性版本提升了超过3倍,同时也可维持长达近半个月的有效编辑。
研究进一步发现,通过腺相关病毒(AAV)递送,遗传编码的circ-arRNA可以在人的原代细胞和类器官中实现长时程的RNA编辑。另外,体外合成的circ-arRNA也可实现高效的靶向编辑,并且与遗传编码的circ-arRNA具有类似的特征。
魏文胜总结道,由于LEAPER 2.0 仍然使用细胞内源的编辑酶,无需外源过表达编辑酶,因此可以避免递送困难和过表达外源编辑酶造成的全转录组范围内的脱靶编辑。
另外重要的是,LEAPER 2.0通过特殊设计,消除了一种特别的邻近碱基脱靶编辑(bystander off-target editing),在安全性、精准度上获得大幅提升。
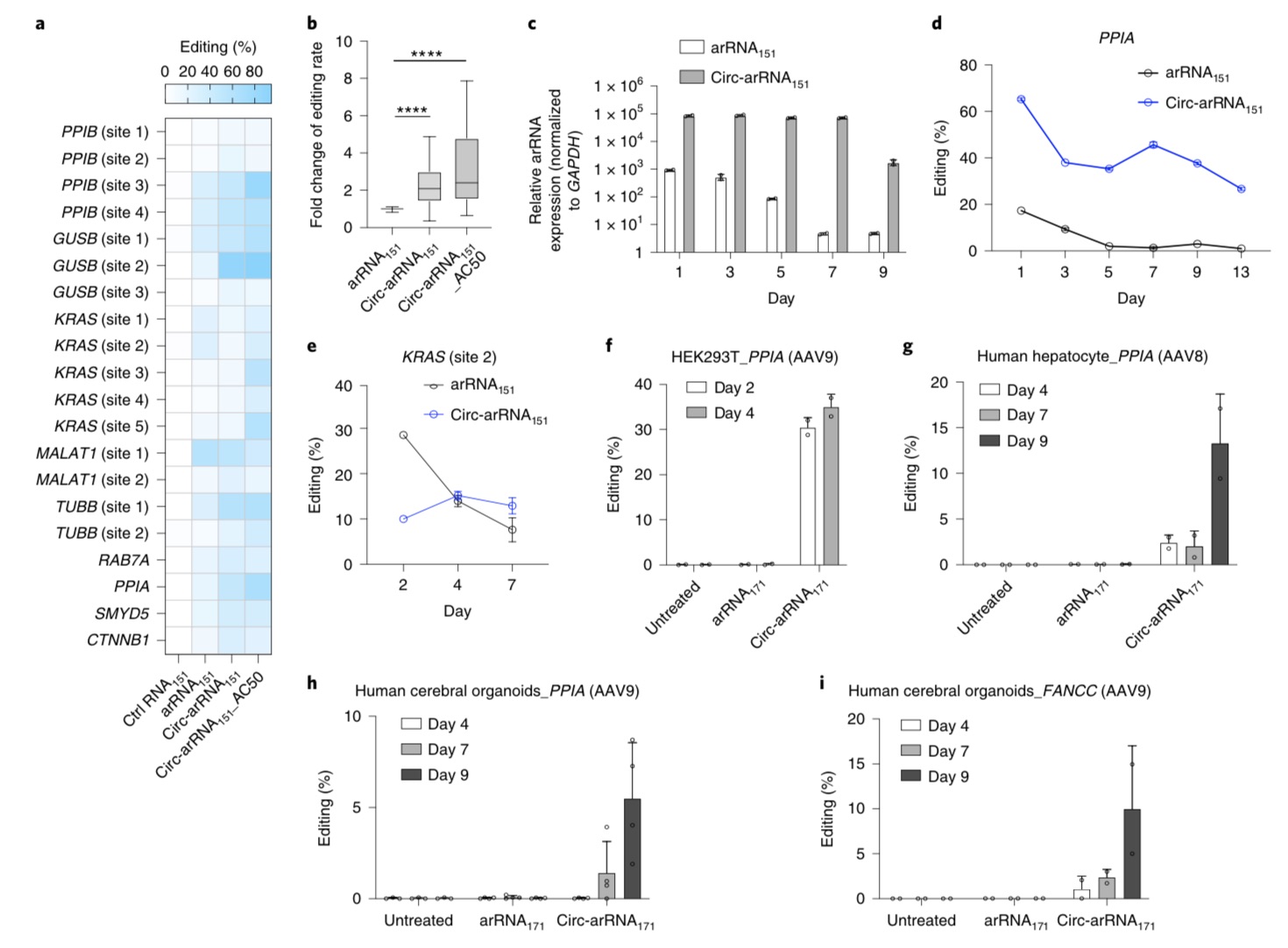
Circ-arRNAs能够对内源转录本进行高效、持久的RNA编辑。
国内外均在进行RNA编辑技术转化
和此前的版本类似,研究团队在这项最新研究中也对LEAPER 2.0的应用潜能进行了评估。
他们的研究显示,利用LEAPER 2.0技术,可以成功激活Wnt信号通路(一类在物种进化过程中高度保守的信号通路),修复TP53基因(一种抑癌基因)中的致病突变使其表达的p53蛋白恢复正常的转录调节功能。
研究团队还初步在小鼠模型上进行了技术验证。他们使用腺相关病毒将circ-arRNA递送至Hurler综合征疾病模型小鼠体内,可以成功修复IDUA转录本上的致病突变并恢复IDUA的正常催化功能。
Hurler综合征是一类复杂的、进行性多系统受累的遗传性溶酶体病,可影响全身器官和组织。患者由于艾杜糖醛酸酶a-L-Iduronidase (IDUA)的缺失,造成糖胺多糖(GAGs)在溶酶体的累积,引起多器官病变。该疾病属于常染色体隐性遗传病。
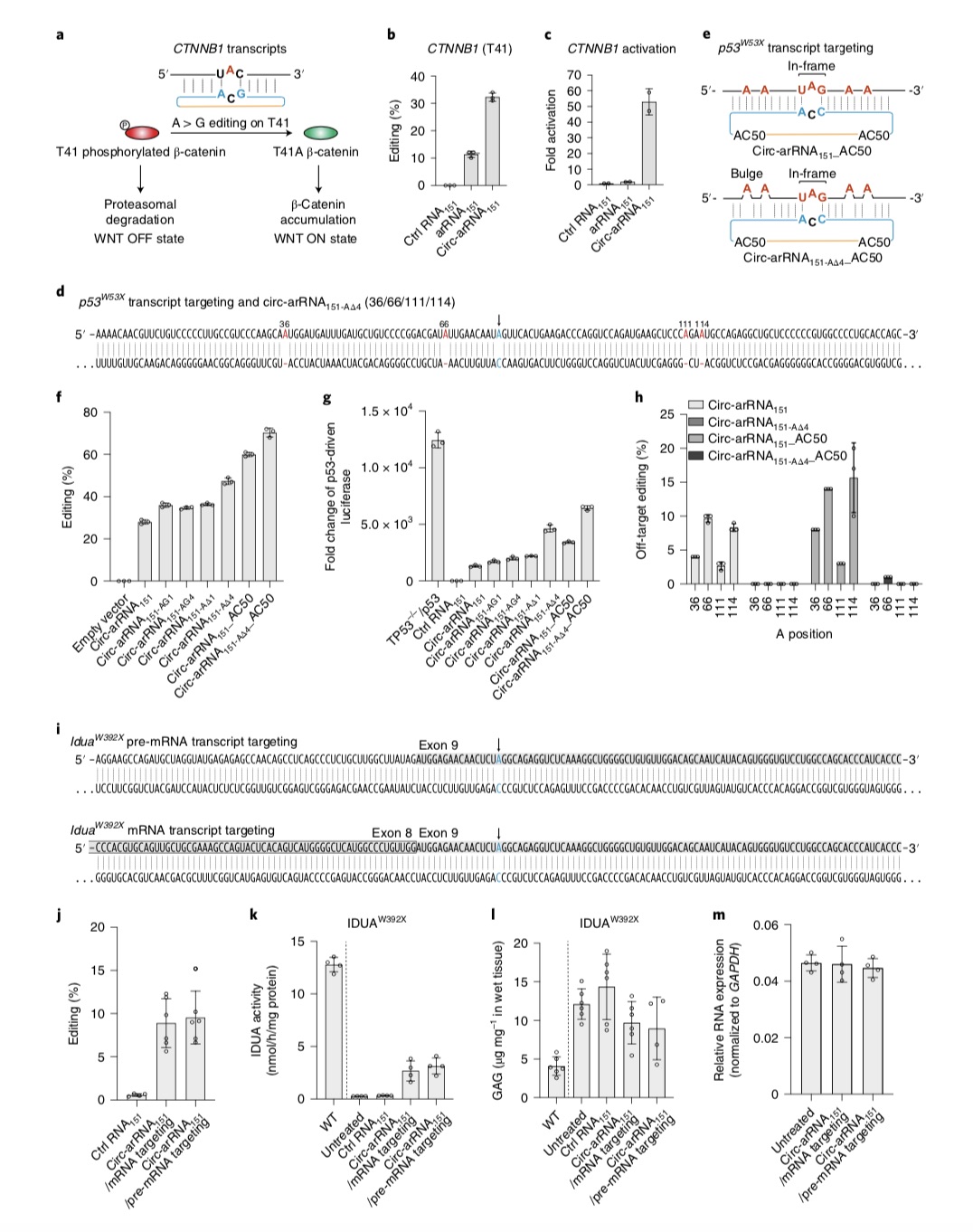
circ-arRNAs对细胞培养和Hurler综合征小鼠蛋白质功能的激活和恢复。
魏文胜谈到,“目前尚无治愈黏多糖贮积症的方法,主要疗法包括改善生活质量的对症治疗、酶替代治疗和骨髓移植/造血干细胞移植。现有疗法则过于昂贵,而且患者和家属需要花费大量时间在医院,应用困难。”
他认为,针对这类疾病,RNA编辑具有优势,“而我们新开发的LEAPER 2.0 与AAV递送系统相结合可以实现长时程的有效编辑,这对治疗Hurler综合征等众多的遗传病是一个好的选择。”除Hurler综合征之外,魏文胜提到,LEAPER 2.0在眼部或者脑部遗传疾病的治疗上也已经观察到了非常好的效果。
总体而言,魏文胜认为,LEAPER技术在临床应用和疾病治疗方面拥有其独特的优势和潜能。“LEAPER作为一项RNA编辑技术,其编辑是可逆、可调控的,而且编辑效果与剂量相关,原理上讲更为安全。同时,LEAPER技术通过向细胞内递送arRNA,招募内源ADAR蛋白完成编辑,递送负担轻,无需引入外源编辑酶,更加适应体内基因编辑治疗。”
正如前述所说,在技术层面上,利用内源机制实现更安全的RNA编辑,国内科学家在国际上已处于领先梯队,在这个研究领域具有极大的竞争优势。而在产业转化方面,国内外又处于怎样的阶段?
魏文胜表示,国际上已经有一些生物医药企业在开展相关技术转化和开发工作,特别是去年,RNA编辑技术受到了极大关注。
例如,2021年8月,跨国制药企业罗氏和Shape Therapeutics公司达成一项研发合作和许可协议,将利用其RNA编辑技术平台RNAfix,以及AAVid技术平台,开发治疗阿尔茨海默病、帕金森病和罕见疾病的基因疗法。随后的2021年9月,礼来与ProQR Therapeutics达成一项全球性的许可和研究合作协议,两家公司将利用ProQR专有的Axiomer RNA编辑技术平台,针对肝脏和神经系统遗传疾病,推进新的药物靶点的临床开发和商业化,合作内容多达五个RNA编辑靶标。
至于国内,魏文胜提到,博雅辑因也正在开展LEAPER技术的转化工作。作为国内基因编辑领域的先锋,博雅辑因成立于2015年,总部位于北京,办公地点分布于广州、上海和美国剑桥,魏文胜系创始人。
博雅辑因首席执行官魏东此前在接受澎湃新闻(www.thepaper.cn)记者采访时表示,对基因编辑这种特别创新的技术来说,“它的首要任务就是要在不同的疾病上能够真正看见技术转化的产品,是不是有足够多的受益,而且安全可控。”特别严重且尚无有效疗法的疾病,例如遗传病和癌症是目前创新疗法的主要“验证区”。
魏东提到,公司目前整个管线的布局包括体外疗法和体内疗法。其中,体内疗法即基于LEAPER技术,正在针对眼科、神经系统等疾病进行研发。2020年,公司也曾在2020年的美国ASGCT年会上报告通过对IDUA信使RNA序列中第402密码子进行精准的、针对特定序列的腺苷A→肌苷I转换,生成野生型IDUA基因的信使RNA和蛋白质,治疗黏多糖贮积症I型最严重亚型Hurler综合征中的W402X突变患者的早期研究数据。
魏文胜在此次采访中也提到,针对LEAPER 2.0技术,博雅辑因正在开展相关转化工作。公司通过AAV递送开展了临床前研究,并在多个研究模型中取得了很好的数据,实现了LEAPER 2.0转化为体内编辑疗法的概念验证。
去年11月,博雅辑因还与北京协和医院睢瑞芳教授团队达成了研究合作,基于我国遗传性视网膜变性(IRD)人群的基因变异特征,探索推进体内基因编辑疗法;同月,该公司还也与威斯康星大学麦迪逊分校的David Gamm实验室达成研究合作,评估公司基于LEAPER技术的RNA碱基编辑候选疗法针对特定遗传疾病的药理特性。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




