- +1
Nature子刊:RNA编辑迈上新台阶
原创 生物世界 生物世界 收录于话题 #新型基因编辑工具 8个
撰文 | nagashi
编辑 | 王多鱼
排版 | 水成文
遗传疾病的治疗一直是一个亟待解决的难题。所幸,随着人类基因组学的发展,越来越多人类遗传病基因被相继发现,通过改变遗传病患者的基因序列从而从根本上治愈人类遗传病也由此成为了一种很有前景的治疗方法。
最近,各种可编程的、特定位点的基因信息操作工具的开发,为纠正致病基因突变创造了机会,例如David Liu(刘如谦)等开发的DNA碱基编辑器。但值得注意的是,DNA编辑可能诱发可遗传的、永久性的脱靶突变,这极大地限制了DNA碱基编辑器在人体内的应用。相比之下,RNA编辑只会瞬时改变mRNA,从而避免了安全和伦理问题。
近日,德国蒂宾根大学 Thorsten Stafforst 教授团队在 Nature Biotechnology 期刊上发表题为:CLUSTER guide RNAs enable precise and efficient RNA editing with endogenous ADAR enzymes in vivo 的研究论文。
该研究开发了一种簇状向导RNA——CLUSTER gRNAs,它们以多价方式结合靶标mRNA,无需外源蛋白,利用内源ADAR酶实现高精度和高效率的编辑,并能够靶向编辑以前的gRNA设计无法访问的序列。在细胞实验中,CLUSTER gRNAs实现了高达45%的编辑效率,而在小鼠实验中,CLUSTER gRNAs的编辑效率也高达10%。

RNA碱基编辑是基因组编辑的一个有前途的选择。目前,一些RNA编辑工具已经被设计用于靶向腺苷-肌苷(A-to-I)和胞苷-尿苷(C-to-U)的转换。这些RNA编辑工具需要异位表达一种经过改造的编辑酶,可能造成大量的脱靶编辑。事实上,在脆弱的小鼠疾病模型中,高度活跃的A-to-I编辑酶的异位表达导致了致命性后果。
基于此,越来越多的研究利用内源性RNA特异性腺苷脱氨酶(ADAR)来解决工程编辑酶的异位表达问题,但依旧存在序列限制、编辑效率低下和脱靶编辑等问题。
早在2016年10月,Thorsten Stafforst 教授团队就在 Nucleic Acids Research 上发表了利用内源性ADAR进行RNA编辑的相关研究,文章题为:Harnessing human ADAR2 for RNA repair - Recoding a PINK1 mutation rescues mitophagy。
研究团队设计了一种特殊的gRNA,它包含与靶标序列结合的互补,以及招募ADAR的RNA结构基序。当这些gRNAs以化学修饰的寡核苷酸形式被使用时,该设计尤其成功,STAT1等相关转录本的编辑产量在20-30%之间。

值得注意的是,研究人员发现同样的寡核苷酸序列在质粒中表达时效果要差得多。一种可能的解释是化学修饰的寡核苷酸具有更强的结合亲和力。因此,当特异性域扩展超过100 nt时,质粒携带的gRNAs通过内源性ADARs成功编辑了内源性靶点。
Thorsten Stafforst 将这些gRNAs称为LEAPER gRNAs,然而,LEAPER方法显示了大量的脱靶编辑,这是由于长链gRNA更容易结合非靶标mRNA。
因此,研究团队对其进行改进,并描述了新的CLUSTER gRNAs的设计原则——包含与靶标mRNA结合互补序列(Specificity domain)和一组7-20nt的招募序列(Recruitment sequence, RS),以及招募ADAR的RNA结构基序。
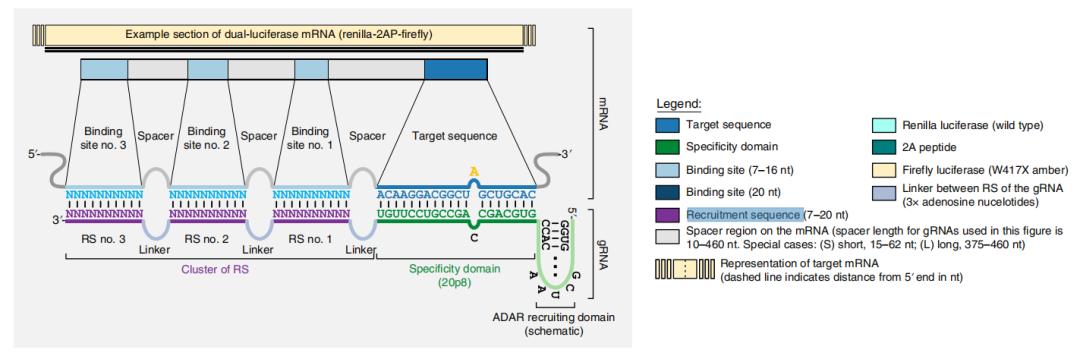
CLUSTER gRNAs的设计原则
这种CLUSTER设计使得基因编码的gRNAs具有高度的序列灵活性,它们以多价方式结合其目标mRNA,实现高精度和高效率的编辑,并能够靶向使用以前的gRNA设计无法访问的序列。
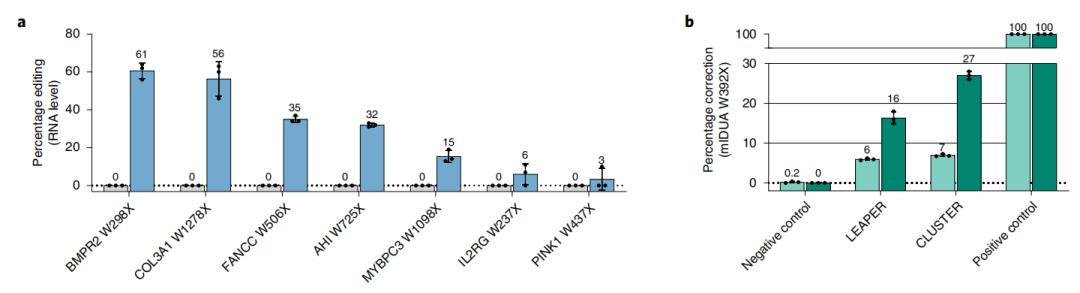
CLUSTER gRNAs实现更高精度和更高效率的RNA编辑
CLUSTER gRNAs可以通过病毒载体进行基因编码和传递,并在多种细胞系中实现高效率的编辑。在细胞培养中,CLUSTER gRNAs可实现内源性转录本的靶向编辑,效率高达45%。在体内,通过水动力尾静脉注射(HTVi)将CLUSTER gRNAs传递到小鼠肝脏中,编辑的报告基因构建率高达10%。
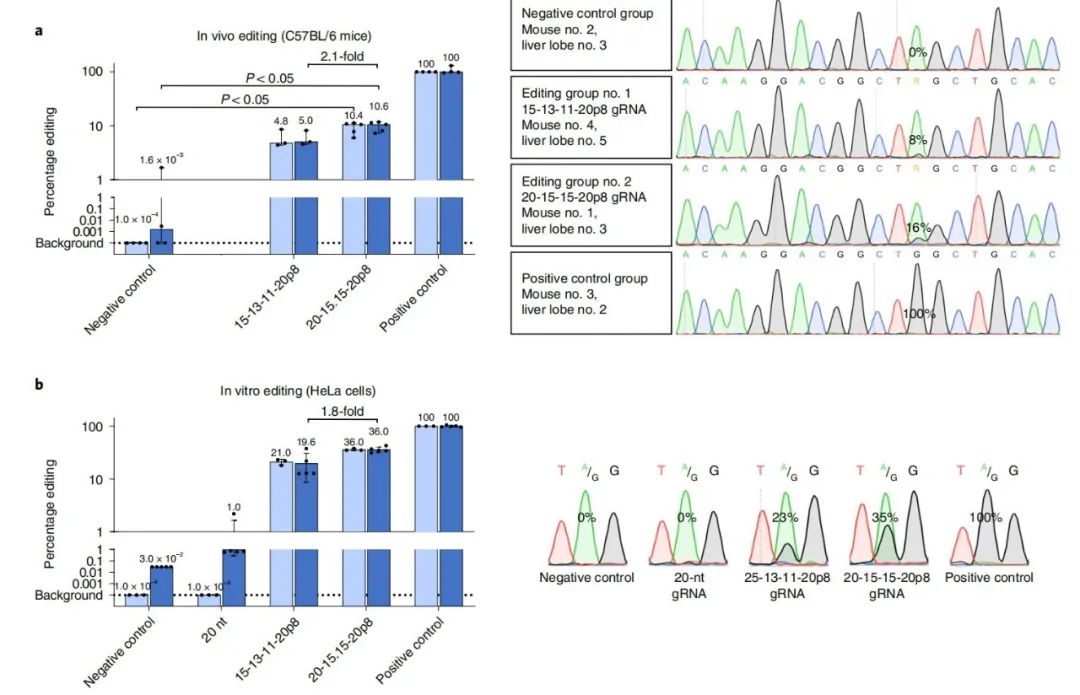
无论是体外实验还是体内实验,CLUSTER gRNAs都表现出很高的RNA编辑效率
总而言之,这项研究开发了一种簇状向导RNA——CLUSTER gRNAs,它可以招募内源性ADAR酶进行RNA编辑,并表现出更高的编辑效率和更少的脱靶效应。CLUSTER方法为RNA碱基编辑领域的药物开发开辟了新的道路!
论文链接:
https://www.nature.com/articles/s41587-021-01105-0
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




