- +1
基因编辑治疗的时代要来了吗?|2021科学突破
原创 bio kiwi biokiwi

写在前面
2021年年末,《科学》杂志提名了十项年度科学突破,其中不少进展与生命科学息息相关,而且充分展现了现阶段科学突破中,生命科学与其他学科交叉碰撞出来的强大能量。
今天我们来聊聊“CRISPR”——这项突破性的基因编辑技术似乎即将走进人类的生活。

其实对于很多人来说,“CRISPR”和“基因编辑”这两个词语并没有那么陌生,因为它们最近几年常常出现在新闻或报道里,尤其是2020年的诺贝尔化学奖,授予了两位发明 CRISPR 基因编辑技术的女科学家,让不少人对这项技术更加熟悉、认识更加深刻。

2020年诺贝尔化学奖获得者埃曼纽尔·卡彭蒂耶(左)和詹妮弗·杜德纳(右) | 图源:Nobel官网
来自美国加州大学伯克利分校的詹妮弗·杜德纳(Jennifer Doudna)和来自法国维也纳大学的埃曼纽尔·卡彭蒂耶(Emmanuelle Charpentier)共同发现了 CRISPR/Cas9 系统中,crRNA的定位能力、以及Cas9蛋白的切割作用。
简单理解的话,就好比是她们发现了基因层面的导航炸弹,能够精准的命中基因上的靶点。不仅如此,在应用过程中,他们还将这个“定位导航系统”进一步简化,使用这一技术的科学家只需要设计一段RNA序列,就像输入一组经度和纬度的坐标一样,就能够简单、准确地识别和编辑目标基因序列,这也显著增加了基因编辑的应用前景。
而这个应用前景在刚刚过去的2021年已经开始崭露头角。
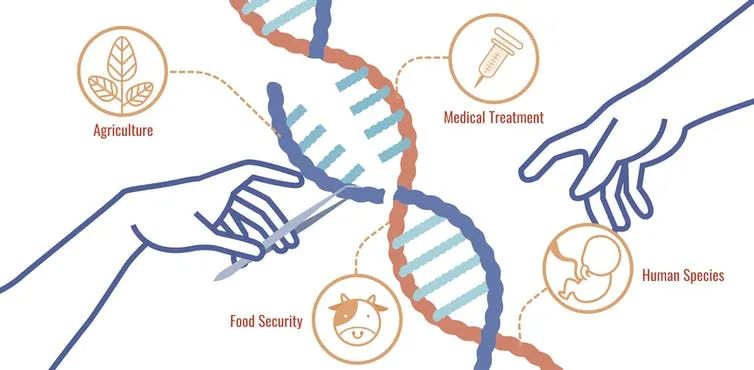
CRISPR技术的广泛应用
| 图源:TotallyMJ/shutterstock.com
2021 年 6 月 26 日,美国 Intellia 生物技术公司和再生元制药公司的科学家们开展了 CRISPR 基因编辑疗法的疗效实验,在6名患有一种名为转甲状腺素淀粉样变性病的罕见疾病的患者身上开展试验。
实验结果显示,所有参与的 6 位患者的畸形蛋白质水平下降,也就是说,原本让他们出现疾病症状的异常的蛋白质越来越少,那么这种罕见病的症状就可能逐渐改善。其中,接受高剂量注射的两名患者平均下降了 87% 的蛋白质水平。
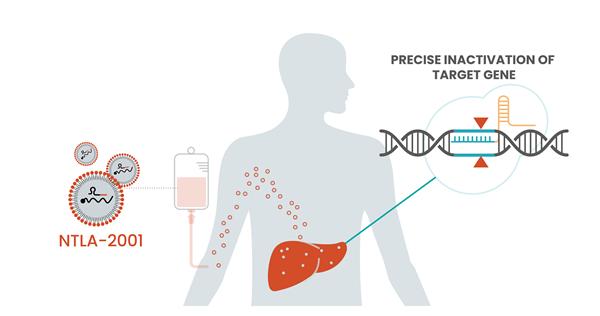
利用CRISPR 基因编辑治疗转甲状腺素淀粉样变性病示意图 | 图源:intelliatx.com
在另一项研究中,Editas Medicine 将一种携带 CRISPR DNA 的无害病毒注射到 6 名患有遗传性视力障碍疾病先天性黑蒙症(Leber’s congenital amaurosis, LCA)的成年人眼睛中。经过一段时间的治疗后,其中两名近乎失明的患者感觉到了更多的光线,有一人甚至能够在昏暗的光线下穿过障碍物。
CRISPR技术治疗视力障碍示意图
| 图源:editasmedicine.com
听起来确实充满希望,但是不少人会对基因编辑感到担忧,改变人体的遗传密码会不会像打开了潘多拉魔盒,从而带来很多不好的影响和风险?要打消疑虑,并弄清楚科学家和医药领域的研究人员是如何应对这一风险的,我们得从源头来了解一下基因本身。
我们人类的每个细胞都包括30亿个碱基,人类基因组里面大约3万个左右的基因,我们从一个受精卵细胞逐渐生长发育成为现在这样一个有鼻子有眼、有手有脚的人,还能说会道、能跑能跳,从基因到生命的结构和功能,这个过程是怎么实现的呢?
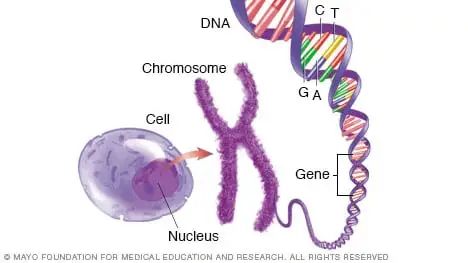
细胞中的基因 | 图源见水印
我们可以类比一下计算机的运作模式,当我们使用计算机的时候,利用键盘等输入工具发出指令,然后通过CPU等计算机的处理系统去执行这些指令,并通过在显示屏幕上的一些界面表现出我们发出的指令和我们想要的效果。而这些指令和记录会作为数据储存在硬盘里。
在某种程度上,生命的运作模式是类似的。由AGCT四种碱基的脱氧核糖核苷酸排列组合形成的不同的基因,以双链DNA的形式储存遗传信息,就相当于生命的”硬盘“。
这块硬盘里的信息会在特殊的“编译器”——RNA聚合酶的作用下,能够形成对应序列的RNA,也就相当于将基因从DNA这种适合存储信息的语言类型,转换成为RNA这种能够处理、解读、转化信息的形式。
有的RNA会直接参与到细胞中的一些结构或功能,还有一部分叫做信使RNA,也就是mRNA,会进一步指导翻译产生蛋白质,而这个蛋白质可能是一种酶,也可能是可以组成细胞结构的一部分,也有可能是一种作用在体外的激素等,用来起到不同的功能和作用,也形成了很多我们肉眼就能够看到的特征。这样不同的编译组合,就成功“编码”输出成我们看到的生命。
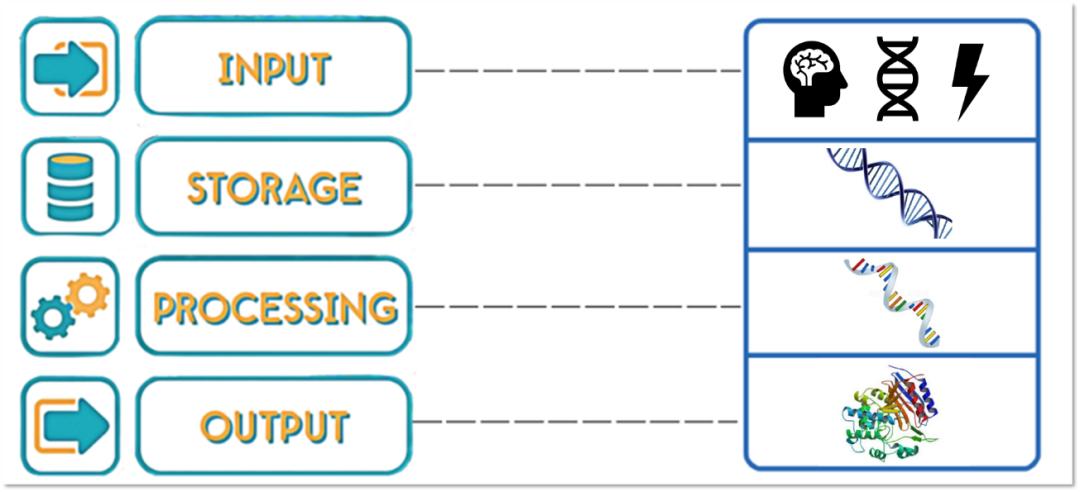
从输入(遗传或者外界刺激)到存储,再到编译、输出,基因的运转模式和计算机运作有异曲同工之妙
那么,为什么在很多科学家眼中,基因编辑领域是革命性、颠覆性的呢?
主要原因也可以用计算机来理解——我们开始能够像在计算机里写代码一样,在生命编码信息的最底层进行改动。就像微信、QQ等应用程序,背后是由“0”和“1”组成的二进制编码语言;生命同样如此,如果我们能更改ATCG的编码,就可以改写生命的“代码”,产生新的生命“程序”。
但最底层的遗传信息与生命的外在体现之间,包含着复杂且多变的调控途径,那么基因编辑想要达到我们认为的革命性和颠覆性,就需要具备两个基本的特质:
一是定位精准。以人类细胞为例,每一个细胞都包含着30亿碱基对的基因组,容易出现序列相似的片段,因此基因编辑最关键、也最难的,便是精准定位、确定目标;如果定位不精准,则只能称作“破坏”,而非“编辑”。
二是编辑。对基因序列的编辑就像修改一份 word 文档,包括插入、删除、以及替换等多种形式的改变都属于编辑。
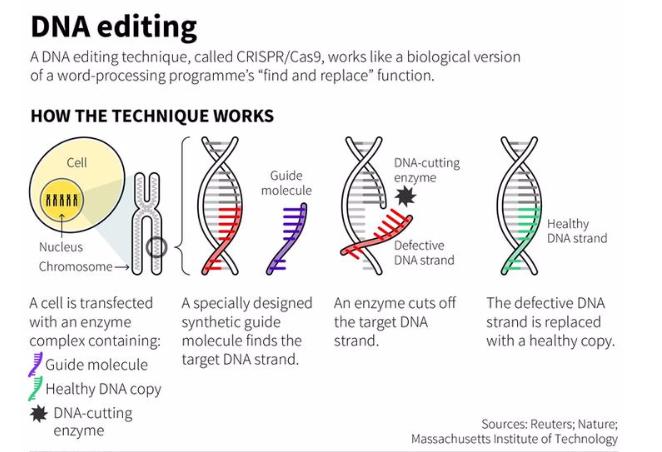
理想的基因编辑方法:使用定位分子(紫色)进行精确定位,再用特定的酶(黑色小团)进行编辑 | 图源见水印
具备了这两个特质以后,基因编辑最理想的状态便是“指哪打哪”,只在目标靶点处发生改变,基因组上的其他位置一动不动。但相似序列、非特异性结合等各种原因,使得这个想法只能停留在理想的状态,几乎难以实现。
基因编辑技术的不断革新,正是向着这个理想的状态不断迈进。
最早的基因编辑源自细胞本身对于自己DNA损伤时候的的一些修复机制。当时科学家利用归巢内切酶(HEs)在基因组的目标位点附近引入DNA双链断裂,激活细胞内同源重组途径(homologous recombination, HR)介导的修复过程,将两端带有同源臂,也就是与插入靶点上下游相同序列的片段的,外源DNA序列插入基因组,实现基因整合编辑的目的。
但DNA双链断裂之后的修复过程主要是非同源末端连接(non-homologous end joining, NHEJ),HR 发生的机率较低,便导致基因编辑的效率极低,且引入的外源 DNA 序列会随机整合到基因组其他位置,造成脱靶效应。
为了减少脱靶效应、提升效率,科学家通过人工改造,先后推出了两种基因编辑的方法:
1996年起,能够识别特异性DNA位点的锌指蛋白,和限制性内切酶的切割结构域被组装成为锌指核酸酶(ZFN),用以对目的位点进行准确地编辑。但针对不同的位点,需要对 ZFN 中的锌指蛋白进行重新设计,难度和成本太高;
转录激活因子效应物核酸酶(TALEN)同样包括DNA特异性识别区域(TALE)和用来切割DNA 的核酸酶。2009年 TALEN 的识别规则被探明以后,便被广泛用于基因编辑领域,2012年甚至被评为当年年度十大科学进展之一。可 TALEN 也存在缺点,组装过程过于复杂,使用的门槛较高。
向下滑动查看
但他们都存在组装过程复杂,或者是成本太高难度太大的缺点,这使得基因编辑技术没能推广开来。
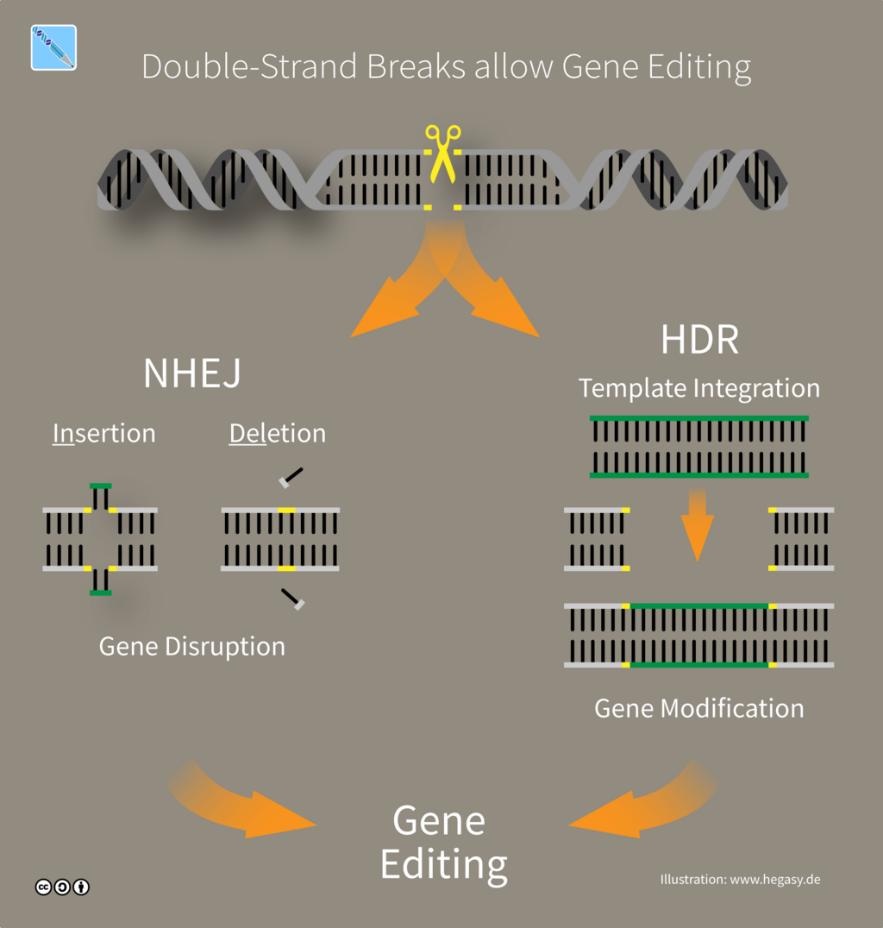
传统基因编辑技术流程示意图 | 图源:Wikipedia
与此同时,CRISPR这个神奇的技术也在不断酝酿、诞生:
1993年,CRISPR(clustered regularly interspaced palindromic repeats)第一次被发现。
2007年,Danisco 公司的Rodolphe Barrangou和Philippe Horvath发现了嗜热链球菌中存在 CRISPR 序列,能够帮助细菌识别、抵抗噬菌体DNA的侵入。原本是原核生物的免疫防御机制,帮助细菌在被病毒入侵时形成“记忆”,下次就能够识别外源DNA(即病毒),并进行剪切。
2011年,来自维也纳大学的艾曼纽·查彭蒂尔(Emmanuelle Charpentier)和 Jörg Vogel 找到了 CRISPR 系统基因编辑蓝图的最后一块拼图—— tracrRNA(trans-activating CRISPR RNA)。在 tracrRNA 的指导下,CRISPR-Cas 系统才能够定向剪切目标基因。
2012年到2013年初,三篇运用 CRISPR-Cas 9 系统进行基因编辑的论文先后发表在顶级科学期刊 Science 上,来自加州大学伯克利分校的詹妮弗以及来自维也纳大学的艾曼纽,证明了 CRISPR-Cas 9 系统在体外具备基因编辑的能力;而来自麻省理工学院博德研究所的张锋和来自哈佛大学医学院的 George Church,也分别成功将 CRISPR-Cas 9 系统运用到哺乳动物细胞中。
向下滑动查看
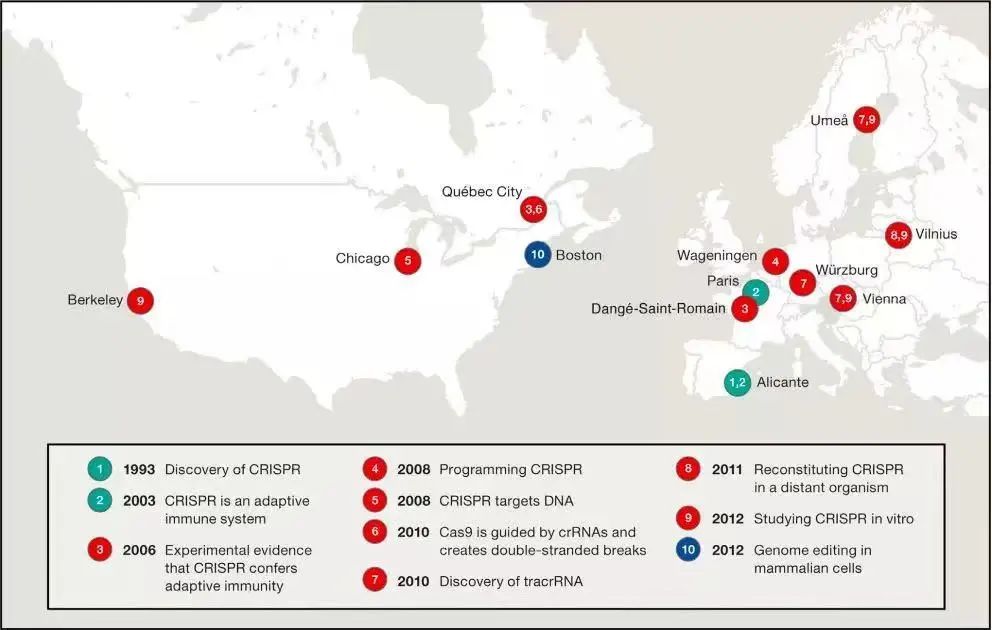
CRISPR技术在欧美的发现史
至此,成簇规律间隔短回文重复序列(CRISPR)系统的出现,彻底加速了基因编辑领域的发展。
经过这几位大牛,詹妮弗和艾曼纽以及张锋等人不断优化、改进;现在研究人员只需要根据目标基因的序列,设计一段几十个碱基长度的向导RNA,并将Cas9或其他Cas酶一并导入细胞中,就能够准确地对目标基因进行编辑。

CRISPR基因编辑技术的几位重要贡献者
CRISPR 不仅大大降低了操作难度和成本,还显著提升了精准度和适用范围(但脱靶效应等缺点还依旧存在,只是概率降低了不少)。目前已有Cas9,Cas12,Cas13,CasX等多种CRISPR/Cas系统,适用于不同的基因编辑场景和目的,也让基因编辑在从理论到临床的道路上更进一步。
就像在前面提到的,CRISPR技术已经在一些罕见病、遗传病领域初显成效,但在这个过程中,科学与伦理之间的平衡和界线仍旧至关重要。
目前公认的尺度是能够在体细胞中进行基因编辑,但禁止在人体精子或卵细胞这样的生殖细胞中进行;因为前者仅仅会影响你个人,而后者可能通过繁殖影响下一代,甚至改变更多人。而我们有权利决定自己,但没有权力影响下一代。更何况,即便目前我们对基因和生命科学有所了解,但是很大程度上还是不够全面,也很难去判断一个基因的好坏。
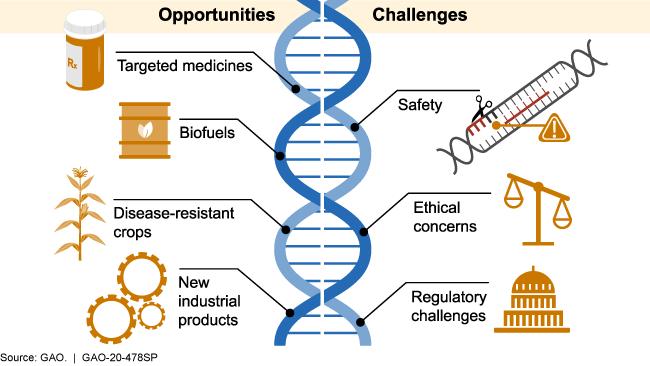
基因编辑技术的机遇与挑战 | 图源见水印
例如在去年年底的腾讯ConTech大会上,著名神经生物学家鲁白教授曾举过一个例子:
“
人体有一个名为脑源性神经营养因子(BDNF)的基因,因为其序列中一个碱基的差异,导致有V型和M型两种,分别在白色人种中占80%和20%。鲁白教授早先的研究表明,基因为M型BDNF的人在场景记忆方面比V型的人要差15-20%。但也正是在记忆上的差异,使得V型BDNF基因的人不容易记住坏事,患抑郁症的概率也更低。因此在不同的场景下,不同的基因类型各有千秋,我们没法武断地认为基因的好坏,也没有权力改变人种。
”
但在合适且合理的监管条件下,现阶段在体细胞上对于基因编辑技术的运用,确实是能够造福人类、缓解病痛的。
尤其是对于很多遗传病、罕见病,基因编辑疗法的开展和普及能够,让原本很多无药可医的疾病开始能够变得有药可医,让很多从小饱受病痛折磨的患者看到康复的曙光。
参考资料
Gillmore, Julian D., et al. "CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis." New England Journal of Medicine 385.6 (2021): 493-502.
Nxumalo, Zandile, Mutsa M. Takundwa, and Deepak B. Thimiri Govinda Raj. "Patents, ethics, biosafety and regulation using CRISPR technology." Progress in molecular biology and translational science 181 (2021): 345-365.
原标题:《基因编辑治疗的时代要来了吗?|2021科学突破》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




