- 3
- +1
清华彭敏团队:功能基因组学全局解析T细胞扩增调控网络
清华彭敏团队:功能基因组学全局解析T细胞扩增调控网络 | Cell Press对话科学家 原创 Cell Press CellPress细胞科学 收录于话题#Cell Press对话科学家 130 个内容 #Cell Reports 21 个内容

生命科学
Life science
2021年12月7日,清华大学医学院/清华大学免疫学研究所彭敏课题组在Cell Press细胞出版社期刊Cell Reports发表研究论文。该研究使用体外/体内CRISPR筛选技术,在全基因组水平系统性地鉴定了调控CD8 T细胞扩增的基因,并揭示了Roquin-IRF4轴在T细胞扩增和肿瘤免疫治疗中的重要作用。
T淋巴细胞在抗感染和抗肿瘤等方面发挥关键作用。识别特定抗原表位的初始T细胞数量极少,激活后需要克隆性增殖达到足够数量才能有效清除靶细胞。基因组中有多少基因参与T细胞扩增尚不清楚。系统性研究T细胞扩增的调控机制,可以加深我们对这一复杂生命现象的理解,有助于发现免疫治疗的新靶点。
基于CRISPR/Cas9的高通量筛选近几年里发展迅速,但原代细胞体内全基因组水平筛选仍具有很大挑战性。为系统性鉴定T细胞扩增调控基因,彭敏课题组建立了T细胞全基因组CRISPR小鼠体内筛选系统,并平行比较了体内和体外全基因组筛选的敏感性和效能差异(图1A)。作者发现了很多新的T细胞扩增必需基因,包括生物学功能未知基因1110004E09Rik和Gm10406等。通过比较体内和体外筛选结果,作者还揭示了CD8 T细胞在体内环境中扩增特异的必需基因,其中部分富集在能量代谢调控途径(图1B)。
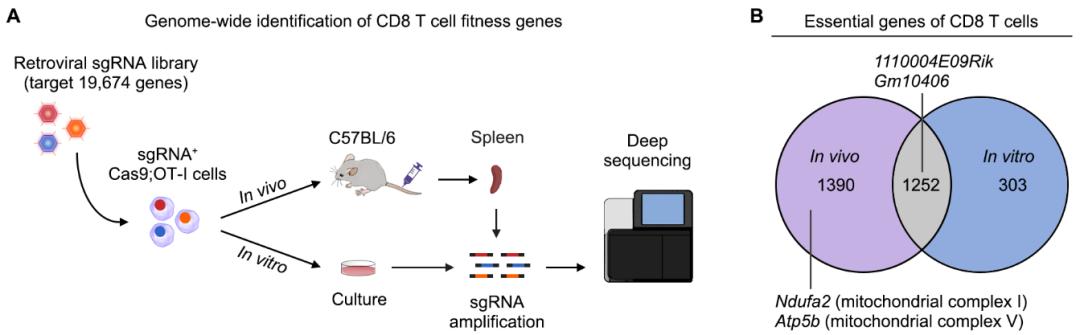
图1. 体外/体内CRISPR筛选鉴定基因组中调控T细胞扩增的基因。
(A) CRISPR筛选策略示意图。(B) 体外/体内筛选鉴定出CD8 T细胞必需基因的数量。
接下来,作者以Rc3h1为例,研究了抑制CD8 T细胞扩增的基因(图2A和2B)。Rc3h1编码Roquin,该蛋白质是RNA结合蛋白,参与调控炎症,但在CD8 T细胞中的功能不清楚。敲除Roquin大幅度提升CD8 T细胞的增殖能力(图2C-2E),对肿瘤的治疗效果显著增强(图2F-2H)。
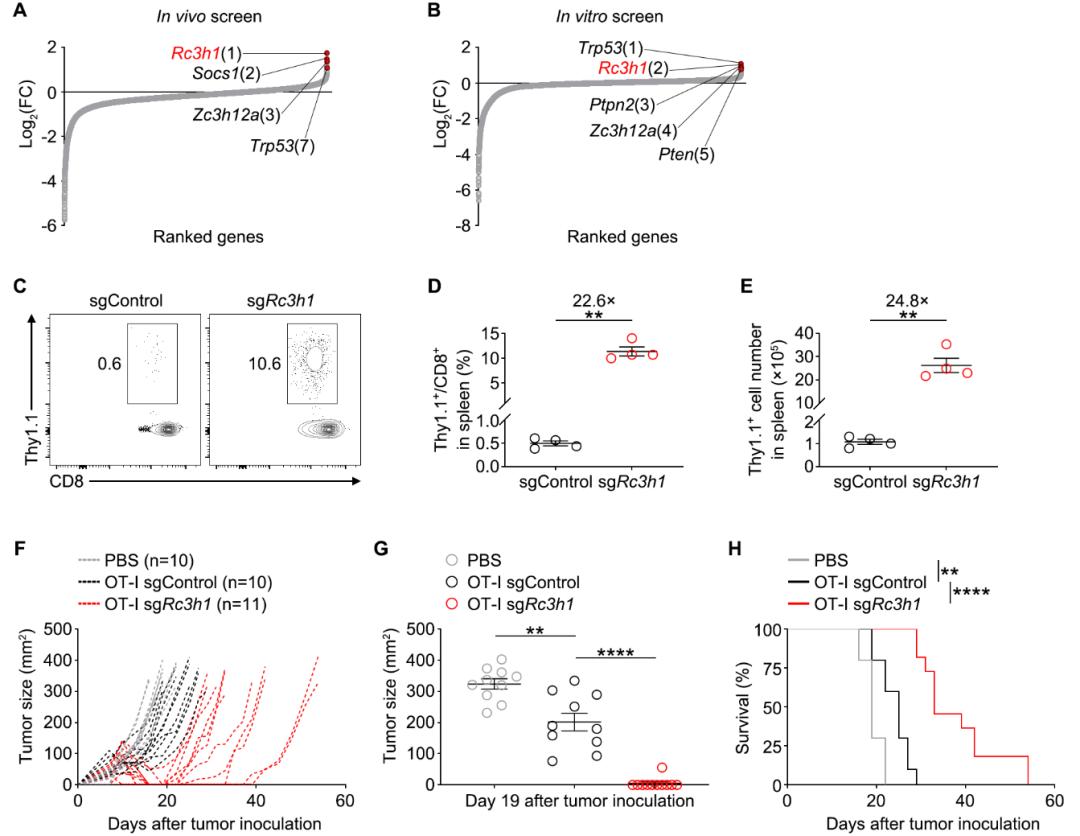
图2. Roquin缺失显著增强CD8 T细胞的增殖能力和肿瘤治疗效果。
(A和B) 图示基于sgRNA富集程度,体内(A)和体外(B)筛选结果中所有基因的排序。(C-E) 过继性转移后受体小鼠脾脏中T细胞比例及数量。(F-H) EL4-OVA肿瘤模型。
在机制方面,通过转录组分析发现Irf4是Roquin下游的一个关键功能性靶mRNA。在Roquin缺失的CD8 T细胞中,Irf4转录和翻译水平均增加,同时敲除IRF4能将Roquin缺失引起的增殖促进作用恢复至野生型水平。过表达IRF4也能够促进CD8 T细胞增殖,并增强抗肿瘤效果。
综上,彭敏课题组在原代CD8 T细胞中建立了全基因组水平的体内、体外CRISPR筛选体系,为领域提供了T细胞扩增必需基因参考目录。作者还证明了CD8 T细胞的增殖抑制因子Roquin及其下游IRF4作为癌症治疗靶点的可能性,为肿瘤免疫治疗供了新靶点。
清华大学医学院博士生赵翰飞为本文第一作者,博士生刘莹对本研究也做出了重要贡献。本研究获得了国家自然科学基金委、清华-北大生命科学中心以及清华大学免疫学研究所的支持。
作者专访
Cell Press细胞出版社特别邀请论文作者彭敏进行了专访,请他为大家进一步详细解读。
CellPress:
克隆扩增是适应性免疫的典型特征,CD8 T细胞在对抗感染和癌症中起着核心作用。请问,目前T细胞的全基因组CRISPR筛选存在哪些挑战?本研究又是如何解决的?
彭敏研究员:
目前T细胞CRISPR筛选面临的挑战主要包括以下几个方面:一是覆盖度问题,过继细胞回输的效率较低,存在细胞随机丢失现象,导致T细胞体内CRISPR筛选主要是用小规模文库进行正向筛选(即细胞富集),对于丢失的细胞,无法区分是基因编辑导致细胞丢失还是随机丢失,因此不能有效筛选出正向调控T细胞扩增的基因;二是体内和体外环境差异问题,尤其是代谢环境(如营养成分等)很难在体外模拟;三是体内筛选的宿主选择问题,免疫缺陷小鼠更容易扩增T细胞,但是与正常小鼠的免疫环境有较大差异。本研究在文库选择,细胞培养,感染,细胞回输和细胞回收方面进行了大量的优化,最终完成了高可信度的CD8 T细胞扩增调控基因的全基因组鉴定,弥补了领域内的空白。
CellPress:
请问CD8 T细胞在体内和体外的扩增有何差异?
彭敏研究员:
对于小鼠CD8 T细胞来说,其在体外的扩增程度和存活时间显著低于体内,原因尚不完全清楚。本研究表明,CD8 T细胞在体内和体外扩增所涉及的基因有很大差异,尤其是必需基因,有些基因是体内扩增必需的,而体外扩增则非必需,反之亦然。
CellPress:
请问体内特异性CD8 T细胞必需基因的富集有何特点?
彭敏研究员:
这是本研究的特点之一,我们平行比较了CD8 T细胞在体内和体外扩增的必需基因,发现有1300多个基因对于CD8 T细胞体内扩增是必需的,但这些基因却不参与CD8 T细胞在体外的扩增,表明体外筛选会漏掉很多重要基因。这些基因中少数是介导免疫识别的,比如MHC-I缺失导致T细胞成为NK细胞的靶细胞(missing-self-mediated killing)。一部分CD8 T细胞体内特异性必需基因富集在能量代谢通路(如线粒体呼吸链组分),表明线粒体代谢对于CD8 T细胞体内扩增是必需的,但在体外扩增中可以被糖酵解部分替代。这也纠正了领域内之前的体外研究结论:即T细胞可以使用线粒体或糖酵解这两种能量代谢途径中的任意一种进行扩增,我们的结论表明CD8 T细胞体必须同时使用线粒体和糖酵解才能在体内有效扩增。除此以外,还有大部分CD8 T细胞体内特异性必需基因的生理功能尚不清楚,需要进一步研究。
CellPress:
请问Roquin-IRF4轴是如何调控T细胞扩增和抗肿瘤免疫的?
彭敏研究员:
T细胞在体内数目的累积主要由细胞增殖和凋亡之间的平衡决定,Roquin缺失和IRF4过表达主要调控T细胞增殖。有趣的是,Roquin调控很多参与DNA复制的基因,表明DNA复制速度可能是限制T细胞增殖的因素之一,这是之前领域内研究较少的。需要强调的是,目前大部分T细胞治疗都需要对小鼠或患者进行化疗药物处理或辐照对(预处理),这样输入的T细胞才能有效扩增。我们的研究表明,Roquin缺失或IRF4过表达能够使得CD8T细胞在非预处理条件下有效扩增,达到对肿瘤良好的治疗效果,为T细胞治疗开辟了新思路。
CellPress:
是否有已知的抑制剂或有潜力的小分子药物可用于针对于Roquin的免疫治疗?
彭敏研究员:
据我所知,Roquin目前还没有小分子抑制剂,这是将来研究的方向之一。
CellPress:
请问本研究的成果为揭示CD8 T细胞扩增的机制提供了怎样的帮助?
彭敏研究员:
克隆性增殖是适应性免疫应答的核心特征,基因组中有多少基因参与该过程是一个基本的免疫学问题。由于技术条件的限制,T细胞领域严重依赖条件性敲除小鼠来逐个研究单一基因(或少数几个基因)的功能,耗时耗力耗资源。本研究通过全基因组CRISPR筛选,系统性地鉴定了小鼠基因组中所有蛋白编码基因在CD8 T细胞扩增中的作用,具有奠基性质,为将来逐个基因深入研究打下基础。需要指出的是,本研究中T细胞增殖是在没有炎症的条件下发生的,比较符合细胞治疗的情境, 但在感染条件下发生的T细胞克隆性增殖是否也受相同的基因调控,需要进一步研究来证实。
CellPress:
Roquin-IRF4轴在抗肿瘤免疫中发挥关键作用,请问这能够为提高肿瘤过继转移治疗的疗效提供怎样的指导?
彭敏研究员:
前面提到,目前几乎所有T细胞治疗(包括CAR-T)都需要对患者进行常规的化疗药物预处理(环磷酰胺和/或氟达拉滨),该处理具有毒副作用,并不是所有患者都耐受。本研究表明Roquin缺失或IRF4过表达可以在不需要预处理的条件下进行有效的T细胞治疗,为领域提供了新的思路。此外,目前临床上T细胞产品在输入患者之前需要较长时间的扩增(1-3周不等),以获得足够数目的细胞,而本研究中使用的T细胞均在激活后2-3天内回输到小鼠体内,极大缩短了时间,有利于大幅度降低成本,并缩短患者的等待时间。
作者介绍

彭敏
研究员
彭敏,清华大学医学院助理教授,清华大学免疫学研究所/清华-北大生命科学中心研究员。我们实验室利用功能基因组学手段系统性研究T细胞增殖,分化, 记忆和耗竭的调控机制,并利用这些机制为免疫相关疾病的治疗提供新策略和新靶点。欢迎对T细胞和免疫治疗感兴趣的学生和博士后加入我们。
Email: pengmin@tsinghua.edu.cn
https://www.med.tsinghua.edu.cn/info/1350/1426.htm
http://www.iitu.tsinghua.edu.cn/show/faculty/181.html

赵翰飞
博士
赵翰飞,清华大学医学院博士研究生。博士期间建立了原代T细胞全基因组CRISPR筛选体系,并利用该体系鉴定T细胞增殖调控基因和发现免疫治疗新靶点。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Cell Reports上,点击“阅读原文”查看论文
▌论文标题:
Genome-wide fitness gene identification reveals Roquin as a potent suppressor of CD8 T cell expansion and anti-tumor immunity
▌论文网址:
https://www.cell.com/cell-reports/fulltext/S2211-1247(21)01574-6
▌DOI:
https://doi.org/10.1016/j.celrep.2021.110083
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
CellPress细胞出版社
原标题:《清华彭敏团队:功能基因组学全局解析T细胞扩增调控网络 | Cell Press对话科学家》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。



- 中方出手连环反制
- 中方连环反制,美指期货应声下跌
- 10位在韩志愿军烈士寻亲线索公布

- 乌外长:乌克兰代表团即将访美,就矿产协议进行磋商
- 多个美股热门中概股盘前跌幅扩大至10%

- 京剧伴奏乐器中的主要弦乐器,又名胡琴的是
- 连接地中海与红海,属于亚非分界线一部分的人工水道是

- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司










