- +1
DRG神经元机械敏感特性相关的单细胞表达谱绘制

生命科学
Life science
作为躯体感受门户细胞的背根神经节(DRG)神经元,其表达的特定离子通道掌管了诸多感觉信息的输入和编码,包括温度、机械力、痒等,其中TRPV1作为首个温度敏感通道在1997年被鉴定到,PIEZO2作为介导轻触觉和本体感觉的机械敏感通道在2010年被鉴定,这些年以来对TRPV1和PIEZO等分子的结构和功能的全面研究也直接锁定了2021年的诺贝尔生理学或医学奖,体现人们对介导机械感受的分子的关注。然而,DRG神经元的机械敏感性表现出多样性,通过电流失活动力学的分析主要表现出3种不同的速度:快速相(rapidly adapting, RA),中速相 (intermediately adapting, IA),以及慢速或超慢速相(SA/ultra SA)。目前确定PIEZO2是RA电流的目标通道,而IA和SA电流的介导通道分子并不清楚。最近艾克斯-马赛大学的Bertrand Coste教授团队利用膜片钳测序(Patch-seq),为具备不同机械敏感电流动力学的DRG神经元的转录谱做了单细胞尺度的聚类分析,为领域内研究者提供了一个实用的转录组学数据集,该工作2021年11月2日发表于Cell Press旗下期刊Cell Reports上。
长按图片扫描二维码阅读论文
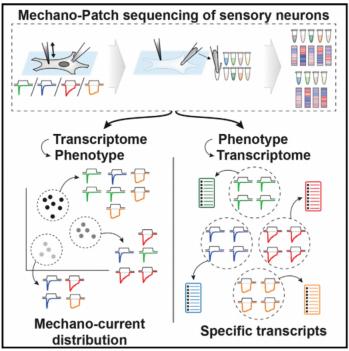
图1 本文研究策略示意图
为了研究DRG神经元这些不同机械敏感动力学表现的分子机制, 作者通过全细胞膜片钳电生理鉴定DRG神经元的机械敏感电流动力学后,再用电极收集细胞,从而进一步获取该细胞的单细胞转录组学数据,这样将机械敏感电流的动力学和基因转录谱对应起来,并根据它们的电流动力学将这些细胞分类,同时测量单细胞的转录组学。作者成功为62个经过电生理记录分型的DRG神经元建立单细胞cDNA库,而它们的电流动力学可以全面覆盖这3种机械敏感特性,最终获得53个适于做单细胞RNA测序分析的DRG神经元,值得一提的是这些细胞的patch-seq基因测序覆盖率为13,359±1,478。

图2 DRG神经元的单细胞机械敏感电流特性和转录组特征的对应分析
根据基因表达谱可以将这些鉴定了机械敏感电流动力学的DRG神经元分为7个功能性的细胞群,高度一致的映射到之前的一篇报道的来自于1580个单细胞RNAseq的数据。这些细胞可以根据聚类情况分为NF(对应到低阈值机械受体LTMR),NP1(与多模态痛敏相关)、NP2和NP3(和痒觉相关)、PEP1(C类温觉痛敏相关)、PEP2(轻度髓鞘化Aδ痛敏受体)、TH(C类低阈值机械受体)。对该数据集的表达谱分析可以看到一些经典的DRG神经元标志性基因以及温觉和痒觉相关的基因,体现出本工作patch-seq数据集的可信的整体质量。
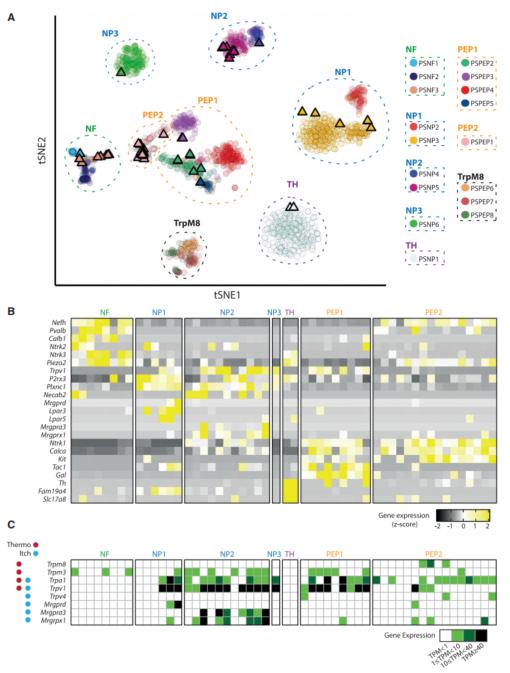
图3 DRG神经元的转录组聚类分析
同时一些经典公认的和新晋报道的机械敏感通道编码基因也在该数据集里有明显表达。
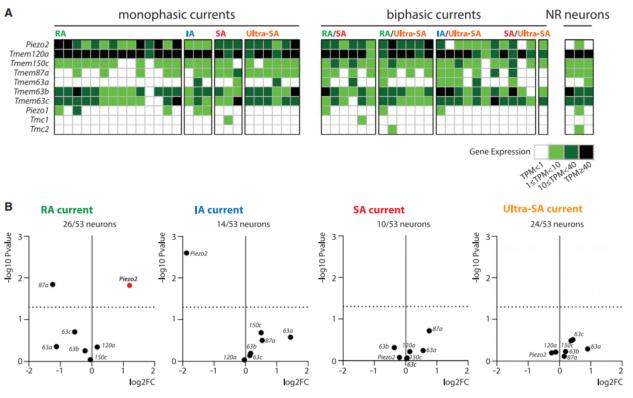
图4 已知或者预测机械敏感通道基因在该数据集的表达
最终,作者还在该数据集中分析了两个最近报道的机械敏感通道通道候选基因TACAN (Tmem120a)和Tentonin-3 (Tmem150c)对应机械敏感电流特性DRG神经元类型的表达情况。两者表达水平在所有的细胞中相当均匀,也就是说并不和机械敏感电流动力学的差异相关。进一步的在DRG神经元上的RNAi敲低实验显示这两个基因的沉默并不显著影响任何类型机械敏感电流的大小。作者的数据和近期一些其他研究组的报道一起显示Tmem120a和Tmem150c可能并非DRG神经元上负责IA和SA机械敏感电流的分子。
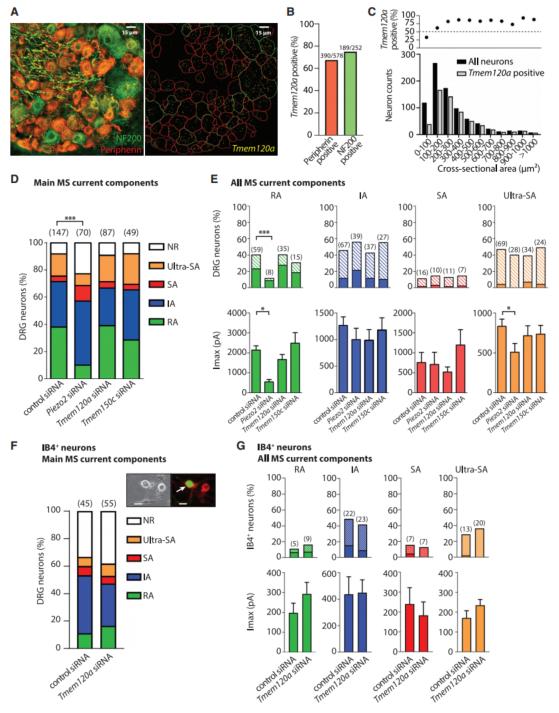
图5 Tmem120a和Tmem150c不参与DRG的机械敏感电流
总结起来,本工作利用Patch-seq技术,为DRG神经元的机械敏感电流动力学特性做了单细胞尺度的转录谱注解,为领域内研究者提供了一个DRG神经元机械敏感通道的备选基因研究的开放数据集。
论文摘要
多种机械感觉神经元参与触摸、本体感觉和疼痛等躯体感觉,然而支持这些感觉模式的机械转导蛋白机器的分子成分仍有待发现。在这篇论文里,我们将机械感觉神经元的机械敏感(MS)电流记录与单细胞RNA测序结合起来:转录谱被映射到先前确定的感觉神经元类型上,以识别转录数据集与细胞类型的相关性。机械敏感电流特征与单细胞转录组的相关性提供了力学特性和转录组定义的神经元群体之间的一对一对应关系。此外,基因表达差异比较为机械转导复合物提供了一组候选基因。和预期相符,Piezo2基因被发现在快适应MS电流表达神经元中富集;而被认为介导慢适应MS电流的Tmem120a和Tmem150c基因,在所有机械感觉神经元亚型中都均匀表达,进一步的基因敲除实验排除了这两个基因参与介导感觉神经元中的MS电流的可能性。该数据集也为进一步探索机械感觉细胞的类型特异性的决定因素提供了一个开放资源。
A variety of mechanosensory neurons are involved in touch, proprioception, and pain. Many molecular components of the mechanotransduction machinery subserving these sensory modalities remain to be discovered. Here, we combine recordings of mechanosensitive (MS) currents in mechanosensory neurons with single-cell RNA sequencing. Transcriptional profiles are mapped onto previously identified sensory neuron types to identify cell-type correlates between datasets. Correlation of current signatures with single-cell transcriptomes provides a one-to-one correspondence between mechanoelectric properties and transcriptomically defined neuronal populations. Moreover, a gene-expression differential comparison provides a set of candidate genes for mechanotransduction complexes. Piezo2 is expectedly found to be enriched in rapidly adapting MS current-expressing neurons, whereas Tmem120a and Tmem150c, thought to mediate slow- type MS currents, are uniformly expressed in all mechanosensory neuron subtypes. Further knockdown experiments disqualify them as mediating MS currents in sensory neurons. This dataset constitutes an open resource to explore further the cell-type-specific determinants of mechanosensory properties.
向下滑动阅览摘要原文
中文内容仅供参考,请以英文原文为准
述评人简介

熊 巍
清华大学生命科学学院研究员
E-mail:wei_xiong@tsinghua.edu.cn
清华大学生命科学学院研究员和博士生导师,清华大学IDG/麦戈文脑研究院研究员。熊巍实验室主要运用小鼠遗传学、分子和细胞生物学、光学成像以及电生理手段,研究听觉系统正常工作以及听觉异常的生物学机制,相关工作以通讯作者身份发表于Nat Protoc., eLife, PNAS等学术期刊。
Dr. Wei Xiong is a Principal Investigator in School of Life Sciences and IDG/McGovern Institute for Brain Research at Tsinghua University. Xiong laboratory mainly use mouse genetics, molecular and cellular biology, optical imaging and electrophysiology to study mechanisms underlying normal hearing and deafness. Dr. Xiong has recently published researches from his laboratory in Journals including Nat. Protoc., eLife, and PNAS.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




