- +1
周大旺/陈兰芬团队探索糖原相分离驱动肝脏肿瘤起始新机制
厦大周大旺/陈兰芬团队探索糖原相分离驱动肝脏肿瘤起始新机制 | Cell Press对话科学家 原创 Cell Press CellPress细胞科学 收录于话题#Cell Press对话科学家 118 个内容 #Cell 61 个内容

生命科学
Life science
2021年10月21日,厦门大学生命科学学院周大旺和陈兰芬课题组合作在Cell Press旗下期刊Cell上发表了题为“Glycogen accumulation and phase separation drives liver tumor initiation”的研究论文。该研究发现肝癌病变的早期病灶及早期肿瘤中都有明显的糖原(glycogen)累积现象(图一),展示了早期癌变起始中的癌细胞汲取葡萄糖后,可能更多是以糖原储能的方式在胞内存储起来而非以无氧糖酵解形式代谢分解葡萄糖供能于细胞的增殖,而过度积累的糖原能够通过液-液相分离抑制Hippo信号通路的活性,从而驱动肿瘤的发生发展。
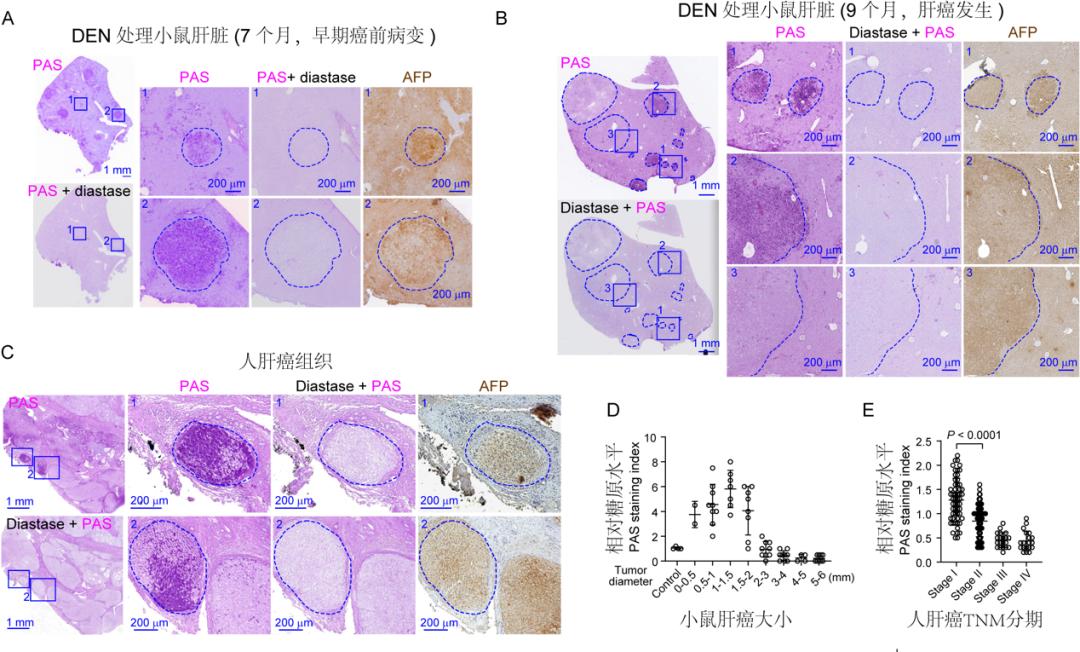
图一:肝脏早期肿瘤病灶及小肿瘤中糖原过度累积
如何诊治癌症一直是生命医学领域内重大的科学问题之一。由于恶性肿瘤发生初期并无明显症状,大部分的患者在就诊时已经处于癌症晚期,这为肿瘤的防治带来了极大的困难,因此,完善肿瘤的早期筛查手段,发现与鉴定癌症早期事件具有重大的科学与临床意义。糖原是葡萄糖在哺乳动物细胞内的主要储存形式,由大量的单糖分子聚合而成,是细胞内最大的可溶性分子之一。一般认为,肿瘤细胞的过度增殖需要大量的能量供给,葡萄糖作为最重要的能量来源会被癌细胞快速消耗。很有趣,本工作发现肝癌发生早期普遍存在着糖原的过度积累的现象,与传统肿瘤代谢认知截然相反。作者通过多种手段消除肝癌早期累积的糖原,发现可以明显削弱肝脏细胞增殖和肿瘤发生。在临床上,糖代谢酶如G6PC(葡萄糖-6-磷酸酶),PYGL(肝糖原磷酸化酶)等基因失活突变会造成患者糖原累积症的发生并诱发肝肿大和后期肝癌的发生,但导致这些临床症状的分子机理仍不清楚。本研究发现累积的糖原会发生液-液相分离(liquid-liquid phase separation),抑制Hippo信号通路活性,导致其下游效应因子YAP激活,驱动肿瘤的起始(图二)。本团队前期研究发现,Hippo信号通路的失活会导致肝细胞快速的增殖,脱分化以及肝癌的发生。临床上多种肿瘤发生发展中往往伴随着抑制细胞癌变的Hippo通路的失活,但基因测序却很少发现Hippo信号通路本身的突变,失活的具体机制仍不清楚。该工作的发现也有望揭示肿瘤发生中抑制细胞癌变的Hippo通路如何失活之谜。
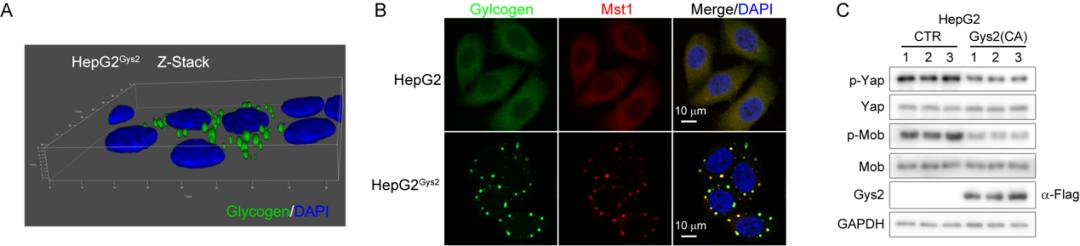
图二:累积的糖原发生液-液相分离抑制Hippo信号通路活性
综上所述,这项工作发现早期肝脏肿瘤细胞通过将汲取的葡萄糖合成糖原作为能量存储,并通过液-液相分离抑制Hippo信号通路的活性,从而驱动肿瘤的发生发展(图三)。本工作表明糖原过度累积可以作为肝癌早期筛查与诊断的重要依据,研究阐释了临床中糖原累积导致肝肿大与肝癌的致病机理,以及多类肿瘤细胞在应激条件下出现糖原累积的现象可能是肿瘤细胞潜在应激生存的耐药机制,为肿瘤治疗提供新思路。
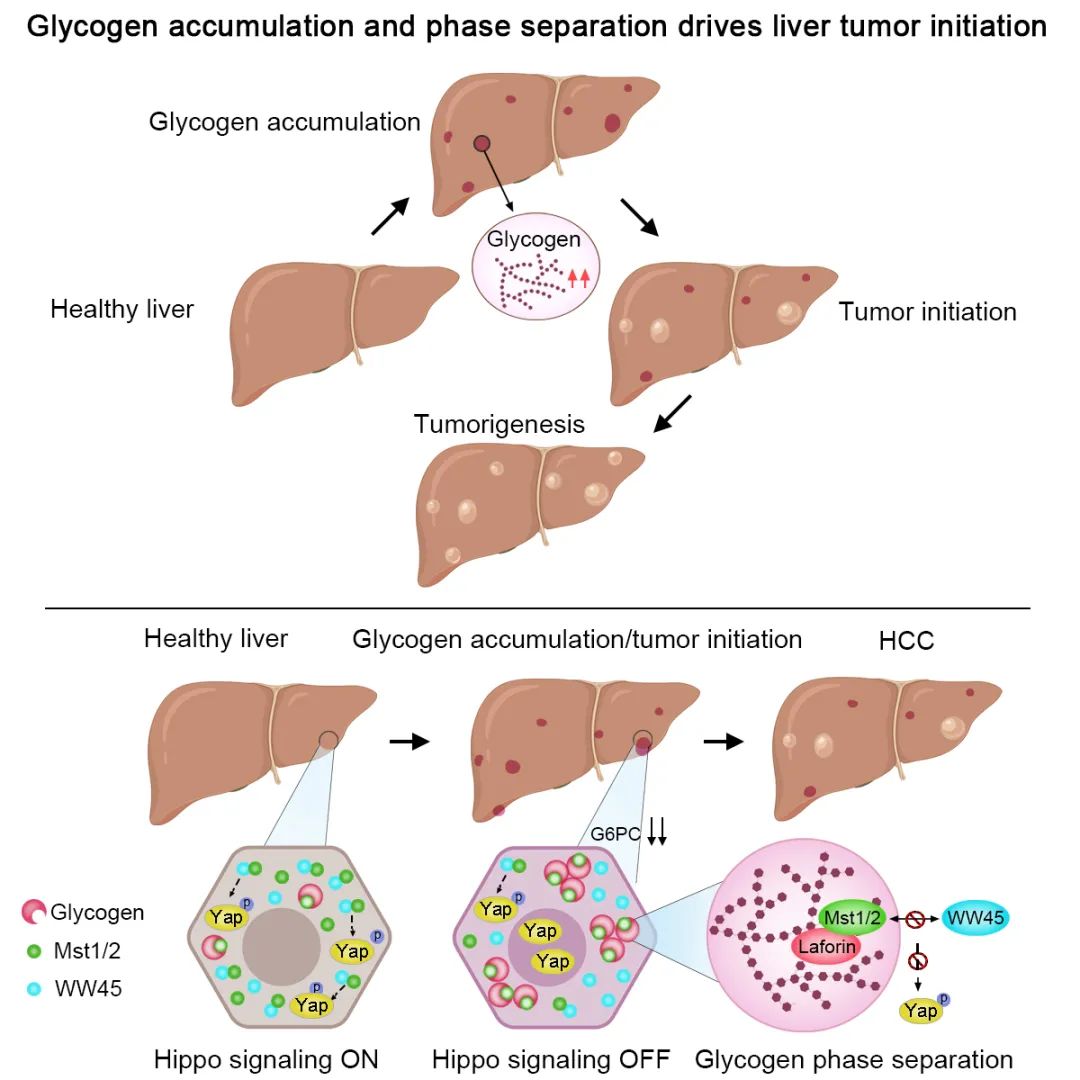
图三:糖原累积和相分离驱动肝脏肿瘤的发生和发展
作者专访
Cell Press细胞出版社公众号特别邀请论文作者周大旺教授接受了专访,请他围绕该研究进行进一步详细解读。
CellPress:
糖原被认为是葡萄糖的主要储存形式,其代谢出现异常与多种疾病相关联,但是为何在肿瘤发生中糖原代谢的功能尚未受到足够重视?为何其在癌症发生中的功能难以确定?
周大旺教授:
糖原是细胞内的可溶性大分子,主要作为葡萄糖的一种贮备形式广泛存在于肝细胞和骨骼肌细胞中。长期以来,人们主要聚焦于糖原的营养能量储存功能,用于维持血糖水平和满足肌肉本身的能量需求。目前肿瘤研究主要聚焦于肿瘤晚期,肿瘤细胞已经完成了瓦博格效应代谢模式的转变,晚期肿瘤更多是糖原消耗模式。因此糖原代谢的功能一直处于被忽视的地位。肿瘤的发病机制复杂且缺乏有效的肿瘤早期诊断标志物,对早期肿瘤如何演变为恶性肿瘤的过程知之甚少,使得分析早期肿瘤细胞的代谢模式以及寻找潜在的分子机制都具有很大的挑战性。
CellPress:
在癌症起始阶段,糖原积累与肿瘤发生速度存在怎样的关系?
周大旺教授:
我们在多种小鼠肝癌模型和人类肝脏肿瘤样品中发现,在肝脏肿瘤的早期阶段,普遍存在糖原累积的现象,并且随着肿瘤发展的进程,累积的糖原不断地被消耗。累积的糖原有利于肿瘤的生存并加速肿瘤的起始,在小鼠自发肝癌DEN模型或KrasG12D突变背景下使糖原累积都可以加快肿瘤发生的速度,而当利用CRISPR/Cas9调除Gys2 (Glycogen Synthase 2, Liver) 或者化学药物VPA降低细胞内糖原的含量都可以有效地缓解肿瘤的发生。
CellPress:
G6PC在癌症起始细胞中的表达是如何被调控的?
周大旺教授:
我们通过显微切割结合RNA-Seq测序对肝脏早期肿瘤的糖原累积区域的细胞进行分析发现,在糖原累积的细胞中,与糖原分解代谢相关的G6pc是普遍显著下调的。Nehrbass等人曾报道G6pc的水平受到Insulin/Akt信号通路的调控,我们通过原位免疫组化在多种小鼠肝癌模型中染色发现,肝脏早期肿瘤的糖原累积区域的细胞中,G6pc水平显著下调,p-Akt水平显著上升,显示G6pc的下降可能是受Akt调节的,但是具体调控机制并不明了。未来需要更多工作来充分地探寻肿瘤进展过程中这种代谢转换的分子基础和潜在机制。
CellPress:
积累的糖原是如何通过相分离来调控Hippo信号的?
周大旺教授:
高浓度的糖原在体内和体外条件下都可以自发地形成液-液相分离。由于糖原结合蛋白Laforin可以与Mst1/2激酶分子相互作用,导致Mst1/2随着Laforin一起被被包裹在发生相分离的糖原液滴中,物理阻断了Mst1/2与细胞浆中下游底物的相互作用,无法磷酸化和抑制Hippo信号通路的下游效应分子Yap,导致Yap进入细胞核发挥转录共激活活性,进而促进细胞增殖和肿瘤的发生发展。
CellPress:
本研究表明糖原积累的消除可以抑制癌症的发病率,那么您和您的团队下一步的研究重点将会是什么?
周大旺教授:
在这项工作中,我们发现糖原积累现象普遍存在于人和小鼠肝脏肿瘤的早期阶段,并且对于肿瘤的起始发生发挥重要作用。糖原积累现象是否发生在那些通常不储存糖原组织的致癌转化过程中以及是否会促进这些组织癌变发生仍然值得探索。下一步研究我们可能会探索其他组织肿瘤早期阶段是否会发生糖原积累的现象并寻找导致糖原累积发生的潜在机制。目前,由于没有可用的表面生物标志物来标记和分离这些早期肿瘤细胞,使得分析这群细胞的代谢模式具有很大的挑战性,因此开发糖原监测探针以及其是否可以做为早期肿瘤标记也将是我们的一个探索方向。

作者介绍

周大旺
教授
周大旺,厦门大学生命科学学院教授、教育部长江学者特聘教授,荣获中国细胞生物学会普洛麦格创新奖,主持基金委创新研究群体、国家杰出青年科学基金等项目。长期从事Hippo信号通路的生物学功能和调控机制研究,探究其失控导致肝脏等器官的再生重塑障碍、癌症发生的致病机理和靶向干预的策略。以通讯作者在Cancer Cell、Nature Immunology、Science Translational Medicine、Development Cell、J Exp Med等国际杂志上发表多篇论文,多篇入选封面文章。筛选获得了靶向Hippo蛋白激酶Mst1/2的小分子抑制剂(XMU-MP-1), 该小分子可有效促进肝脏和肠道的修复与再生, 药物专利已成功转让。

陈兰芬
教授
陈兰芬,厦门大学生命科学学院教授、福建省闽江学者特聘教授,荣获中国青年女科学家奖,主持承担国家杰出青年科学基金等项目。课题组工作聚焦于自身免疫疾病发生、天然免疫宿主防御与肿瘤炎症微环境重塑等方面的致病机理研究,为免疫相关疾病的诊治提供了重要靶点和科学依据。以通讯作者在Nature Immunology、Cancer Cell、Nature Comminutions、Cell Reports、 J Immunol等国际杂志上发表多篇研究论文,研究成果被NatureReviews的多个综述刊物进行专题评论。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Cell上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Glycogen accumulation and phase separation drives liver tumor initiation
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(21)01175-2
▌DOI:
https://doi.org/10.1016/j.cell.2021.10.001
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




