- +1
CR:一文搞懂心力衰竭的能量代谢改变,以及潜在的治疗靶点
原创 奇点糕 奇点网

心力衰竭真的是一个“狠角色”。高致残、高致死是它的主要特点。
我国最新的《中国心血管健康与疾病报告》指出,我国心血管病患病人数达3.3亿,其中心力衰竭患病人数就有890万,这个疾病的5年死亡率甚至超过了50%,真是可怕.JPG.
心力衰竭主要分为两种类型,一种是射血分数降低型心力衰竭(HFrEF),一种是射血分数保留型心力衰竭(HFpEF),两种类型的心力衰竭及其合并症的发生率是相当的。缺血性心肌病和高血压是心力衰竭的主要病因。
能量代谢改变是心脏衰竭的重要特征,优化心肌能量代谢是治疗心力衰竭的重要手段之一。

那什么是能量代谢呢?它是人体分解葡萄糖、脂类、蛋白质等营养物质,产生三磷酸腺苷(ATP)的全过程。
如果心肌的能量代谢出现异常,那么心脏就可能出现结构和功能的变化,比如:心率改变,心脏收缩及舒张功能异常,甚至出现心肌肥大、凋亡与坏死等。因此阐明心力衰竭患者心肌的能量代谢改变,将为临床心力衰竭治疗提供潜在的药物作用靶点,具有重要意义。
前不久,来自心脏代谢领域的大牛,世界顶尖大学加拿大阿尔伯塔大学的Gary D. Lopaschuk教授、华盛顿大学的田蓉教授等,在Circulation Research发表了综述性文章,为我们系统性的介绍了正常心肌的能量代谢,心力衰竭心肌的能量代谢改变、心肌能量代谢领域研究的困境,以及靶向能量代谢治疗心力衰竭的可能策略。

首页截图
接下来我就带着大家一起学习大牛们的这篇力作。
正常心肌的能量代谢
首先,咱们一起来看看正常心肌的能量代谢。
成人心肌细胞主要通过线粒体氧化磷酸化和糖酵解产生能量,而线粒体氧化磷酸化的能量供应占比高达约95%,糖酵解的能量供应占比仅约5%。心肌能量代谢消耗的底物包括脂肪酸、乳酸、葡萄糖、酮体、氨基酸,其中约40%-60%的产能来源于脂肪酸氧化。
脂肪酸氧化对心肌的重要性可见一斑。
心脏里的脂肪酸主要以两种形式存在,一种是与血液中的白蛋白结合的脂肪酸,另一种是由乳糜微粒和极低密度脂蛋白(VLDL)中所含的三酰基甘油水解的脂肪酸。
在众多能量底物中,脂肪酸是产能最高的能量底物,但也是氧耗最大的能量底物,所以被判定为效率最低(ATP生成/氧耗)的心肌线粒体能量底物。
葡萄糖也是心脏产生ATP的重要来源,主要通过细胞质内的糖酵解和线粒体氧化磷酸化产生能量。心肌细胞摄取葡萄糖主要依靠糖转移体1(GLUT1)和糖转移体4(GLUT4)。
葡萄糖因为它卓越的磷氧比值(P/O)比,被誉为最高效能的能量底物。
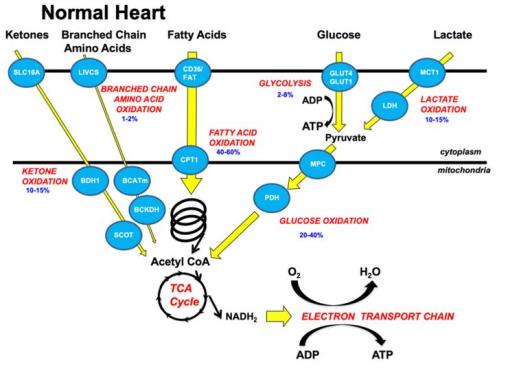
正常心脏的能量代谢
再说乳酸。最近的研究报道,乳酸可能是心肌丙酮酸的重要来源,在一些特殊情况,乳酸以不依赖丙酮酸的方式为TCA循环提供碳原子,给细胞提供能量。
近年来,酮体β-羟基丁酸 (βOHB)也逐渐被认为是心脏的重要能量来源。若循环血酮水平升高,酮体将成为心脏的主要能量底物。更让人惊讶的事,酮体是仅次于葡萄糖的最高效率的能量底物。
最后再说一下氨基酸。支链氨基酸(BCAA)是心肌氨基酸氧化利用的最具特征性的能量来源。虽然BCAA只占心肌ATP生成的2%,但是它在调节胰岛素通路和哺乳动物类雷帕霉素靶蛋白(mTOR)信号通路中发挥着重要作用。此外,BCAAs可以持续激活mTOR信号,通过胰岛素受体底物(IRS)损害胰岛素信号转导,并且异常的BCAAs代谢可以引起BCAAs代谢产物的堆积,最终导致胰岛素抵抗。
心力衰竭心肌的能量代谢偏好改变
在简单了解心脏的正常能量代谢过程后,咱们再一起来看看心力衰竭状态,心肌能量代谢的变化。
在心力衰竭状态下,心肌中的能量代谢可出现翻天覆地的改变。在HFrEF患者的心肌中,脂肪酸供能降低到71%,酮体供能增加到16.4%,氨基酸供能增加到6.4%,乳酸供能增加到5%。
上述能量代谢的改变直接导致线粒体ATP产能减少, ATP产能将较正常心肌减少约30%。产能减少的具体机制有三:心肌细胞活性氧产生的异常增多,线粒体钙离子稳态的异常调节;线粒体质量控制系统的损伤,异常的线粒体自噬;线粒体蛋白的转录调节异常改变,蛋白转录后修饰的增加。
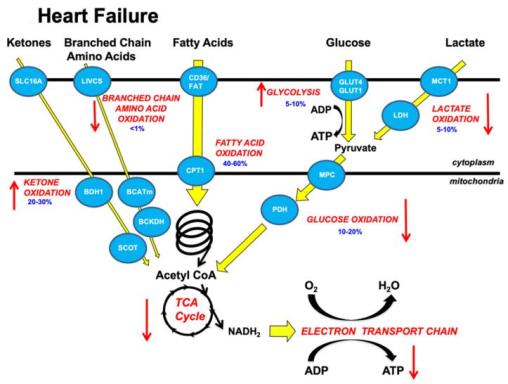
心力衰竭的能量改变概览
那具体的能量变化是什么呢?咱们接着往下看。
(1) 心力衰竭心肌中脂肪酸氧化的变化
之前的主流观点认为:衰竭心肌的脂肪酸氧化是降低的,心力衰竭越严重,心肌内脂肪酸氧化越低。
但近几年的实验结果并不总是一致,甚至存在矛盾。比如:有学者发现自发性高血压大鼠、心肌梗死模型小鼠的脂肪酸摄取和氧化没有改变,也有学者发现自发性扩心病患者脂肪酸氧化是降低的。
另一些学者却发现,自发性扩心病患者脂肪酸摄取不变,充血性心力衰竭患者脂肪酸摄取增多。在心力衰竭合并糖尿病和肥胖的患者中,心肌脂肪酸摄取和氧化是增加的,在HFpEF小鼠中,脂肪酸氧化同样增多,而在高血压或缺血合并心力衰竭中,心肌脂肪酸氧化减少。
总的来说,目前学界关于心力衰竭心肌的脂肪酸氧化变化没有得出一致的结论,不过这可能主要是由于心力衰竭的严重程度不同,心力衰竭的合并症不同导致。
(2) 心力衰竭心肌葡萄糖氧化的变化
虽然衰竭心肌的糖摄取增加是公认的,但糖摄取的增加并没有总是伴随葡萄糖氧化的增加。在大多数心力衰竭心肌中,出现了糖酵解和糖氧化的耦合能力的降低。
简单地说,就是来源于糖酵解的丙酮酸并没有用于线粒体的氧化磷酸化产能,使心肌在葡萄糖利用上,主要依赖糖酵解产生能量。
在HFrEF患者,合并肥胖、糖尿病的心力衰竭患者,以及左心室肥大的小鼠中,就出现了丙酮酸氧化的明显减少,并伴随着丙酮酸转运相关酶丙酮酸脱氢酶(PDH),和线粒体丙酮酸转运载体(MPCs)的降低,以及丙酮酸羧化作用和心肌氧化应激水平增加。
这里需要提一下MPC,它是一个潜在的针对糖代谢调节治疗的靶点。有研究发现,心脏特异性敲除MPC的小鼠可出现年龄相关性左心室肥大,虽然它的射血分数没有出现明显变化,但是可以出现明显的葡萄糖氧化减少,脂肪酸氧化增多等表型变化。这意味着我们可以针对MPC来进一步研究心力衰竭的机制,尤其是对目前我们所知甚少的HFpEF……
(3) 心力衰竭心肌酮体氧化的变化
在HFrEF患者中,酮体氧化会增加100%。
衰竭心肌的酮体代谢变化与脂肪酸代谢变化紧密相关,心肌酮体β-OHB氧化的增多常常伴随着脂肪酸氧化的减少。
例如:心梗(MI)联合主动脉缩窄(TAC)诱导的HFrEF心力衰竭小鼠就表现出明显的酮体摄入和氧化增多,而脂肪酸氧化的显著减少,并且上述小鼠模型出现左心室肥大的易感性增加。
在心力衰竭患者中,酮体代谢的增加是适应性改变还是不适应性改变仍有待确定。重要的是,必须评估酮体利用效率的高低,以及酮体代谢是否以脂肪酸或葡萄糖的氧化为代价。
最近,学者们在3-Hit诱导的HFpEF小鼠模型研究中发现,与HFrEF不同,HFpEF心肌在酮体氧化并没有增加。而提高酮体的可用性,比如:升高心肌酮体的β-羟基丁酸水平,可以改善促炎因子诱导的HFpEF的线粒体功能障碍,从而缓解心力衰竭症状。
其他学者也发现,HFpEF患者血清中乙酰乙酸和βOHB的水平明显高于HFrEF患者。这提示,与HFpEF相比,HFrEF对更依赖酮体作为能量底物。
未来的研究需进一步阐明酮体代谢在HFpEF的发生发展的作用。
(4) 心力衰竭心肌BCAA氧化的变化
心力衰竭患者血浆BCAA水平的升高,被认为是未来心血管疾病发展的早期预测指标。它的升高可能预示着心力衰竭中BCAA的氧化受损,堆积的BCAAs可激活mTOR信号,加速心肌肥大的发生发展。
调节BCKDK活性是改善BCAA代谢的主要方式,它的神秘法宝是“去磷酸化”和“激活BCKDH”,这样可以改善HFrEF心肌收缩功能障碍和心肌胰岛素抵抗。例如,咱们可以通过给予BCKDK的抑制剂BT2,促进衰竭心肌的BCAA氧化代谢,减少BCAA堆积。
其次,蛋白磷酸酶PPC2m也是一个有趣且重要的靶点,它对BCAA氧化也十分重要,可以减少对BCKDH的抑制,促进BCAA氧化,PPC2m基因敲除小鼠患HFrEF的风险是明显增加。
不过,BCAA分解障碍如何抑制心脏葡萄糖氧化;BCAA和BCKA在触发mTOR通路,介导胰岛素抵抗的过程中是否存在不同,仍然还不明确。总之,调控心力衰竭中BCAA的代谢是非常重要且有意义的。
(5) 心力衰竭心肌的胰岛素抵抗
糖尿病与心脏疾病是有千丝万缕的联系,胰岛素抵抗是心力衰竭的独立危险因素。糖尿病患者发生心肌梗死的几率是普通人的约2-4倍,糖尿病可以加速缺血性心肌病演变为心力衰竭的过程。
同样,心力衰竭礼尚往来,也会加重胰岛素抵抗的程度。增加心脏的能量供应,促进心脏葡萄糖氧化,已经成为很多研究中减少心力衰竭中心脏不良重构的主要方法。
在心力衰竭中,胰岛素抵抗,除了表现在葡萄糖氧化的明显降低以外,还伴随着心脏胰岛素信号转导的变化。后者不仅可以调节心脏能量代谢,也可能改变心脏对葡萄糖和脂肪酸等能量物质的利用,从而加重左心室重塑水平。
胰岛素信号通路主要包括胰岛素受体底物蛋白-1(IRS-1)和RAC-α丝氨酸/苏氨酸-蛋白激酶(Akt1)等蛋白,IRS-1基因的缺失和IRS-1/ Akt1通路的过度激活,都具有明显的心肌保护作用,但敲低胰岛素受体底物蛋白-2(IRS-2)却可以加重小鼠的心力衰竭。

然而,胰岛素信号如何转导到线粒体以刺激PDH和葡萄糖氧化目前还不清楚,胰岛素信号在线粒体上的特征也没有完全阐明,目前的观点认为,胰岛素刺激的Akt1是心肌细胞线粒体葡萄糖氧化的关键因子。
(6) 心力衰竭心肌的NAD(H)改变
在包括心力衰竭在内的许多慢性疾病中,都可以看到烟酰胺腺嘌呤二核苷酸(NAD)的减少或NAD+/NADH氧化还原的抑制。
然而,引起心力衰竭心肌NAD(H)水平改变的具体机制尚不完全清楚。虽然增加NAD水平可以改善各种心力衰竭动物的疾病预后,但我们对NAD发挥保护作用的机制也不明确。
之前有学者发现NAD+是Sirtuin去乙酰化酶的共底物,在心力衰竭或线粒体功能障碍引起的心肌病中都观察到了蛋白质乙酰化的增加、NAD和Sirtuin的减少。
于是大家就把Sirt3(sirtuin 3)(一种线粒体定位的 Sirtuin)的激活与增加NAD的心脏保护作用联系起来。
但也有学者发现,线粒体高乙酰化并不会加重高血压导致的心力衰竭。这就提示我们,对NAD的研究不能仅仅局限于Sirt3和线粒体蛋白质乙酰化。
此外,增加NAD前体、过表达NAMPT或者恢复NAD+/NADH氧化还原也可以改善心力衰竭小鼠模型的疾病预后,但是具体机制也是等着我们去发现。
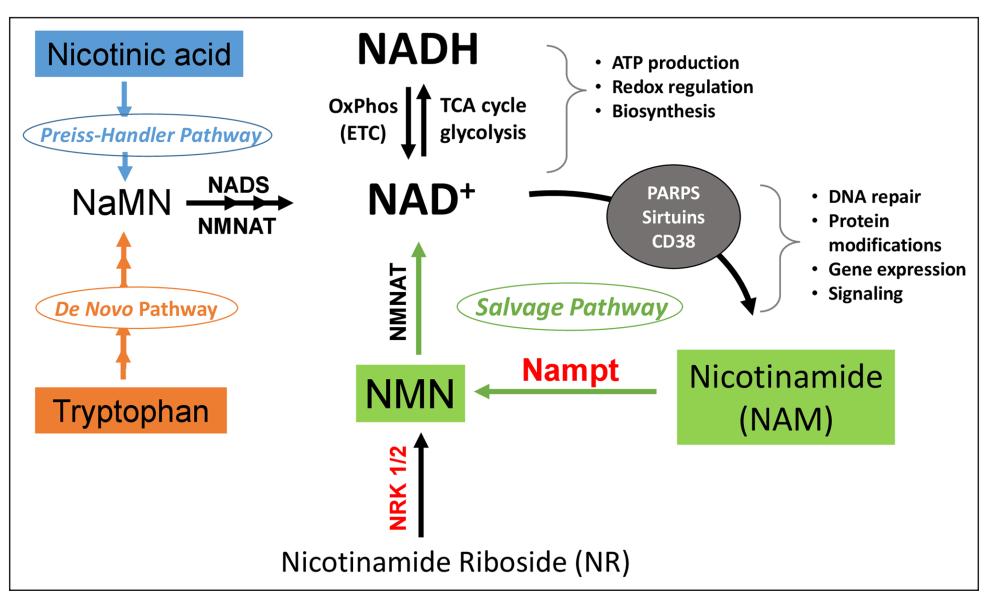
烟酰胺腺嘌呤二核苷酸(NAD)的代谢及其生物学作用
(7) 心力衰竭心脏的表观遗传及转录改变
蛋白质乙酰化是组蛋白翻译后修饰的一种,许多控制组蛋白乙酰化的酶都可以被NAD(H)和乙酰辅酶A调节,蛋白质乙酰化有成为心力衰竭治疗靶点的潜力,因此受到学者们最广泛的关注。这里就不得不提sirtuins和组蛋白去乙酰化酶 (HDAC)抑制剂了。
Sirtuins是一种依赖NAD的蛋白质去乙酰化酶,因其在心血管疾病中的潜在作用,而被广泛研究。一些sirtuins酶可能通过表观遗传调节线粒体酶的功能,也可能直接调节线粒体酶的功能。
HDAC抑制剂也是一种治疗心力衰竭的候选药物。最近的证据也支持抑制HDAC可以改善HFpEF动物模型的心肺功能。
除了组蛋白对基因表达的表观遗传调控外, DNA的直接修饰也可能通过胞嘧啶核苷酸的修饰,鸟嘌呤核苷酸的甲基化(5mC)或羟甲基化(5hmC)来完成。当然,表观遗传调控还包括非编码RNA,它主要是指microRNA到长链非编码RNA的多种调节途径。
靶向心脏代谢,治疗心力衰竭的可能策略
基于上面的内容,不难看出代谢调节是治疗心力衰竭的一种非常有潜力的方式。
接下来我们就简要梳理一下靶向心脏代谢,治疗心力衰竭的可能策略。
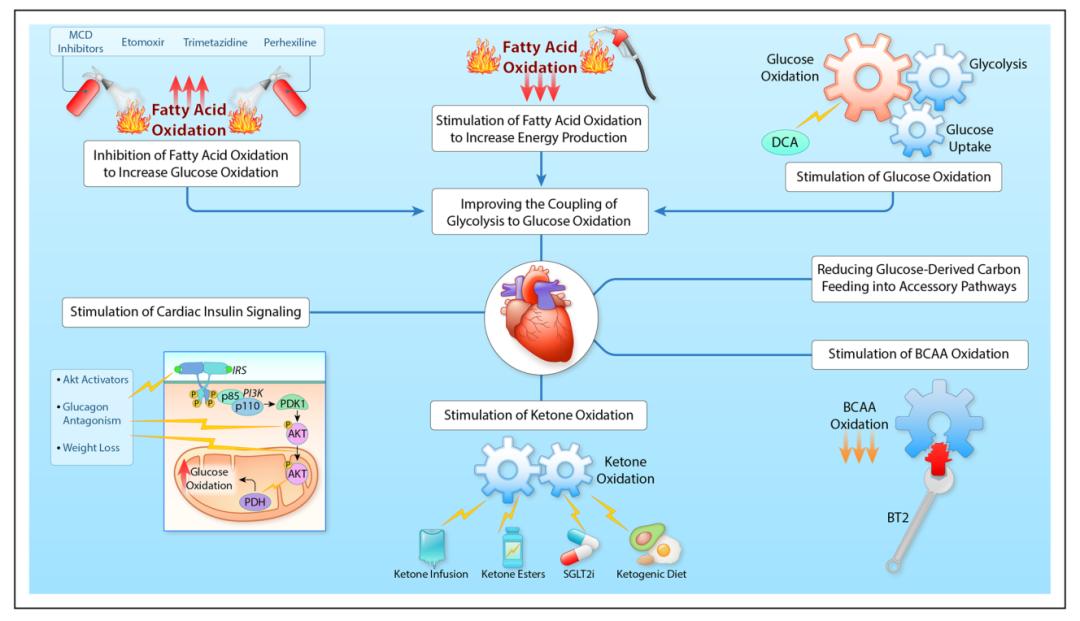
靶向心脏能量代谢,治疗心力衰竭的可能策略
(1) 策略一:促进心脏酮体氧化利用
增加心脏酮体的氧化利用可以改善心脏功能,这可以用升高血酮水平来实现,主要有以下4种方式:酮体输注、酮酯给药、钠/葡萄糖共转运体2 (SGLT2)抑制剂的使用,以及生酮饮食治疗。
酮体输注和酮酯的给药方式可以改善心脏功能,减轻心室异常重构,但上述2种给药方式的缺点在于,它们不能长期将血酮维持在高水平;SGLT2抑制剂可克服这一缺点,它可以长期提高酮体水平,增加衰竭心脏的能量供应;生酮饮食是另一种升高循环血酮的方式,已有研究证明:给心力衰竭小鼠喂食生酮饮食,心衰小鼠的心脏功能可以得到较好的改善。
(2) 策略二:促进心脏葡萄糖氧化利用,改善胰岛素敏感性
促进葡萄糖氧化利用可以改善心脏功能,并且减轻胰岛素抵抗对衰竭心脏的不良影响。例如:用二氯乙酸盐(丙酮酸脱氢酶激酶的直接抑制剂)治疗心力衰竭,可以激活PDH复合物,促进心衰心肌葡萄糖的氧化利用,提高糖酵解和线粒体葡萄糖氧化之间的紧密耦合,还可以通过降低心肌耗氧的需求,提高心脏做功效能。
另外,针对伴有胰岛素信号上调的衰竭心脏,特别是那些伴有糖尿病和肥胖的心力衰竭患者,使用抗胰高血糖素受体(GCGR)的人单克隆抗体,可以改善心肌胰岛素敏感,促进葡萄糖氧化利用,从而改善心脏功能。
(3) 策略三:改变心脏脂肪酸氧化利用
我们已经知道,衰竭心脏中脂肪酸氧化的改变是复杂的,它可能会减少、不变,甚至可能增加。尽管如此,抑制脂肪酸氧化的治疗方式,已被证明可以改善衰竭心脏的心脏功能。例如,脂肪酸氧化抑制剂如曲美他嗪、依托莫西和哌克昔林对心力衰竭患者具有心脏保护作用,它们主要通过增加葡萄糖氧化,抑制脂肪酸氧化,最终增加心脏工作效能。
另外值得提及的是丙二酰辅酶A,它是心脏脂肪酸氧化的内源性抑制剂,通过抑制线粒体脂肪酸摄取发挥作用,主要被丙二酰辅酶A脱羧酶(MCD)和乙酰辅酶A羧化酶(ACC)调节。有研究发现,抑制MCD和ACC都可以提高糖酵解和糖氧化的耦合效能,改善心脏线粒体功能,对心力衰竭有保护作用。
(4) 策略四:促进心脏BCAA氧化利用
增强BCAA氧化和/或降低血液中BCAA水平,在心力衰竭中都具有心脏保护作用。例如:BCKDK抑制剂BT2,可以提高衰竭心脏BCAA氧化能力,减少BCAA堆积,减小心脏I/R损伤的梗死面积,在未来的心力衰竭治疗研究中,调控BCAA代谢,将会是一种非常有前途的策略。
结语:
衰竭心脏的能量缺失,主要原因在于心脏线粒体氧化能力降低、糖酵解和糖氧化的耦合能力不足,以及脂肪酸氧化的变化。而衰竭心脏中线粒体氧化代谢的改变,是由于参与这些代谢途径的关键酶的转录发生了变化,以及氧化还原状态和代谢产物信号出现了异常。
目前,我们对心力衰竭的能量改变仍然有非常多没(ke)有(ti)明(fang)确(xiang)的地方,尤其是对HFpEF这种特殊的心力衰竭,我们对它所知甚少。
此外,以线粒体氧化代谢为药理学治疗靶点的治疗方法,已经成为了改善衰竭心脏功能的一种非常有潜力的新型治疗方法,未来的研究应该在这些方面进行深入探究。

参考文献:
1. Lopaschuk, G.D., Qutuba G. Karwi, Rong Tian, Adam R. Wende , E. Dale Abel. Cardiac Energy Metabolism in Heart Failure. Circulation Research, 2021. 128(10): p. 1487-1513. Doi:10.1161/CIRCRESAHA.121.318241.
2. 中国心血管健康与疾病报告编写组,中国心血管健康与疾病报告2019概要.中华老年病研究电子杂志,2020,7(04):4-15.
3. Li T, Zhang Z, Kolwicz SC Jr, Abell L, Roe ND, Kim M, Zhou B, Cao Y, Ritterhoff J, Gu H, Raftery D, Sun H, Tian R. Defective Branched-Chain Amino Acid Catabolism Disrupts Glucose Metabolism and Sensitizes the Heart to Ischemia-Reperfusion Injury. Cell Metab. 2017 Feb 7;25(2):374-385. doi: 10.1016/j.cmet.2016.11.005.
4. Deng Y, Xie M, Li Q, Xu X, Ou W, Zhang Y, Xiao H, Yu H, Zheng Y, Liang Y, Jiang C, Chen G, Du D, Zheng W, Wang S, Gong M, Chen Y, Tian R, Li T. Targeting Mitochondria-Inflammation Circuit by β-Hydroxybutyrate Mitigates HFpEF. Circ Res. 2021 Jan 22;128(2):232-245. doi: 10.1161/CIRCRESAHA.120.317
5. Kenchaiah S, Vasan RS. Heart Failure in Women--Insights from the Framingham Heart Study. Cardiovasc Drugs Ther. 2015 Aug;29(4):377-90. doi: 10.1007/s10557-015-6599-0.
6. Murashige D, Jang C, Neinast M, Edwards JJ, Cowan A, Hyman MC, Rabinowitz JD, Frankel DS, Arany Z. Comprehensive quantification of fuel use by the failing and nonfailing human heart. Science. 2020 Oct 16;370(6514):364-368. doi: 10.1126/science.abc8861.


责任编辑丨BioTalke
原标题:《CR:一文搞懂心力衰竭的能量代谢改变,以及潜在的治疗靶点丨奇点深度》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




