- +1
《细胞》子刊:破解ω-3/6杀死癌细胞之谜
原创 奇点糕 奇点网 收录于话题#饮食是门大学问43#众病之王癌症88

通过能量限制饮食和特殊氨基酸限制饮食来抑制肿瘤生长,是当前抗癌研究的一个重要方向[1]。但这种方式往往会引起机体的不良后果,如体重下降、疲劳、虚弱[2]。
因此,通过补充特定营养元素,而非限制饮食的干预策略也成为肿瘤治疗探索的新方向。一些小鼠的研究表明,补充摄入组氨酸和甘露糖可以抑制肿瘤生长[3, 4]。此外,在小鼠的饮食中添加ω-3(n-3)多不饱和脂肪酸(PUFA)也能发挥潜在抗肿瘤作用[5]。
虽然饮食中补充PUFA相比能量限制饮食更方便易行,然而n-3 PUFA饮食抗肿瘤的有效性,摄入剂量和模式,以及具体作用机制仍尚不清楚,有待进一步研究。
近期,来自比利时鲁汶大学实验与临床研究所(IREC)的Olivier Feron研究团队在《细胞·代谢》期刊发表重要研究成果[6]。他们的研究表明,增加饮食中PUFA摄入,会促进酸性肿瘤微环境中癌细胞的脂质过氧化,诱发癌细胞铁死亡,从而发挥抗肿瘤作用。

论文首页截图
既往大量研究表明肿瘤生长高度依赖于脂肪酸摄取和氧化。在作者的前期研究中,他们发现肿瘤酸中毒与脂肪酸代谢重构密切相关,外源性脂肪酸摄取可作为其发生β氧化的原料,并促进甘油三酯在脂滴中累积[7]。
研究人员首先分别在酸性(pH 6.5)和中性(pH 7.4)培养条件下,用不同类型脂肪酸处理肿瘤细胞。结果显示,酸性条件下,不同来源的肿瘤细胞将脂肪酸累积到脂滴的能力更强。同时,酸性环境中肿瘤细胞会摄取更多n-3和n-6 PUFA,同时将其存储到脂滴中,且脂滴大小和数量与PUFA的双键数量成比例增加。
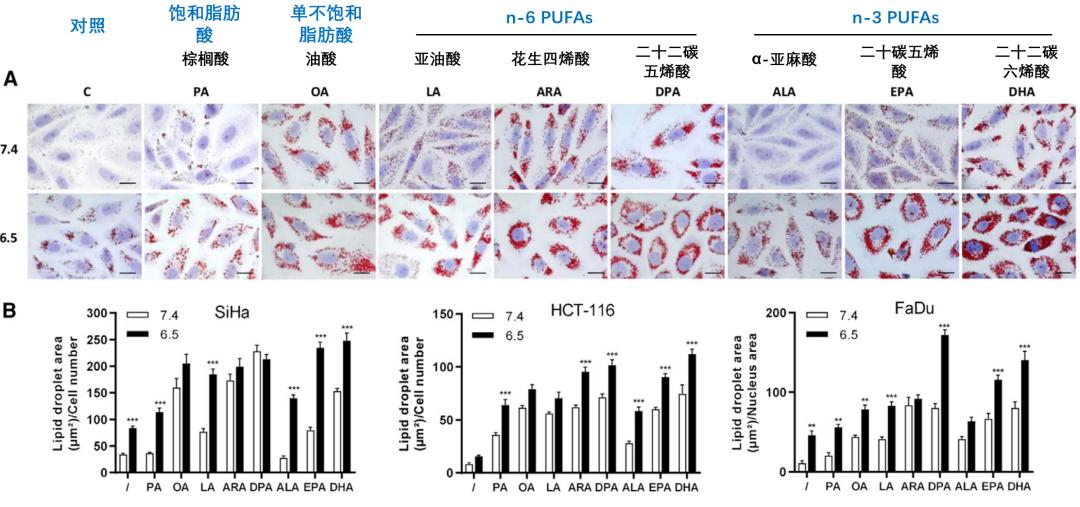
n-3和n-6 PUFAs优先累积到酸性肿瘤细胞的脂滴中,且与双键数量成正比(n-6 PUFAs: C22:5, DPA > C20:4, ARA > C18:2, LA; n-3 PUFAs: C22:6, DHA > C20:5, EPA > C18:3, ALA)。
细胞毒性实验表明,在酸性环境下,n-3和n-6 PUFAs均呈现剂量依赖性的抑制肿瘤细胞生长,而对中性环境肿瘤细胞无明显影响。无论在什么条件下,棕榈酸(PA,为饱和脂肪酸)和油酸(OA,为单不饱和脂肪酸)都不能发挥抑制肿瘤生长的作用。
此外,n-3和n-6 PUFAs的肿瘤抑制作用与其双键数量成正比,并且这一作用在酸性被中和之后被逆转。
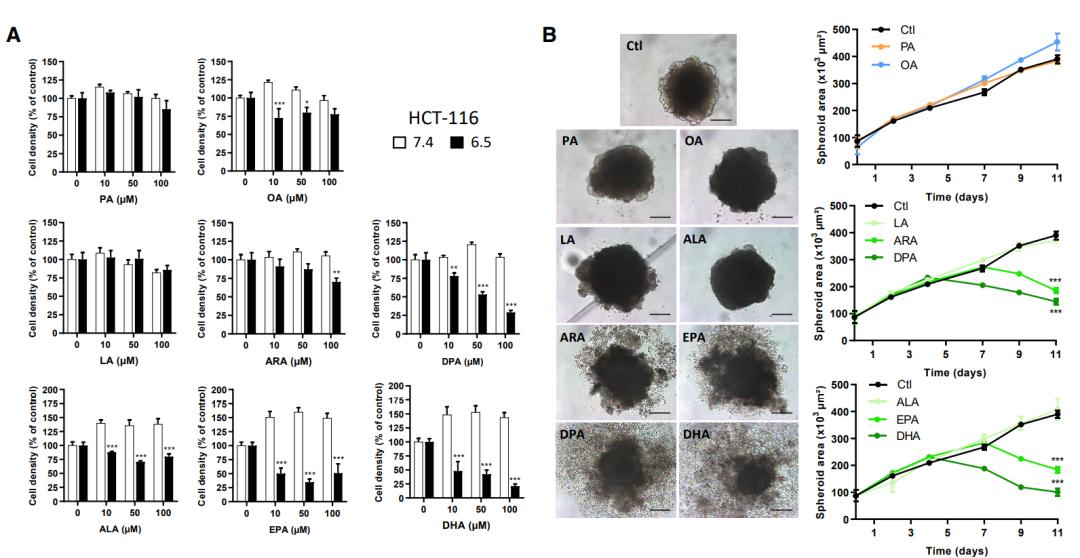
n-3和n-6 PUFAs在酸性肿瘤细胞发挥细胞毒性作用
那么在酸性环境条件下,n-3和n-6 PUFAs诱导肿瘤细胞死亡的机制是什么呢?
由于活性氧能引发PUFAs发生过氧化,形成丙二醛(MDA)等过氧化物,进而引起细胞死亡;以及n-3和n-6 PUFAs的细胞毒性作用与双键数量密切相关,因此研究人员推测:是PUFA发生脂质过氧化,从而导致肿瘤细胞死亡。
Feron团队通过C11-BODIPY 581/591荧光探针和MDA检测脂质过氧化,结果发现,酸性条件下肿瘤细胞显示出更高的氧化能力。如果将肿瘤细胞暴露在不同脂肪酸中,细胞在酸性条件下脂质过氧化水平更高,且与双键数量成正比。
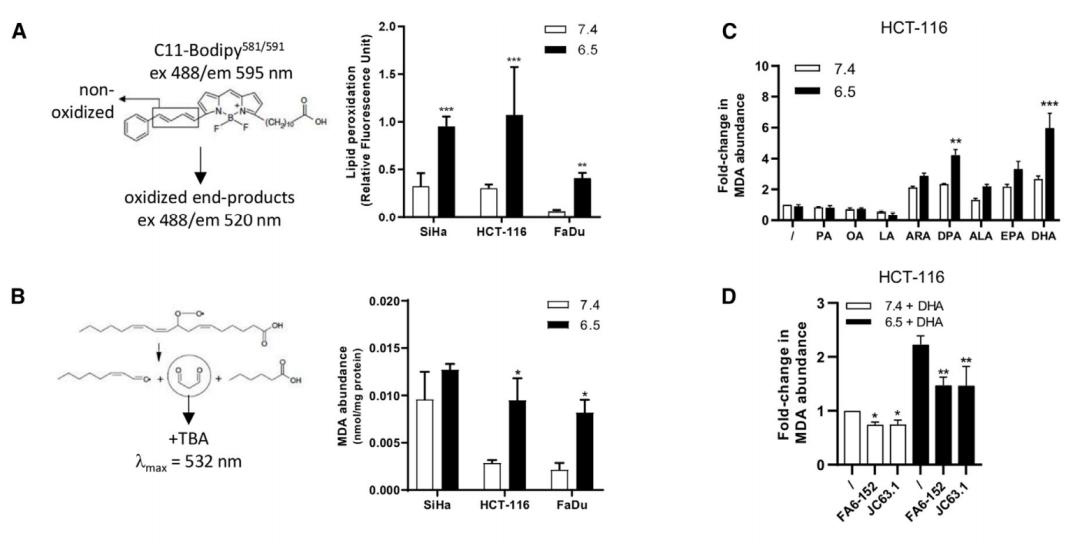
n-3和n-6 PUFAs在酸性条件下优先发生脂质过氧化
上面的研究结果让Feron和他的同事们想起了铁死亡。
铁死亡是一种铁依赖性的调节性细胞死亡形式,由过度的脂质过氧化引起,它与各种类型肿瘤的发生和治疗反应相关。
那么n-3和n-6 PUFAs引起肿瘤细胞毒性的机制,是否与其诱发铁死亡相关呢?
Feron团队用铁死亡诱导剂erastin和RSL3处理3D肿瘤球体,发现它们均能显著增加DPA(二十二碳五烯酸)和DHA(二十二碳六烯酸)这两种PUFAs在3D肿瘤球体中的细胞毒性作用。
而使用抗氧化剂维生素E和铁死亡抑制剂ferrostatin-1和liproxstatin-1能抵抗PUFAs诱导的细胞死亡。
此外,Feron团队还发现,在酸性条件下,肿瘤细胞中与铁死亡相关基因如GPX-4、SLC7A11、DHFR和FSP-1的表达均发生改变。这些结果说明,n-3和n-6 PUFAs的细胞毒性确实是由脂质过氧化诱发的铁死亡引起。
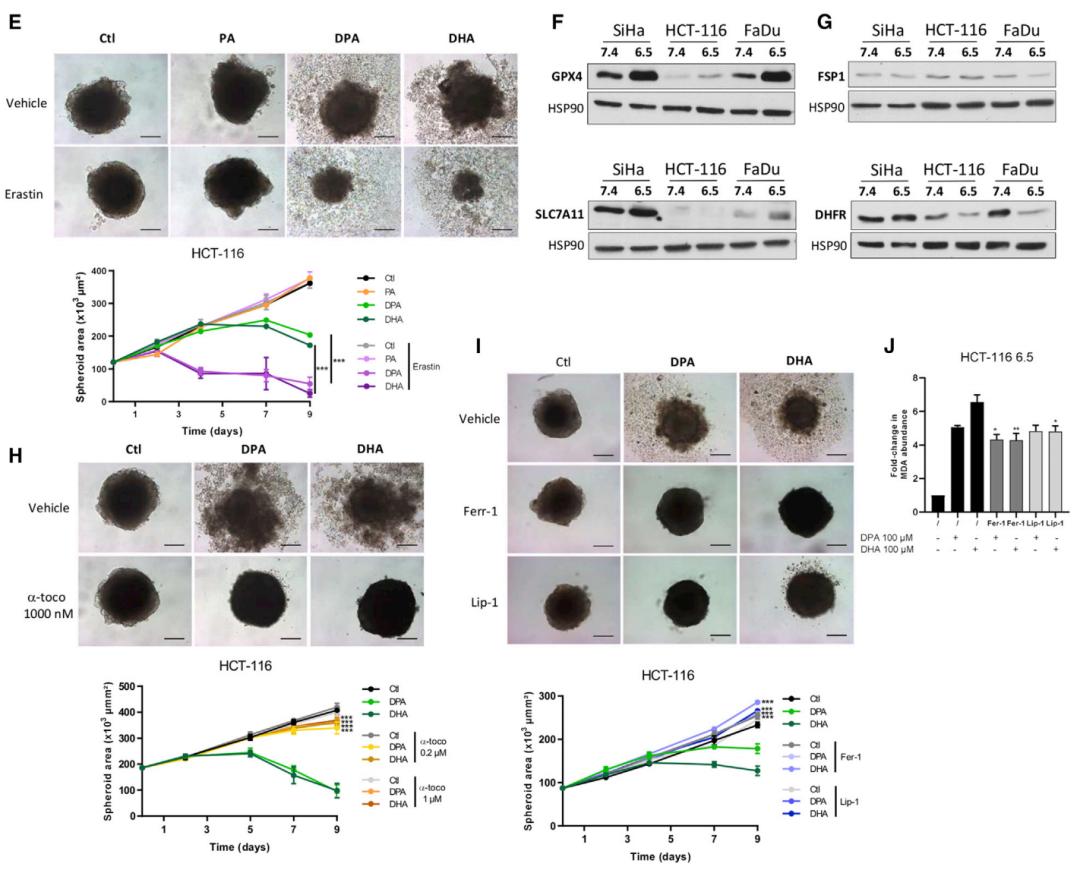
n-3和n-6 PUFAs诱发酸性肿瘤细胞发生铁死亡
既然n-3和n-6 PUFAs对肿瘤细胞具有强烈的细胞毒性,那么为何细胞会摄取PUFAs并将其储存到脂滴中呢?
Feron和他的同事们推测:脂滴可能是肿瘤细胞抵抗脂质过氧化的保护机制。
为了证实这一猜想,Feron团队使用二酰基甘油酰基转移酶(DGAT)抑制剂防止酸性肿瘤细胞的脂滴形成。结果发现DGAT抑制剂显著增加了DHA诱导的酸性肿瘤细胞中MDA产生,这提示DGAT抑制剂促进PUFAs诱导的脂质过氧化。
于是,研究人员进一步检测了DGAT抑制剂对n-3和n-6 PUFAs诱导的细胞毒性影响。结果表明,DGAT抑制剂增加了DPA和DHA对酸性条件下细胞的细胞毒性作用,且DGAT1和DGAT2抑制剂联用比单药有更强抑制作用。
此外,使用铁死亡抑制剂ferrostatin-1和liproxstatin-1均能阻止DGAT抑制剂这一作用。
这些结果表明,用DGAT抑制剂阻止PUFAs在肿瘤细胞的脂滴中累积,能选择性促进酸适应肿瘤细胞的铁死亡。
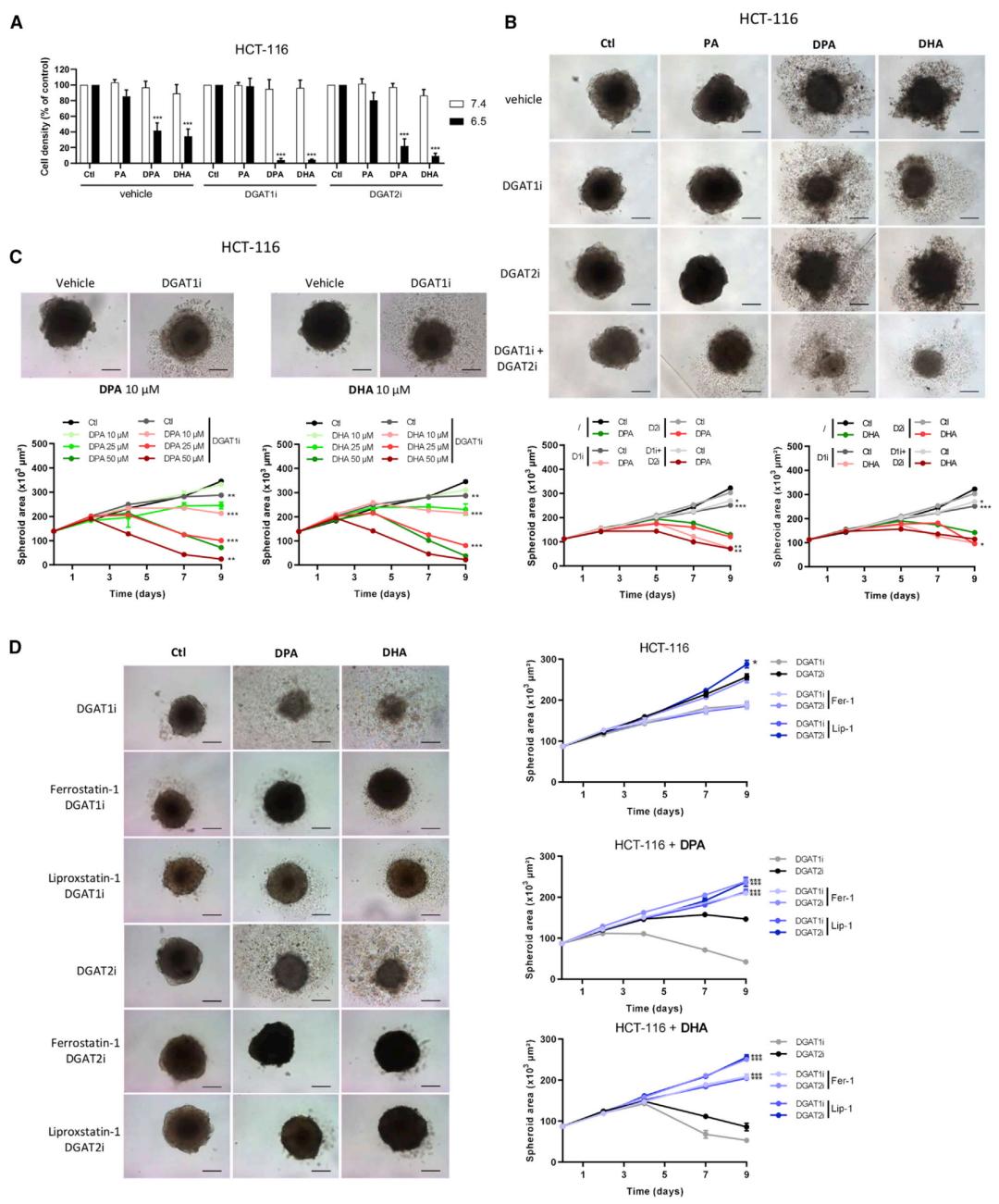
DGAT抑制剂增强n-3和n-6 PUFAs对酸性条件肿瘤细胞的毒性作用
最后,研究人员还在体内验证了PUFAs的抗肿瘤作用。
他们使用富含OA对照或DHA的等热量饲料喂养小鼠。结果显示,DHA饮食小鼠血清和组织中n-3 PUFAs水平显著增加。与正常饮食和富含OA饮食小鼠相比,高DHA饮食能显著抑制荷瘤小鼠体内肿瘤生长,同时延长小鼠生存期。使用DGAT1抑制剂能进一步抑制高DHA饮食小鼠的肿瘤生长。
此外,使用铁死亡诱导剂柳氮磺吡啶和erastin,能协同增强高DHA饮食对小鼠肿瘤生长的抑制作用,而铁死亡抑制剂ferrostatin-1则削弱了高DHA饮食的抗肿瘤作用。
这些结果表明n-3 PUFAs饮食可以通过诱导肿瘤细胞铁死亡,从而发挥抗肿瘤作用。
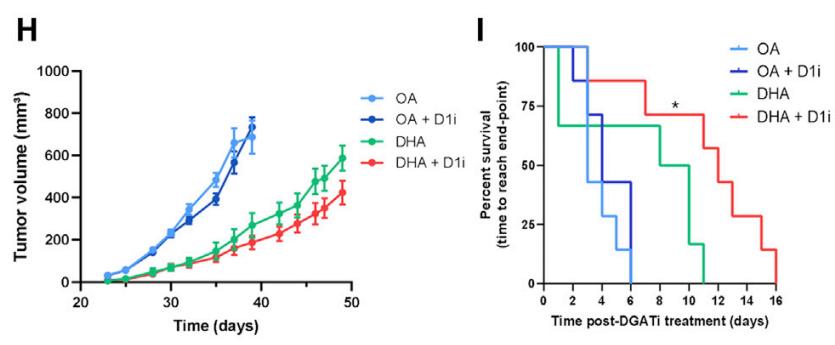
高DHA饮食和DGAT抑制剂协同抑制肿瘤生长,同时延长小鼠生存期
总的来说,本研究证实,通过饮食补充n-3和n-6 PUFAs能对诱导酸性环境的肿瘤细胞发生铁死亡,而对pH正常的组织细胞影响不大,并且这种作用能通过抑制脂滴形成和铁死亡诱导剂协同增强。
巧的是,在实体肿瘤中,由于肿瘤组织迅速增长,而瘤内血管系统不完备,这些会导致肿瘤组织内氧气不足,因此肿瘤细胞优先使用无氧糖酵解进行能量代谢(Warburg效应),导致乳酸积累。此外,肿瘤细胞也会将细胞内H+运输到细胞外。
正是这些细胞反应造成肿瘤微环境pH降低,整体呈酸性环境,给补充n-3和n-6 PUFAs杀死癌细胞提供了潜在的机会。
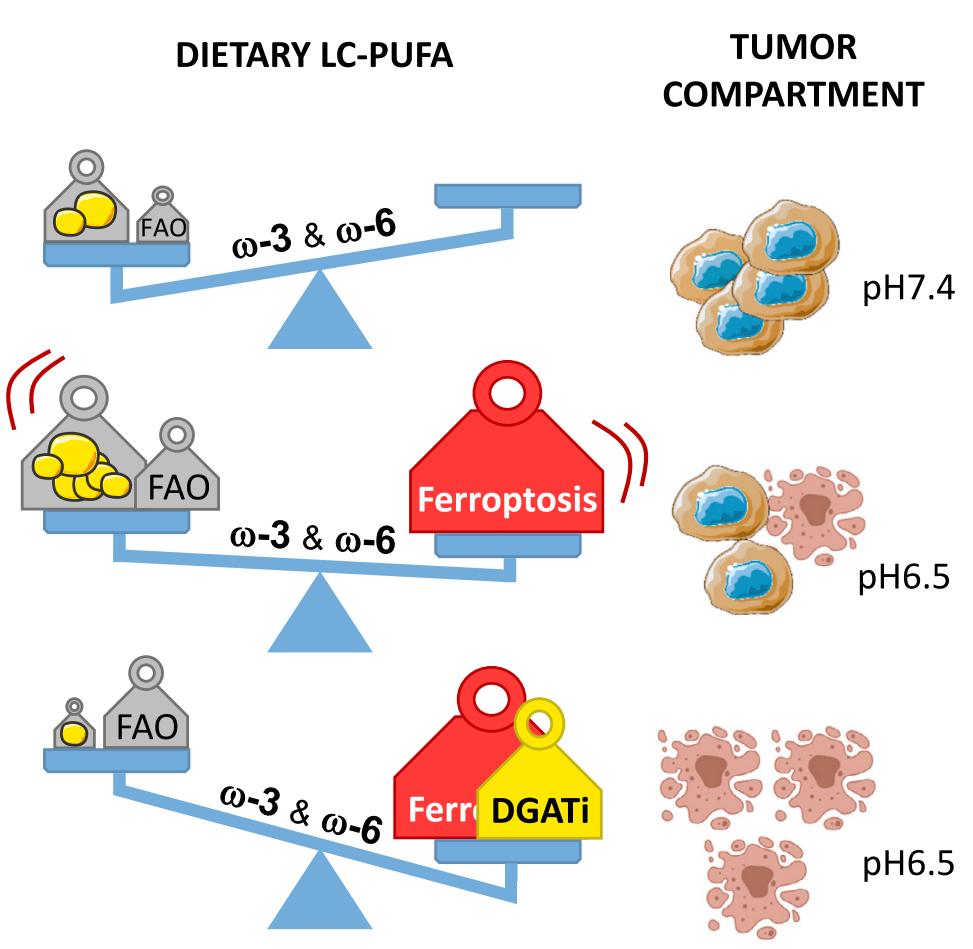
基于以上研究成果,研究人员认为本研究的意义在于阐明膳食补充PUFA或能作为一种选择性辅助抗肿瘤方式。尤其在靶向铁死亡的肿瘤治疗方案中,PUFA或能协同增强抗肿瘤效果。

奇点上新
这次的课程,我们用10讲系统梳理了晚期肺癌治疗20年的风云变幻。细致盘点了靶向治疗的最新进展,也全面展现了罕见靶点研究的勃勃生机。
当然免疫治疗也是重中之重,我们会带你再次洞察免疫治疗的深层机制,深入免疫治疗最前线,探讨迈入无化疗时代的治疗选择,一起见证辅助和新辅助治疗开疆拓土的战绩。
除此之外,我们还会和你一起凝视纷繁复杂的生物标志物研究,探究免疫治疗新靶点的无限潜力。

当然,深度不意味着晦涩,复杂不等同于繁复。我们竭尽全力将这些庞杂的知识点融汇成精湛的音频课程,让你听得轻松、顺畅,不头大,让这些知识快速整合到我们的认知体系,成为下一步进阶的土壤。
说了半天,这么好的课程,原价只需39.9元,认证购买仅需9.9元,也就半杯奶茶的钱!既然看到这里了,就立刻扫描下方二维码,购买收听起来吧!

参考文献:
[1] Dierge E, Larondelle Y, Feron O. Cancer diets for cancer patients: Lessons from mouse studies and new insights from the study of fatty acid metabolism in tumors. Biochimie. 2020;178:56-68. doi:10.1016/j.biochi.2020.08.020
[2] Dierge E, Feron O. Dealing with saturated and unsaturated fatty acid metabolism for anticancer therapy. Curr Opin Clin Nutr Metab Care. 2019;22(6):427-433. doi:10.1097/MCO.0000000000000601
[3] Kanarek N, Keys HR, Cantor JR, et al. Histidine catabolism is a major determinant of methotrexate sensitivity. Nature. 2018;559(7715):632-636. doi:10.1038/s41586-018-0316-7
[4] Gonzalez PS, O'Prey J, Cardaci S, et al. Mannose impairs tumour growth and enhances chemotherapy. Nature. 2018;563(7733):719-723. doi:10.1038/s41586-018-0729-3
[5] Van Blarigan EL, Fuchs CS, Niedzwiecki D, et al. Marine ω-3 Polyunsaturated Fatty Acid and Fish Intake after Colon Cancer Diagnosis and Survival: CALGB 89803 (Alliance). Cancer Epidemiol Biomarkers Prev. 2018;27(4):438-445. doi:10.1158/1055-9965.EPI-17-0689
[6] Dierge E, Debock E, Guilbaud C, et al. Peroxidation of n-3 and n-6 polyunsaturated fatty acids in the acidic tumor environment leads to ferroptosis-mediated anticancer effects. Cell Metab. 2021;S1550-4131(21)00233-3. doi:10.1016/j.cmet.2021.05.016
[7] Corbet C, Bastien E, Santiago de Jesus JP, et al. TGFβ2-induced formation of lipid droplets supports acidosis-driven EMT and the metastatic spreading of cancer cells. Nat Commun. 2020;11(1):454. Published 2020 Jan 23. doi:10.1038/s41467-019-14262-3


责任编辑丨BioTalker
原标题:《《细胞》子刊:破解ω-3/6杀死癌细胞之谜!科学家发现,多不饱和脂肪酸可诱导癌细胞铁死亡丨科学大发现》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




