- +1
科学家首次发现β-淀粉样蛋白纤维可催化神经递质降解
原创 Cell Press CellPress细胞科学

物质科学
Physical science
近日,以色列内盖夫本-古里安大学Raz Jelinek等人在Cell Press细胞出版社期刊Chem Catalysis上发表了一篇新研究,题为“β-Amyloid fibrils catalyze neurotransmitter degradation”,他们首次证实了成熟Aβ42纤维具有显著的催化活性,或揭示阿尔兹海默病的毒性机制可能与Aβ42纤维有关,而非Aβ42单体或者通常被认为具有毒性的寡聚体。
Cell Press细胞出版社微信公众号对该论文进行了解读,旨在与广大科研人员深入分享该研究成果以及一些未来的展望。
作为一种毁灭的神经退行性疾病,阿尔兹海默病(AD)已成为影响人类健康的重大疾患,相关研究也引发了科研人员的广泛关注。其主要病理特征之一为神经组织中β-淀粉样蛋白(Aβ)纤维斑块的积累,然而目前这种Aβ纤维斑块与AD病理学之间的因果关系尚待证实,且AD的致病机理和治疗方法仍未完全阐明。许多研究认为,Aβ寡聚体或者纤维前体(pre-fibrillar species)可能才是AD的毒性根源。
另一方面,虽然蛋白质聚集(如Aβ纤维)是典型的疾病标志。但在催化领域,受启发于酶催化,基于多肽及其组装体的类酶催化性质正逐渐引起科研人员的关注,并已成功应用于多种催化反应中。而从进化论的角度来看,自组装多肽催化对于生物分子的结构复制以及研究生命起源等关键问题具有重要意义。此外,β-折叠也是影响合成多肽以及人工酶的催化活性的关键因素,例如Aβ的短片段Aβ16-22可作为催化活性物质的脚手架,并进一步通过修饰氨基酸的方式得到具有高催化活性的纳米管。然而目前关于Aβ纤维组装体的催化性质研究尚无报道。
基于此,Raz Jelinek团队拟通过系统评估Aβ42纤维在生物反应中的催化特性,以阐明纤维组装在生物催化中的结构和功能意义。图1所示为Aβ纤维的组装过程及催化示意图。首先,新鲜溶解的Aβ42初始状态为单体(图1,i),随后形成交叉β片状结构的寡聚体(图1,ii),并最终通过堆叠形成较长的成熟Aβ纤维(图1,iii)。研究人员假定Aβ42纤维的表面具备独特的催化活性位点(标记为“剪刀”),且催化活性主要来源于纤维的表面,重点强调纤维组装在催化过程中的关键作用,而非单体或寡聚体。
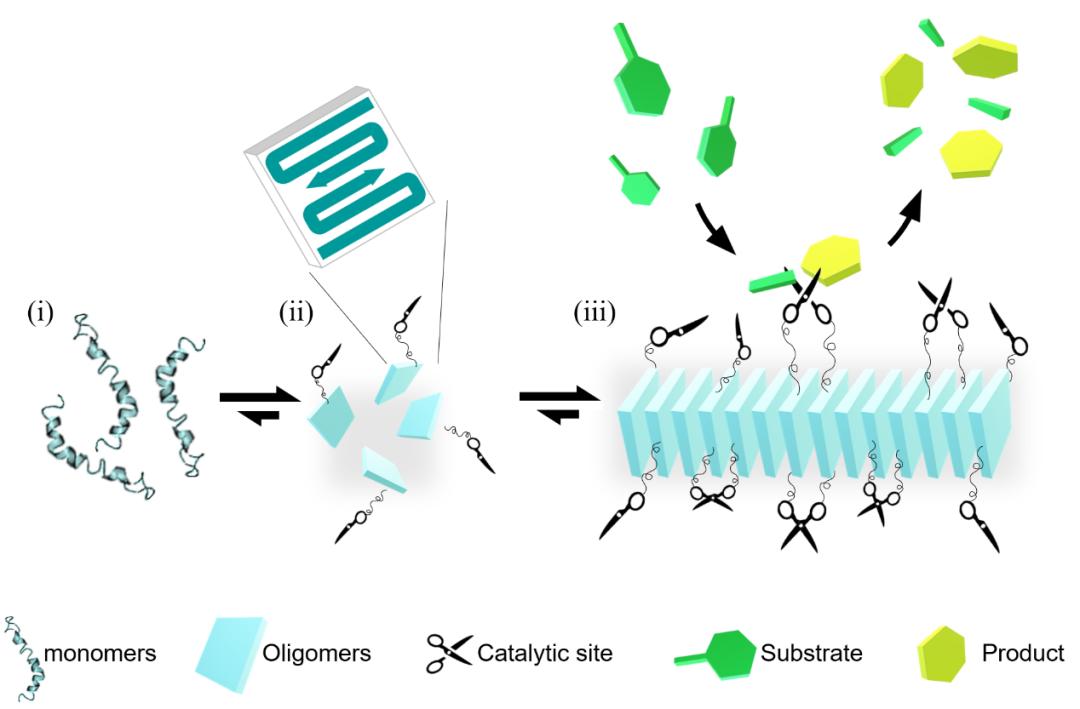
图1:β-淀粉样蛋白(Aβ)纤维的组装过程及催化示意图
为进一步验证上述假设,研究人员对Aβ42催化乙酸对硝基苯酯(pNPA)水解的活性进行了研究。首先,通过FTIR以及cryo-TEM等手段对两种不同的Aβ42物种:Aβ42单体(紫色)以及Aβ42纤维(橙色)的成分及结构进行了确认(图2A,B)。进一步对两种Aβ42的水解动力学进行了研究。图2C展现了水解产物对硝基苯酚(pNP)的浓度分别在Aβ42单体(紫色),Aβ42纤维(橙色)以及空白对照(黑色)的条件下,随反应时间的变化曲线。相比于空白对照(没有催化剂),两种Aβ42物种均展现出了催化活性,且Aβ42纤维的催化水解活性显著高于Aβ42单体,其pNP浓度在反应了12小时后提升了近十倍。而pNPA的初始水解速率(V0)和Aβ纤维浓度之间的线性关系与米-曼氏模型相吻合,证实反应相对于Aβ42纤维为一级反应。图2E(i)则证实了Aβ42纤维的水解作用,在相同底物浓度的情况下,Aβ42纤维促进水解的能力显著强于Aβ42单体,且用于催化的Aβ42浓度(10 μM)比底物pNPA的浓度低了两个数量级(3000 μM)。图2E(ii)则总结了相关参数并对米-曼氏模型进行非线性拟合,结果表明Aβ42纤维具有比其他合成多肽组装体更高的催化效率。图2F表明纤维表面的催化位点并不支持金属辅助因子,这与合成多肽组装体的催化结果也是相似的。
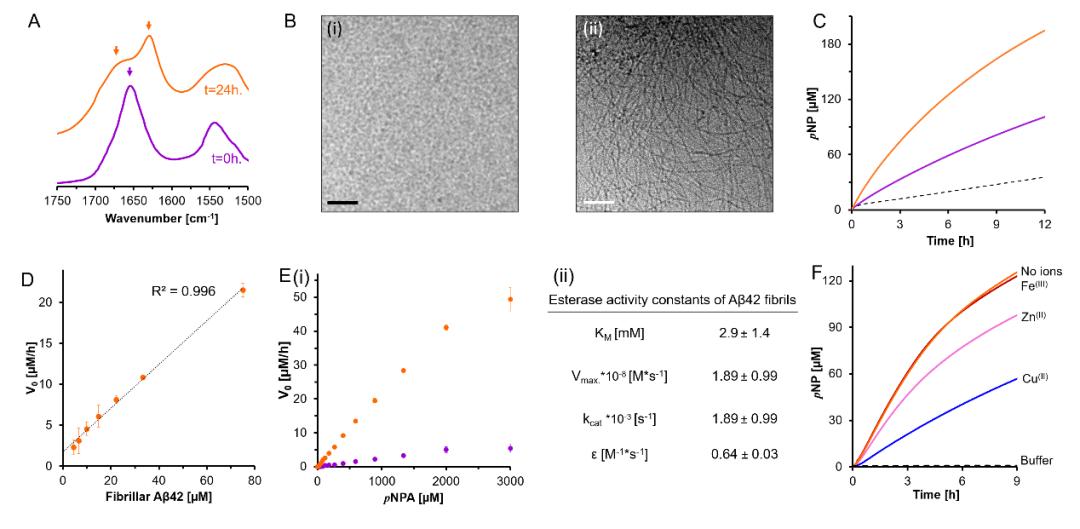
图2:Aβ42纤维催化乙酸对硝基苯酯(pNPA)水解活性测试
通过比较不同Aβ纤维亚结构域(subdomains)的催化活性,文章对Aβ42催化活性与纤维组织的组成结构之间的关系也进行了研究。图3A为Aβ42的氨基酸序列和构象特性。TEM照片(图3B)以及CD光谱(图3C)证实了三种Aβ纤维(Aβ1-42,Aβ16-22,Aβ1-22)的不同结构。进一步的催化测试可以看出,Aβ42纤维的催化活性显著高于Aβ16-22以及Aβ1-22(图3D,E),这表明Aβ42纤维的催化活性不仅与纤维状结构相关且很大程度上还取决于纤维表面的化学环境。
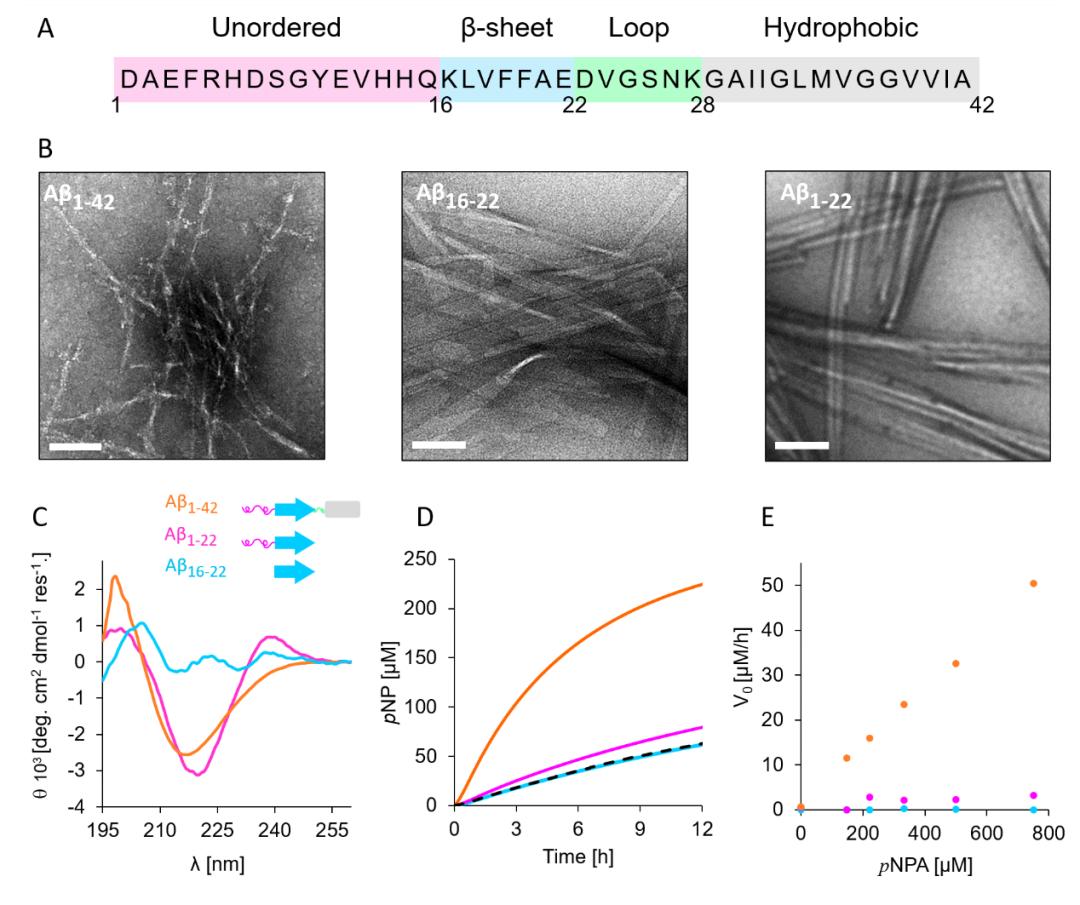
图3:Aβ42衍生物的催化活性测试
作者进一步还选取了与神经退行性疾病相关的其他生物反应,如乙酰胆碱水解,多巴胺及肾上腺素氧化反应,对Aβ42纤维的催化性能进行了拓展测试。首先,根据胆碱能假说,乙酰胆碱调制的信号传导阻断被认为是导致AD的病理学原因之一;其次,氧化应激与AD患者的神经元细胞损伤有关,多巴胺氧化也被报道发生于AD-受损的大脑区域中。且黑色素衍生物(多巴胺氧化产物)的增加也被认为是AD病理学原因之一。催化结果表明,三种反应中Aβ42纤维均展现出显著高于Aβ42单体的催化活性(图4)。值得注意的是,在多巴胺和肾上腺素氧化中发生了明显的滞后现象(图4B.ii和4C.ii),这意味着该反应的决速步并非氧化,而是吸附依赖的。对于Aβ42纤维而言,一方面,其亲核侧链有利于邻苯二酚转化为醌以及迈克尔加成反应;另一方面,其较强的疏水性有利于吸附多巴胺和肾上腺素,增加其局部浓度和稳定醌类疏水异构体。也正是二者之间的协同作用提升了Aβ42纤维的氧化能力。
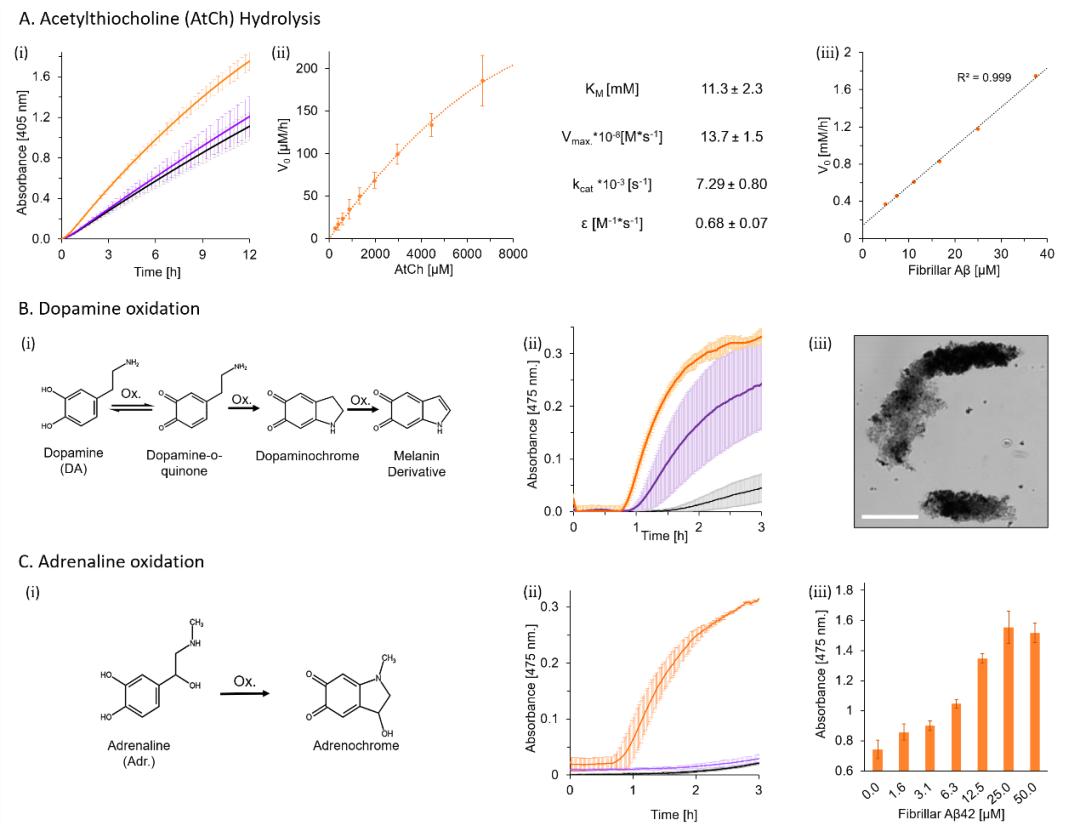
图4:Aβ42的乙酰胆碱酯酶和多巴胺氧化酶活性
讨论
实验结果表明,Aβ42纤维在多种反应中均表现出催化活性。这可归因为Aβ42纤维组装体的组成和结构特征。具体地,富β-折叠的Aβ42由14个疏水残基尾部组成,而疏水序列有助于催化活性;Aβ42的亲水序列包含亲核侧链和组氨酸残基,而二者都与酶活性位点密切相关。此外,Aβ42的催化活性与其纤维组织和形成纤维表面化学环境的特定序列也息息相关,因为无论是Aβ42单体,纤维前体抑或是具备纤维结构的Aβ16-22和Aβ1-22均表现出较差的催化活性。
对酶而言,其催化活性主要取决于活性比表面积以及结合位点的灵活性,而Aβ42纤维二者兼具,这也使其具备类酶的催化活性。但与酶不同的是,淀粉样纤维斑块倾向于多形态,酶催化中的锁-钥学说可能并不适用。此外,本文报道的纤维的催化特性尚未在实际细胞和神经元组织中得到证实,相关研究正在进行。
综上,本文首次证实了成熟的Aβ42纤维具有催化活性,包括催化pNPA水解、乙酰胆碱水解以及多巴胺氧化等。且Aβ42纤维比Aβ42单体,寡聚体以及亚结构域展现出更强的催化活性,或揭示Aβ42纤维可能加速多种生物反应和病理生理过程,具有重要的生物学和治疗意义。
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Chem Catalysis上,点击“阅读原文”查看论文
▌论文标题:
β-Amyloid fibrils catalyze neurotransmitter degradation
▌论文网址:
https://www.cell.com/chem-catalysis/fulltext/S2667-1093(21)00136-6
▌DOI:
https://doi.org/10.1016/j.checat.2021.07.005
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。
CellPress细胞出版社
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




