- +1
【科技前沿】张宏团队综述自噬小体成熟的分子机制、调控和病生理意义
细胞在生命过程中,面临着各种各样内源或外源的应激,包括蛋白折叠错误、细胞器损伤、外源营养匮乏和病原入侵等【1-3】。自噬(autophagy)是细胞应对这些应激的重要手段。自噬通过在胞质中形成双层膜结构,包裹待清除物质,并运送到溶酶体(lysosome)降解。在多细胞生物中,新形成的自噬小体在与溶酶体融合前,通过与内吞溶酶体途径不同阶段的囊泡,如早期内吞体(early endosome)、晚期内吞体(late endosome)融合形成自噬内吞体(amphisome),此过程被称为自噬小体成熟(autophagosome maturation)【4】。自噬小体成熟受细胞营养状态和应激信号途径的精确调控,此过程异常导致细胞内累积大量受损细胞器和有毒蛋白聚集体,同时也会影响内吞系统功能。自噬小体成熟障碍与多种人类疾病的病理过程密切相关,如神经退行性疾病、肿瘤和肌肉疾病等【4,5】。多种病毒和细菌也通过影响自噬小体成熟来抑制溶酶体的降解功能,逃避宿主的清除【6-9】。
2021年7月23日,中国科学院生物物理研究所张宏研究员、法国巴黎大学的Patrice Codogno教授和南方科技大学生命科学院的赵燕教授在Nature Reviews Molecular Cell Biology杂志上发表题为:Machinery, regulation and pathophysiological implications of autophagosome maturation 的综述文章。此文章首先全面概括了近年来在自噬小体成熟分子机制方面的研究进展,接下来详细论述了自噬小体成熟异常与人类疾病发生发展的关系,以及病毒和细菌干扰自噬小体成熟的机理,最后系统总结了调控自噬小体成熟治疗人类疾病的潜在靶点。

一、介导自噬小体融合的分子机理
自噬小体与不同阶段内吞体和溶酶体融合的过程由RAB蛋白、栓系蛋白和SNARE复合体协同参与。融合过程主要由两组SNARE蛋白介导,包括自噬小体上的STX17(Qa)、SNAP29(Qbc)和晚期内吞体/溶酶体上的VAMP8(R)以及自噬小体上的YKT6、SNAP29(Qbc)和晚期内吞体/溶酶体上的STX7。目前研究也发现了多个介导融合过程的栓系蛋白,包括HOPS复合体、EPG5和PLEKHM1等(见图1)。多组/种SNARE复合体和栓系蛋白参与自噬小体过程,提示这些因子之间可能存在互相代偿作用,也可能在自噬小体成熟的不同阶段发挥功能,和/或介导自噬小体与不同亚群的内吞/溶酶体之间的融合。
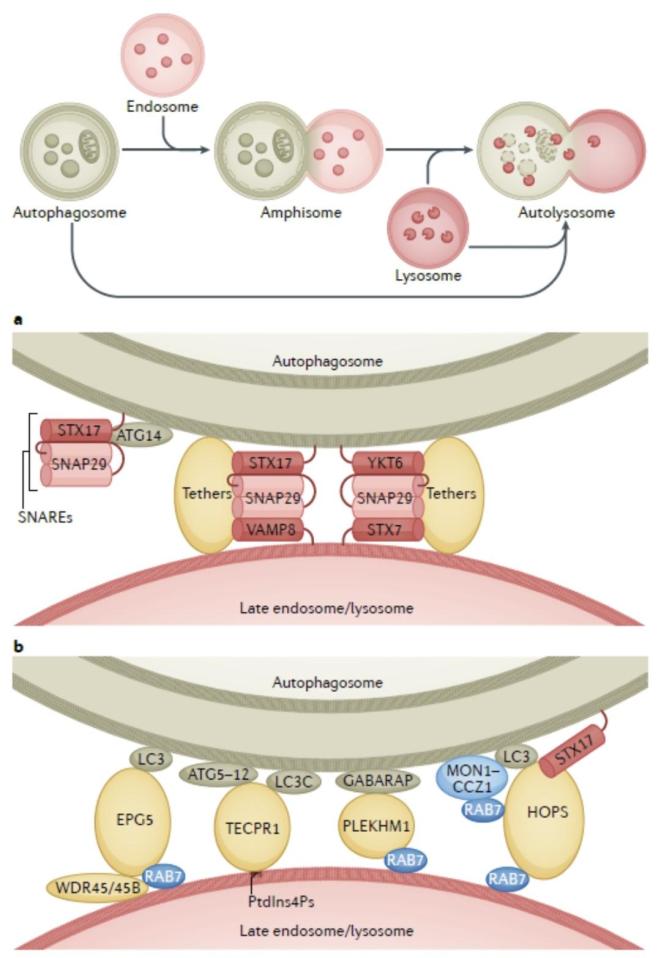
图1. SNARE、栓系蛋白和RAB蛋白介导自噬小体成熟
二、自噬小体成熟过程中的囊泡运输
在非极性细胞中,自噬小体在细胞质的不同区域形成,而溶酶体主要位于核周区域。因此两种囊泡结构的融合需要微管动力蛋白参与的相向运动,自噬囊泡需经过动力蛋白(dynein)介导的反向运输,溶酶体则需经过驱动蛋白(kinesin)介导的正向运输。参与此过程的分子如图2所示。
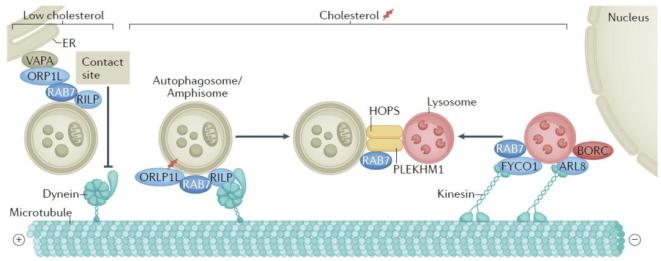
图2. 介导自噬囊泡与晚期内吞体/溶酶体运输和融合的偶联机制
三、自噬小体成熟的调控
自噬过程的调控是多层次、多水平的,自噬小体的形成受到了多条细胞外应激和细胞内信号转导途径的调控,如mTOR和AMPK途径。自噬小体的成熟过程也受到细胞营养和压力状态等多种信号的动态调控。由于介导成熟过程的分子多样且具有一定代偿性,也为这一过程的调控提供更多灵活性(见图3)。
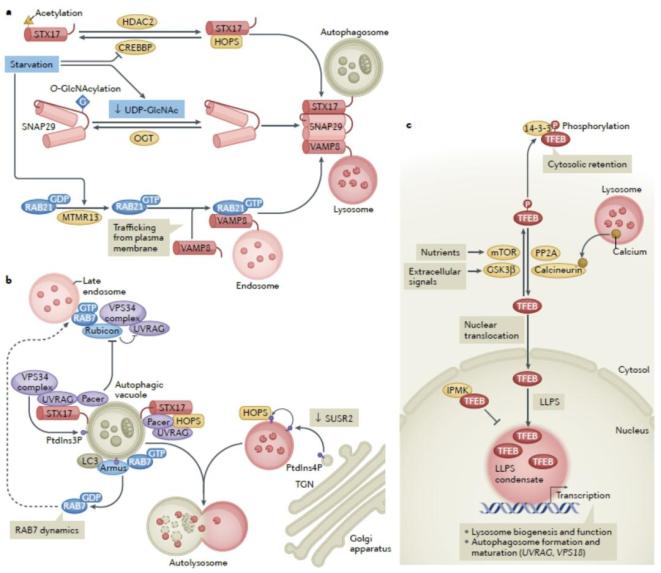
图3. 自噬小体成熟的调控机理
四、自噬小体成熟与人类疾病
自噬溶酶体的降解异常与多种人类疾病的病理过程密切相关,包括神经退行性疾病、肿瘤和肌肉疾病等。自噬小体成熟异常不但会造成有毒蛋白质聚集体和受损细胞器累积,另一方面,无功能的自噬内吞体、自噬溶酶体和异常形成的囊泡会造成内吞系统异常,进一步导致病理情况恶化。自噬小体成熟不同阶段异常导致的神经退行性疾病如图4所示。
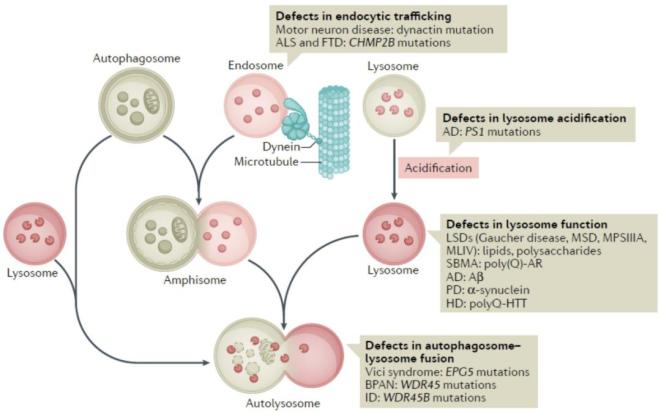
图4. 自噬小体成熟异常与神经退行性疾病
五、自噬小体成熟与病原体感染
自噬可以包裹外源入侵的病原体并将其运输到溶酶体清除,此过程也被称为异源自噬(xenophagy)。此过程可以辅助抗原呈递,进而促进天然和获得性免疫。为了逃避自噬过程,病原体也进化出了各种机制抑制自噬小体的形成和/或成熟(见图5)。某些病原体不但可以阻断自噬小体成熟,还能利用这些自噬结构完成自身的复制以及释放。
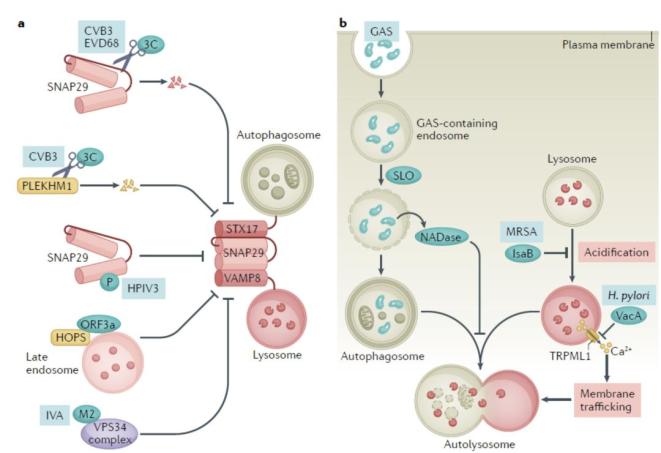
图5. 病原体抑制自噬小体成熟的机制
六、自噬小体成熟过程的治疗靶点
自噬过程的不同阶段都可能作为药物研发的潜在靶点。自噬小体形成的调控,主要包括ULK1/VPS34抑制剂和活化剂,如Tat-beclin 1。靶向自噬小体的成熟阶段的药物设计策略,包括针对介导融合的因子开发抑制剂或活化剂,针对自噬和溶酶体相关基因转录调控开发(如TFEB途径的调控剂),以及改变溶酶体活性的亲溶酶体药物开发(见表1)。
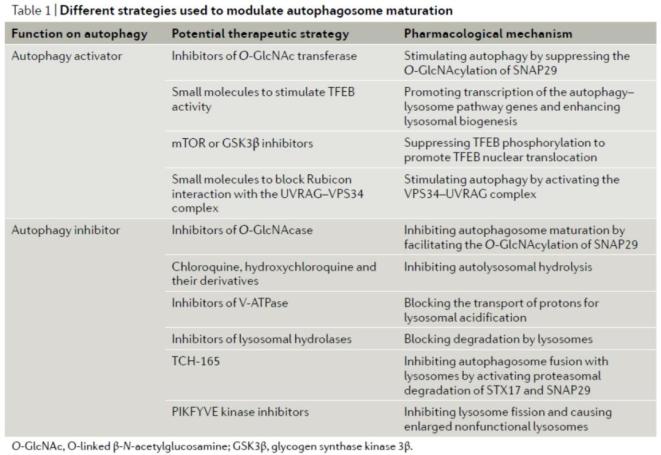
表1. 调控自噬小体成熟的治疗策略
未来展望
自噬小体的正常成熟是实现自噬溶酶体降解功能的前提,是自噬过程的关键阶段,同时也是调控自噬活性的重要环节。虽然我们已经对自噬小体成熟阶段的分子机制积累了一定的认识,但不同细胞和生理病理条件下,内吞溶酶体囊泡的分布、运输和功能存在很大差异,这就需要不同SNARE和栓系蛋白等融合因子合作完成。因此,我们尚需深入研究自噬小体成熟机制的组织及细胞特异性以及病生理状态的差异。
另一方面,目前虽然体外已有很多成熟的方法来检测自噬通路的活性,但是仍然缺乏可靠的方法检测体内自噬活性,自噬小体成熟的检测方法也无法应用于人体。因此为了筛选针对自噬通路的药物,亟待开发可信且适合高通量筛选的自噬活性生物标志物。
原文链接:
https://www.nature.com/articles/s41580-021-00392-4.pdf
参考文献
1. Feng, Y.C., He, D., Yao, Z.Y. & Klionsky, D.J. The machinery of macroautophagy. Cell Res. 24, 24-41 (2014).
2. Lamb, C.A., Yoshimori, T. & Tooze, S.A. The autophagosome: origins unknown, biogenesis complex. Nat. Rev. Mol. Cell Biol. 14, 759-774 (2013).
3. Nakatogawa, H. Mechanisms governing autophagosome biogenesis. Nat. Rev. Mol. Cell. Biol. 21, 439-458 (2020).
4. Zhao, Y.G. & Zhang, H. Autophagosome maturation: An epic journey from the ER to lysosomes. J. Cell Biol. 218, 757-770 (2019).
5. Jiang, P.D. & Mizushima, N. Autophagy and human diseases. Cell Res. 24, 69-79 (2014).
6. Choi, Y., Bowman, J.W. & Jung, J.U. Autophagy during viral infection - a double-edged sword. Nat. Rev. Microbiol. 16, 341-354 (2018).
7. Deretic, V., Saitoh, T. & Akira, S. Autophagy in infection, inflammation and immunity. Nat. Rev. Immunol. 13, 722-737 (2013).
8. Kimmey, J.M. & Stallings, C.L. Bacterial Pathogens versus Autophagy: Implications for Therapeutic Interventions. Trends Mol. Med. 22, 1060-1076 (2016).
9. Levine, B., Mizushima, N. & Virgin, H.W. Autophagy in immunity and inflammation. Nature 469, 323-335 (2011).
本文转载自公众号“BioArt”(BioGossip)
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【科技前沿】张宏团队综述自噬小体成熟的分子机制、调控和病生理意义》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




