- +1
【十院科研】发现常用静脉麻醉药丙泊酚或致肿瘤侵袭/转移增加
麻醉药物广泛应用于外科手术或相关临床检查,然而长久以来麻醉药物对患者脑功能和肿瘤复发转移的影响一直存在争议。上海市第十人民医院精神心理科主任、同济大学医学院麻醉与脑功能研究所常务副所长申远教授与美国哈佛大学麻省总院老年麻醉实验室主任谢仲淙教授的合作团队,历经两年的探索研究,通过一系列体内、体外实验,从分子、蛋白、组织等多层面证实,常用静脉麻醉药丙泊酚(propofol)或使肿瘤侵袭/转移增加。相关论文于2021年7月15日在《先进科学》(Advanced Science,IF:16.08)在线发表,该发现对于麻醉学、肿瘤学和外科学等领域均具有非常重要的临床意义。
该团队近年来一直致力于探索麻醉药与阿尔兹海默症(Alzheimer’s disease, AD)神经病理机制以及肿瘤发生、发展之间的关联。在前期细胞毒理的实验中,研究人员观察到临床广泛使用的静脉麻醉药丙泊酚可使肿瘤细胞对血管内皮的黏附能力显著增高。循环肿瘤细胞(Circulating tumor cells ,CTCs)被认为是手术后肿瘤转移复发的主要因素,而循环肿瘤细胞和血管内皮细胞的黏附可以促使肿瘤细胞突破血管侵袭到组织中。因此,这一发现立即引起了研究团队的兴趣和重视:丙泊酚如果能增强肿瘤细胞的黏附能力,那么它究竟能否影响循环肿瘤细胞从而促进肿瘤的侵袭转移呢?麻醉、肿瘤和脑功能之间究竟存在着怎样的相互作用呢?带着这一系列的疑问,研究人员开启了为期二年的探索过程。
研究人员以结肠癌细胞为主要研究对象,通过对小鼠尾静脉注射结肠癌细胞的同时注射丙泊酚进行建模,模拟临床围术期中丙泊酚与血管内循环肿瘤细胞接触的过程。小鼠实验结果进一步说明,丙泊酚有可能增加结肠癌细胞的侵袭转移潜能,造成肺部远处转移(见图1)。
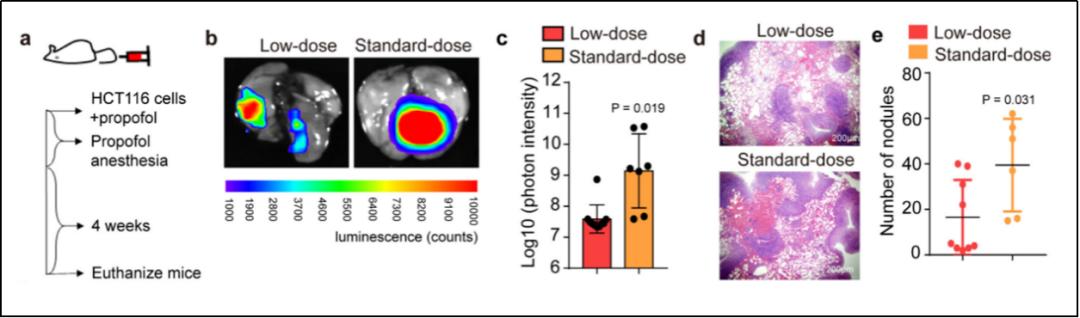
图1|标准剂量(standard-dose)丙泊酚促进结肠癌细胞在小鼠肺部的转移
丙泊酚是一种γ-氨基丁酸 ( γ-Aminobutyricacid,GABA ) A受体(GABAaR)激动剂。那么,丙泊酚促进结直肠癌肺转移的作用是否是通过激动GABAaR实现的呢?研究团队紧接着使用另一种GABAaR特异性激动剂Muscimol体外预处理肿瘤细胞后再注射入体内,同样也在小鼠肺部也发现了肿瘤转移灶的增加,初步锁定了GABAaR在其中的作用。
对血管内皮细胞的成功粘附是循环肿瘤细胞发生转移的关键环节。接下来,研究人员采用同样的体外预处理方法观察了更多肿瘤细胞,包括肺癌、子宫内膜癌细胞等,发现相对于对照组,丙泊酚能使更多的肿瘤细胞黏附到血管内皮细胞(见图2),并伴随更大的伸展面积和更多的黏着斑形成。反之,使用GABAaR拮抗剂(Bicuculine)或利用CRISPR/Cas9技术敲除GABAaR 部分亚基(β3,δ)则可阻断丙泊酚对肿瘤细胞对血管内皮细胞粘附的促进作用。这些数据进一步夯实了丙泊酚通过激动GABAaR而增强了肿瘤细胞对血管内皮细胞的黏附能力,并可能因此增加了肿瘤细胞在肺部的转移定植的科学假说。
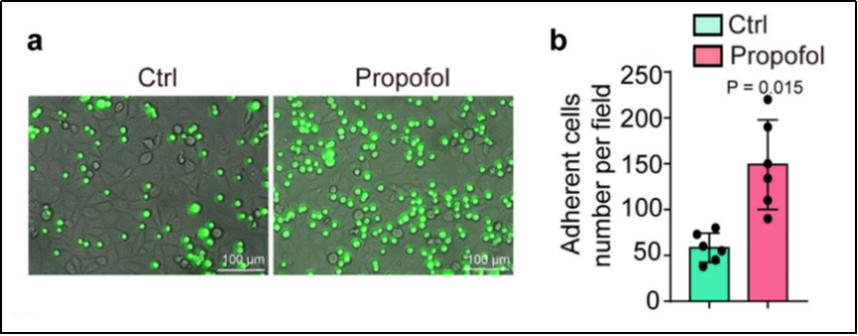
图2|丙泊酚能促进肿瘤细胞对血管内皮细胞的黏附能力
研究人员据此进一步锁定了研发抗癌药物的重要靶标、同时也是介导细胞黏附的重要原癌基因——Src激酶。研究证明,丙泊酚促进肿瘤细胞黏附和伸展的效应是通过GABAaR抑制Src泛素化,导致Src表达上调所产生的。由此进一步锁定了同样与肿瘤细胞相关,并与细胞骨架蛋白相互作用的E3泛素连接酶基因TRIM21,发现TRIM21很可能介导了丙泊酚通过GABAaR对Src调控的上游机制。为验证这一关键假说,研究人员通过体内试验进一步证实Src的选择性抑制剂蛋白磷酸化酶2 (protein phosphatase 2,PP2)可使丙泊酚或GABAaR激动剂muscimol造成的体外预处理的结肠癌肺细胞在小鼠肺部的转移结节明显减少。
综上所述,本研究通过一系列体内、体外实验,从分子、蛋白、组织等多层面证实,丙泊酚可能通过调节GABAaR/TRIM21/Src信号通路促进肿瘤细胞在肺部的转移(见图3)。该发现对于麻醉学、肿瘤学和外科学等领域均具有非常重要的临床意义。
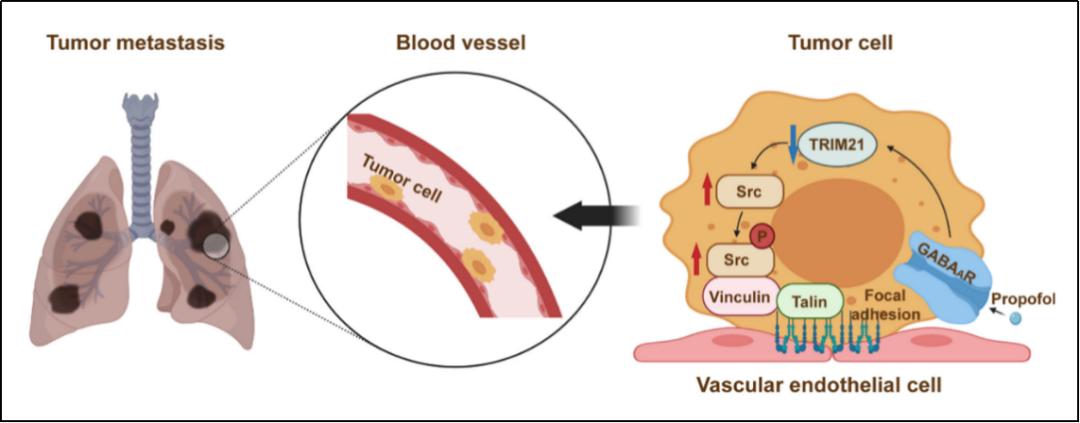
图3|丙泊酚可能通过调节GABAaR/TRIM21/Src信号通路促进肿瘤细胞在肺部的转移
与此同时,研究团队也表示,尽管建立了不同剂量标准丙泊酚诱导下的细胞和动物模型,依然无法完全模拟临床麻醉手术过程,尤其是缺乏不使用麻醉药物做对照组的肿瘤切除小鼠模型,即肿瘤自发转移模型。因此,研究者们特别强调本研究的发现并不代表临床上使用丙泊酚一定会导致患者的肿瘤复发转移增加。该研究旨在唤起研究领域的同行们的共同关注,以促进临床环境中对麻醉与肿瘤转移相关性的更多研究。
除上述结果外,该团队近年来在麻醉、肿瘤和脑功能领域持续不断深入探索,初步发现了麻醉、AD等疾病与肿瘤发生发展的相互影响,后续研究中将进一步阐明三者之间的相互作用机制,期望最终能将基础科研结果用于临床,改善患者的预后和临床结局。
本研究全部在同济大学医学院麻醉与脑功能研究所实验室进行,主要实验工作由脑功能研究所博士后刘起东博士(现任同济大学助理教授),同济大学硕士研究生盛志豪、博士研究生程淳、中国医学科学院附属肿瘤医院麻醉科主任郑晖教授(均为共同第一作者)完成;哈佛大学附属麻省总医院胸外科Michael Lanuti 副教授、Rong Liu 讲师以及同济大学医学院副院长王平教授参与了本研究部分工作。此外,实验过程中得到了同济大学医学院郑加麟院长,研究生院章小清副院长及康九红教授的大力支持。本文的通讯作者为同济大学附属上海第十人民医院精神科主任、麻醉与脑功能研究所常务副所长申远教授和哈佛大学Henry K. Beecher冠名主任教授谢仲淙。
同济大学医学院麻醉与脑功能研究所于2017年9月由上海市第十人民医院牵头成立并投入建设,旨在拓展麻醉学科与国内外一流院所同行的学术交流,深化与神经认知科学等相关前沿学科的全面合作。成立3年多来,在麻醉毒理、麻醉与AD、麻醉与肿瘤机制方面开展了前沿性工作,已发表论文近20篇,获批国家自然基金重点项目、青年项目、博士后基金等多项国家级课题资助。
专家述评
随着麻醉学向围术期医学转变,研究麻醉及围术期处理对手术后结局的影响成为新的研究热点,麻醉及麻醉药对肿瘤手术患者的预后是近年来的关注点。以往的研究发现麻醉药能影响中枢神经系统, 造成认知功能障碍。但麻醉药与肿瘤发生发展的关系尚不明确。麻醉药究竟促进或抑制肿瘤细胞增殖?对其侵袭转移能力是否有影响?麻醉药对肿瘤的影响和对中枢神经系统之间有没有相关性?这些重要的临床问题都有待深入探索。
在刚刚发表于《Advanced Science》杂志的研究中,同济大学、美国哈佛大学等研究团队通过一系列严谨的实验和详实的科学证据,揭示了目前临床广泛使用的静脉麻醉药物丙泊酚有可能促进肿瘤细胞的局部黏附和侵袭能力,并造成远处肺转移增加。但是,这些发现仅是一个开始,尚需更多研究观察在临床上丙泊酚是否真正影响肿瘤病人最终的结局。麻醉与肿瘤之间的关联尚未得到足够的重视,其深层机制更存在巨大的盲区。因此,本研究结果对麻醉学科的临床实践和科学研究有着重要意义。对于这些科学问题的解答不仅关系着临床上庞大的肿瘤手术患者的长期结局;更为重要的是,这些研究揭示了麻醉、肿瘤和大脑之间潜在的相互作用及复杂机制。未来麻醉学科的关注重点应该拓展到更加广泛的领域,增强与神经科学、肿瘤学甚至其他相关学科的交叉合作,共同探索这些重要的临床问题。
——同济大学脑功能与人工智能转化研究所所长,同济大学附属上海第四人民医院院长 熊利泽 教授
专家述评
中国目前在癌症防控方面面临着前所未有的挑战,癌症已成为疾病死因之首位原因,且发病率和死亡率还在逐年攀升,对人民健康和社会经济造成巨大影响。尽管各国研究者对癌症的高危因素进行不断研究,发现了诸多诱发癌症的危险因素,如吸烟、饮酒、高热量食物摄入,以及糖尿病、慢性传染病等;但药物本身尤其麻醉药作为开展临床手术和操作必不可少的药物,其与肿瘤复发转移方面研究仍知之甚少。近年来的实验证据表明,特定麻醉药可能具有“Two sides of a coin”的特性,麻醉导致的生理紊乱可能会直接影响残存肿瘤细胞的命运。比如,在这些肿瘤细胞进入循环系统之后(CTCs),是否可以形成难以检测的亚临床微转移病灶。
丙泊酚是目前静脉麻醉诱导、维持及镇静的首选用药之一,它有没有促进肿瘤侵袭转移的风险?如果有,该如何对其进行干预和控制呢?带着这两个科学问题,同济大学和美国哈佛大学等研究团队合作构建了一系列细胞和动物模型开展探索性研究。明确了丙泊酚可以直接增强结肠癌细胞的肺部转移潜能;并在机制研究中发现,丙泊酚促进侵袭转移的机制并非通过调节免疫微环境这一常规途径,而是直接靶向肿瘤细胞表面的GABAaR受体。换言之,丙泊酚实现神经麻醉作用和诱导肿瘤转移的功能在分子机制上是一致的。在肿瘤细胞中,丙泊酚通过GABAaR进一步激活TRIM21和Src,调控肿瘤细胞和血管内皮之间的黏附作用,最终促进肿瘤突破血管侵袭到组织。该工作不仅首次解析了丙泊酚影响患者肿瘤的复发转移的作用和机制,还验证了使用GABAaR拮抗剂和Src抑制剂减少肿瘤细胞肺转移的可行性,为进一步的药物干预策略提供了优化方向,对麻醉-肿瘤领域具有非常重要的临床意义。
——复旦大学附属肿瘤医院胆胰外科副主任、主任医师、博士生导师 刘亮 教授
长
按
关
注
原标题:《【十院科研】发现常用静脉麻醉药丙泊酚或致肿瘤侵袭/转移增加》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




