- 3
- +11
【学术前沿】李咏生、吴永忠团队发表综述《炎症与肿瘤进展:信号通路与靶向干预》

BioArtMED
BioArt姊妹号。关注医学最前沿,提高科学新认知,聚焦人类大健康。
公众号
早在19世纪中页,德国病理学家Rudolf Virchow发现肿瘤组织中有大量炎症细胞的浸润,提出肿瘤起源于慢性炎症的猜想。目前医学界已明确炎症与癌症发生、发展及抗癌治疗的疗效密切相关。例如,胃癌与幽门螺旋杆菌感染相关,鼻咽癌与疱疹病毒感染相关,肝癌与肝炎病毒感染相关;肥胖及抑郁等系统性炎症亦与肿瘤的发生率及抗癌治疗疗效不佳相关;同时治疗诱发的炎症反应也在不同程度上影响肿瘤的临床治疗效果。尽管一些抗炎药(阿司匹林、他汀类药物)可显著降低癌症发病率及死亡危险;但一些促炎细胞因子或刺激物(TNF-α、cGAS-STING通路激活剂)可以促进免疫细胞向感染组织渗透、进而显著提高肿瘤治疗的效果,这表明炎症是把“双刃剑”。如何调控炎症以改善癌症治疗的疗效,仍然是当前国际前沿领域的重要科学问题。
近日,重庆大学附属肿瘤医院李咏生、吴永忠团队在 Signal Transduction and Targeted Therapy杂志发表了题为Inflammation and tumor progression: signaling pathways and targeted intervention的长篇综述论文。据悉,该综述共计5万余字,引文906篇,从炎症的启动与消退过程入手,系统阐述了炎症与肿瘤发生、发展及治疗之间的复杂关系,深入解析了促癌和抑癌的炎症类型,并详细讨论了靶向调控炎症在肿瘤治疗中的干预策略。

炎症可分为急性炎症和慢性炎症,急性炎症是身体对受损细胞、病毒和其他有害刺激的自然防御,它快速启动并帮助身体自愈,急性炎症的过程短暂,通常会在短时间内消退。在该过程中,涉及人体的白细胞、淋巴细胞及其产生的化学物质,如抗体和细胞因子等被释放到血液或受影响的组织中,对抗外来病原体或炎性刺激。炎症的消退不是被动的炎症反应的终止,而是在炎症发生后最初数小时内即启动的,由多种细胞和抗炎因子、促消退介质(Specialized Proresolving Mediators, SPM)共同参与的主动的程序化过程;一旦炎症无法及时消退,则转变为慢性炎症,可能会诱发包括恶性肿瘤在内的一系列炎症疾病。
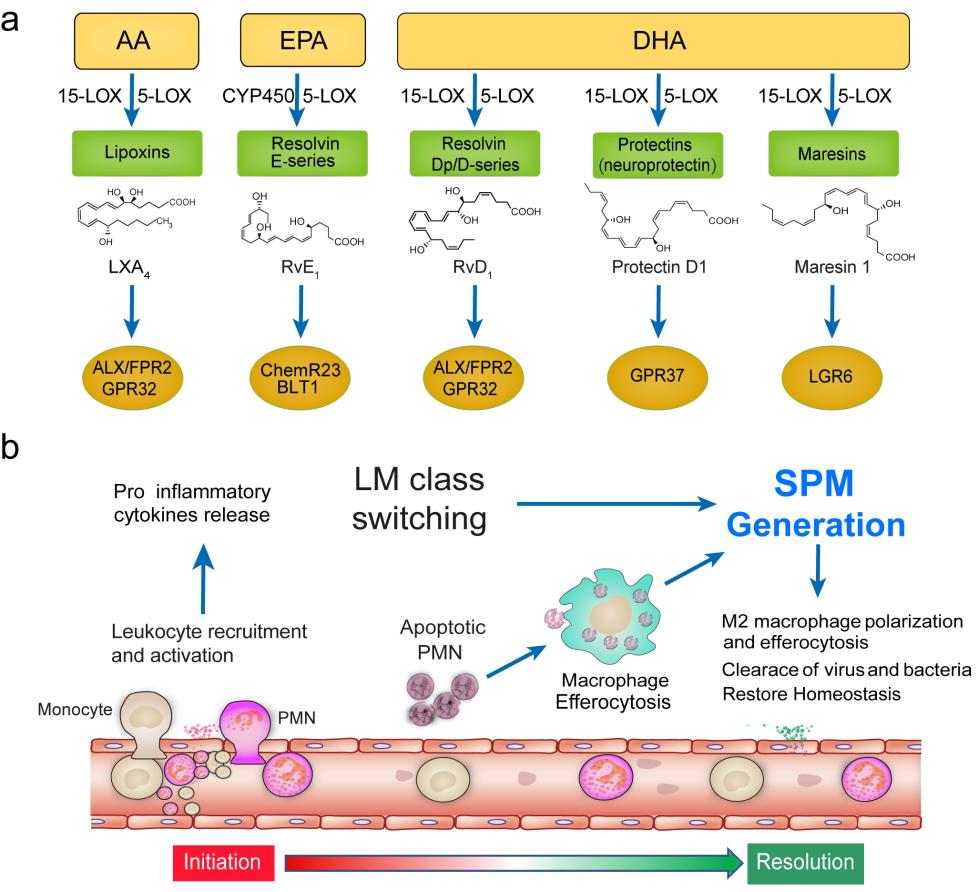
图1. SPM的生物合成及其在炎症消退中的作用
炎症不仅能促进免疫响应,也可以导致免疫抑制。炎性反应中的固有免疫及适应性免疫在肿瘤发生、进展及转移中扮演着重要的角色。一方面,急性炎症中大多数的炎性细胞可杀灭病原、促进组织修复、阻止肿瘤生长;并且利用刺激物和炎性因子可激活免疫系统,进而发挥抑癌的作用。另一方面,慢性炎症产生的细胞因子通过诱导基因突变、改变癌基因和抑癌基因表达和转化、抑制细胞凋亡,诱导血管新生,造成炎症信号传导通路异常;并且慢性炎症通过募集多种免疫抑制性细胞(M2-TAMs、MDSC、Treg等)促进免疫抑制肿瘤微环境(TME)的建立,促进肿瘤的发生和发展。此外,系统性慢性炎症(肥胖、抑郁等)以及治疗诱发的慢性炎症亦通过影响免疫系统,进而促进肿瘤的发生和发展。
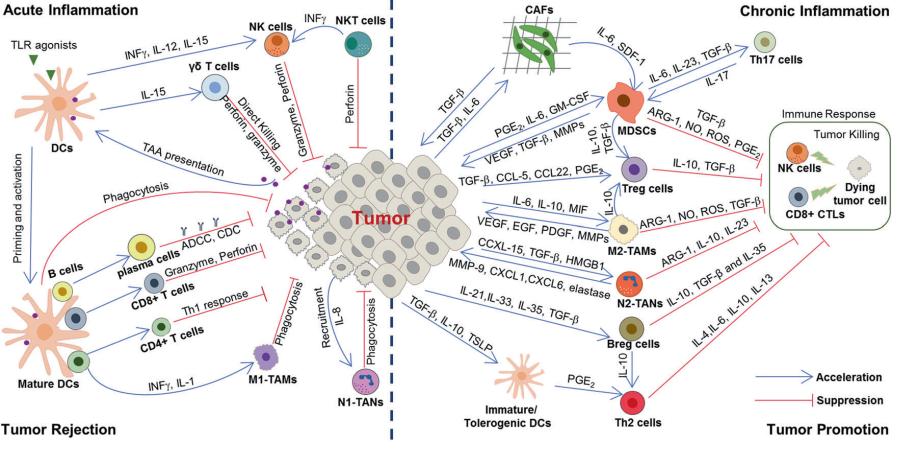
图2. 炎症与肿瘤进展的关系
慢性炎症已被证实是肿瘤的发生和发展的元凶之一。首先,使用非特异性的抗炎药(非甾体抗炎药、他汀类、糖皮质激素、具有抗炎活性的天然产物、SPM)在早期阶段可抑制慢性炎症,阻止肿瘤的发生、并提高其他疗法对肿瘤细胞的杀伤作用。其次,针对肿瘤发生及治疗过程中产生的某些特异性炎性介质,可采用抗体中和或靶向抑制炎性信号通路的方法。此外,靶向免疫抑制TME中的免疫细胞及炎性介质、细胞因子,有助于打破免疫抑制TME,提高化疗、放疗、免疫治疗等抗癌疗法的效果。另一方面,由于“冷肿瘤”——肿瘤组织中没有或者只有很少的免疫细胞,对免疫治疗几乎没有响应。而通过重组细胞因子、TLRs激活剂、cGAS-STING通路激活剂等诱导急性炎症反应,可有效促进炎性细胞及效应性免疫细胞浸润入肿瘤组织,改变促癌TME为抗肿瘤免疫,进而增强化疗、放疗、免疫治疗等抗癌疗法的疗效。
如今,许多旨在评估炎症调节剂在癌症预防和治疗中的疗效的临床试验正在进行。一方面,单一使用抗炎药物的疗法已被证明在癌症治疗中疗效有限;另一方面,炎症调节剂通过与抗癌疗法(化疗、免疫治疗等)协同作用,提高抗癌的疗效。
近年来对炎症与肿瘤关系的深入研究,无论是炎症的起始及消退机制还是其在肿瘤发生发展中的作用,均取得了诸多可喜的研究成果,然而对于如何调控炎症以改善癌症治疗的疗效仍然存在诸多亟待解决的关键问题。例如:如何鉴定影响肿瘤患者炎性TME中最关键的驱动因素,如何避免抗癌疗法诱导急性炎症转变为慢性炎症,如何减少抗癌疗法的严重的炎性副作用(CAR-T疗法诱发炎性风暴)等,是靶向炎症提高抗癌疗效的重要挑战。此外,在抗肿瘤过程中还应考虑到癌症患者不同的炎症反应,针对具有特异性的肿瘤相关炎症采取个性化的治疗策略(精准医疗)将有助于提高抗癌疗效。
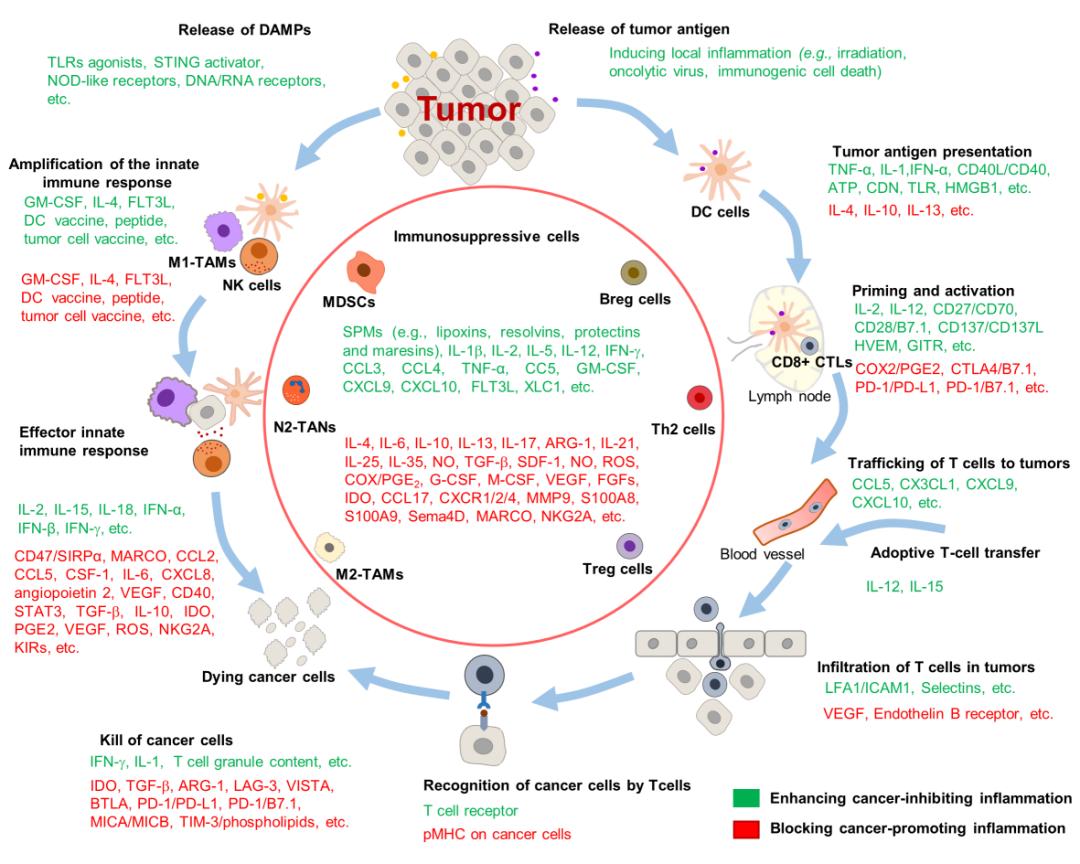
图3. 干预炎症治疗肿瘤的方式
重庆大学附属肿瘤医院肿瘤内科赵化侃、吴磊、颜桂芳、周明月、陈瑜为论文的共同第一作者,李咏生教授与吴永忠教授为共同通讯作者。
原文链接:
https://www.nature.com/articles/s41392-021-00658-5
参考文献
1. Zhao, H., Wu, L, Yan, G., Chen, Y, Zhou, M., Wu, Y. & Li, Y. Inflammation and tumor progression: signaling pathways and targeted intervention. Signal Transduct Target Ther 6, (1): 263 (2021).
2. Grivennikov, S. I., Greten, F. R. & Karin, M. Immunity, inflammation, and cancer. Cell 140, 883–899 (2010)
3. Serhan, C. N., Chiang, N. & Van Dyke, T. E. Resolving inflammation: dual antiinflammatory and pro-resolution lipid mediators. Nat. Rev. Immunol. 8, 349–361 (2008)
4. Zhang, Q., Zhu, B. & Li, Y. Resolution of cancer-promoting inflammation: a new approach for anticancer therapy. Front. Immunol. 8, 71 (2017).
5. Hou, J., Karin, M. & Sun, B. Targeting cancer-promoting inflammation - have anti-inflammatory therapies come of age? Nat. Rev. Clin. Oncol. 18, 261-279 (2021).
6. Ritter, B. & Greten, F. R. Modulating inflammation for cancer therapy. J. Exp. Med. 216, 1234–1243 (2019)
7. Liu, Y. et al. Gasdermin E-mediated target cell pyroptosis by CAR T cells triggers cytokine release syndrome. Sci. Immunol. 5, eaax7969 (2020).
8. Yang, Y. Cancer immunotherapy: harnessing the immune system to battle cancer. J. Clin. Invest. 125, 3335–3337 (2015).
来源: BioArtMED

原标题:《【学术前沿】李咏生、吴永忠团队发表综述《炎症与肿瘤进展:信号通路与靶向干预》》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司