- +1
竺淑佳团队揭示人源NMDA受体的门控机制和调节位点
原创 Cell Press CellPress细胞科学

生命科学Life science
2021年6月28日,中国科学院脑科学与智能技术卓越创新中心竺淑佳研究员团队在Cell Press细胞出版社期刊Neuron上发表了一篇题为“Gating mechanism and a modulatory niche of human GluN1-GluN2A NMDA receptors”的新论文,研究了人GluN1-GluN2A NMDA受体的门控机制和调节位点。
摘要
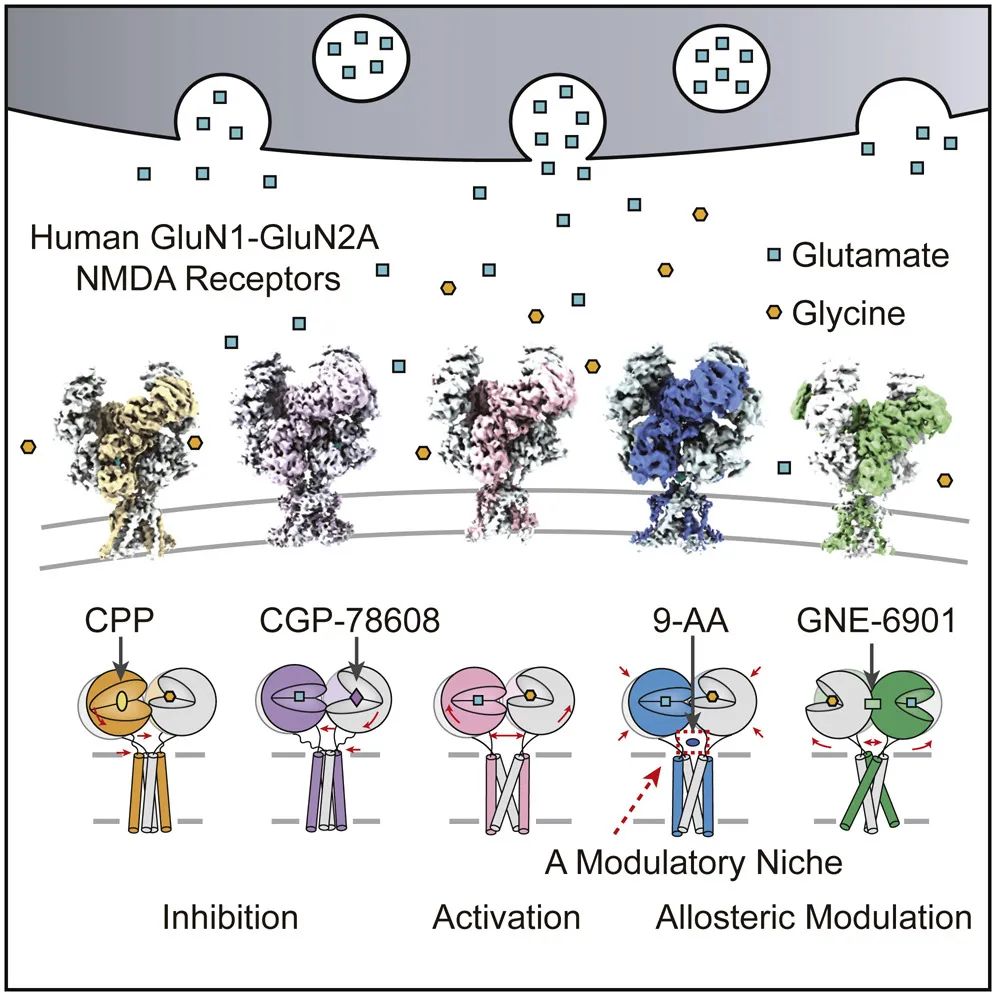
N-甲基-D-天门冬氨酸(NMDA)受体是谷氨酸(Glu)门控的钙高通透离子通道,对突触传递和突触可塑性起到重要调节作用。在此,我们报道了一系列人源GluN1-GluN2A亚型NMDA受体与不同小分子结合的冷冻电镜(cryo-EM)结构,总体分辨率达4Å。在全长GluN1-GluN2A受体的电子云密度图中,我们可以直接观察到结合在GluN1和GluN2A亚基配体结合域(LBD)上的竞争性拮抗剂。同时我们发现,正向变构调节剂(PAM)的结合缩短了LBD和跨膜结构域(TMD)之间的距离,从而进一步使得门控通道处于开放状态。最有意思的是,我们出乎意料地在LBD-TMD连接区域发现了9-氨基吖啶的结合腔,与传统的NMDA受体通道阻断剂结合位点完全不同。我们的研究为LBD和TMD在通道激活、抑制和变构中的构象转换机制提供了结构信息。
作者专访
Cell Press细胞出版社特别邀请论文作者竺淑佳研究团队进行了专访,请他们为大家进一步详细解读。
CellPress:
NMDA受体在突触前和突触后功能有什么差异?
竺淑佳团队:
NMDA受体广泛存在于兴奋性突触后膜上,领域内对突触后膜上NMDA受体的研究较为深入,但是对突触前膜上的NMDA受体功能研究甚少。有研究发现突触前膜的NMDA受体可以在突触前起到高通滤波的作用,参与突触后膜电位的调节。突触后的NMDA受体接受突触前释放的神经递质(谷氨酸),同时结合突触间隙中游离的甘氨酸来激活通道,以此将化学信号转变为电信号,广泛参与突触信号传递和突触可塑性。
CellPress:
GluN1-GluN2AWT和GluN1-GluN2AEM受体的生物物理特性有什么差异?
竺淑佳团队:
GluN1-GluN2AEM和GluN1-GluN2AWT相比在配体结合域二聚体界面之间引入了一对半胱氨酸的突变,突变后的受体在通道的开放概率和动力学特性都有一定程度的提高。换句话说,该受体就处于一个更加激活的状态。同时我们在GluN1-GluN2AEM受体上截短了C末端结构域来保证受体蛋白纯化时的稳定性,通过电生理实验发现,截短C末端后与野生型受体相比,通道展现更快的脱敏现象。
CellPress:
为什么选择了CPP,CGP-78608,GNE-6901和9-AA进行研究?这些物质在GluN1-GluN2A受体上的作用位点有何不同?
竺淑佳团队:
这些小分子的选择是为了解答GluN1-GluN2A亚型NMDA受体在不同生理学状态下的构象差异。如CPP和CGP-78608分别为NMDA受体GluN2A和GluN1配体结合域的竞争性抑制剂,通过竞争性抑制激动剂来模拟受体处于一个抑制关闭的状态。
GNE-6901是Genentech公司开发的靶向GluN1-GluN2A受体的特异性正向变构调节剂。通过冷冻电镜解析的全长GluN1-GluN2A NMDA受体结构,我们通过全长结构解析发现GNE-6901结合在GluN1和GluN2A二聚体中间(与之前的晶体学结构解析的结合位点一致)。但我们从全长受体的构象变化上说明了正向变构调节剂如何使得门控通道进一步处于相对开放状态。
9-AA的结合区域解析是我们最有趣的发现。9-AA在此前的研究发现中是一种可以将通道锁定在开放构象的通道抑制剂,但是对于其结合位点一直没有直接的证明。我们的研究发现9-AA结合在配体结合域和门控通道之间的铰链区域,该区域此前从未有小分子结合报道。我们通过电生理实验验证了在铰链区的一对谷氨酸的突变会影响9-AA的作用。这个新小分子结合位点的发现丰富了NMDA受体的药理学研究。
CellPress:
正向别构调节剂(PAM)结合全长GluN1-GluN2A受体后对门控通道产生了什么效应?其分子机制如何?
竺淑佳团队:
此前的研究发现,GNE-6901小分子通过作用在由GluN2A亚基组成的NMDA受体上,可以促进CA1锥体神经元的兴奋性突触后电位进而改善脑部功能。冷冻电镜解析的GNE-6901结合的GluN1-GluN2A受体结构分析发现,小分子结合在GluN1与GluN2A亚基配体结合域间二聚体中,同时使得配体结构域的D2 lobe进一步向外打开,这种变化同时也通过铰链区传导到跨膜区,使跨膜区整体向上移动,进而让受体的门控通道处于更加开放的构象。这也是首次在全长NMDA受体上观察到GNE-6901的变构调节机制。
CellPress:
本研究在LBD-TMD连接区域发现了一个9-AA的结合腔,这为之后的研究提供了什么启发?
竺淑佳团队:
在NMDA药理学研究中,N端结构域,配体结合域以及门控通道的跨膜区都发现过不同小分子的结合位点。以往认为,这段LBD-TMD连接区域更多地起到将配体结合域构象变化传递给门控通道的作用。同时,这个铰链区构象的动态性制约了我们对其更加深入的机制研究。
我们首次在这个区域发现了一个全新的小分子结合的调节位点,不仅丰富了NMDA受体功能药理学研究,同时也给研究这个重要铰链区结构域提供了新的结构信息。为将来针对这个铰链区结构域的功能学和结构学研究提供了新的思路和小分子工具。希望这项发现可以推动领域真正理解该结构域在整个NMDA受体门控机制中发挥的重要作用。当然,这个结合位点也为NMDA受体的新药研发提供了新的启示。
CellPress:
在GluN1-GluN2A和GluN1-GluN2B受体之间,竞争性拮抗剂和激动剂引起门控转换的分子机制是否一致?研究如何证明了这一点?
竺淑佳团队:
GluN1-GluN2A与GluN1-GluN2B之间的蛋白同源性较高,但是在已知得到的蛋白结构中仍然存在一些差异。之前有报道使用GluN1-GluN2B解释了其竞争性拮抗剂和激动剂引起门控转换的分子机制,我们进一步通过结构的比较,引入了三个比较参数来量化结构变化(亚基间角度,配体结构域D1-D2距离和D2-门控通道Pore的距离),发现在门控机制的转换方面,GluN1-GluN2A与GluN1-GluN2B之间相对保守。
CellPress:
在解析GluN1-GluN2A NMDA受体与不同配体结合的冷冻电镜(cryo-EM)结构时遇到了哪些困难?团队是如何解决的?
竺淑佳团队:
主要由于GluN1-GluN2A亚型NMDA受体本身通道处于高活性状态,导致蛋白的稳定性不是很好。同时由于受体跨膜区构象异质性高,使得受体跨膜区的电镜密度不是很好。实验中我们导入的一对半胱氨酸突变可以有效地提高蛋白的稳定性,在优化蛋白制备过程后可以得到较为稳定的四聚体蛋白。在冷冻电镜数据处理过程中,我们通过优化电镜数据处理步骤,通过多次优化后最终得到更高分辨率的蛋白结构,为我们的研究提供了更有利的证据。

通讯作者简介

竺淑佳
研究员
竺淑佳,研究员,博士生导师,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)突触蛋白的结构与功能研究组组长。2013年获法国巴黎第六大学神经生物学博士学位,博士论文得到法国教育部最高论文等级评定。2013-2016年分别在法国巴黎高师和美国Vollum研究所从事博士后研究工作。2016年8月加入中科院神经科学研究所,并入选脑科学与智能技术卓越创新中心年轻骨干。入选国家级人才项目及上海市启明星计划。担任中国神经科学学会离子通道与受体分会常委、上海市生物物理学会理事及Neurosci Bull青年编委。主持国家自然科学基金面上项目、国际合作与交流中法项目、中科院先导B专项及上海市市级科技重大专项等基金。以通讯或第一作者在Cell, Neuron, NSMB, PNAS, Cell Rep, Cell Res等期刊上发表多篇研究论文。

研究团队
相关论文信息
论文原文刊载于CellPress细胞出版社旗下期刊Neuron上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Gating mechanism and a modulatory niche of human GluN1-GluN2A NMDA receptors
▌论文网址:
https://www.cell.com/neuron/fulltext/S0896-6273(21)00410-4#%20
▌DOI:
https://doi.org/10.1016/j.neuron.2021.05.031
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




