- +1
《细胞》:不修改DNA序列的表观遗传CRISPR来了,可逆、不脱靶
原创 奇点糕 奇点网 收录于话题#基因编辑21个

CRISPR/Cas9基因编辑技术大家都不陌生了:利用一段单链RNA片段(常见的为single guide RNA,简称sgRNA)将核酸内切酶Cas9引导到目标位点,切断DNA双链,在此基础上即可实现对基因的剪切和编辑。
尽管风头正盛,CRISPR/Cas9的局限性好像也不绝于耳,比如脱靶效应、计划外的DNA片段丢失,以及激活的DNA修复机制可能引起细胞复杂的应激反应等等[1]。
既然基因编辑的目标是调控蛋白质的表达,那么,有没有可能绕过基因,从其他角度实现这个目标呢?

图源 | pixabay
当然可以了。
既然基因先需要转录成为信使RNA,再被翻译生成蛋白质,那么在不影响编码基因的双链DNA的情况下,通过人为控制基因的转录,同样可以达到调控蛋白质表达的效果。
这种新兴的技术,叫做表观遗传编辑,即不直接修改基因序列,而是通过DNA甲基化、组蛋白甲基化和乙酰化等方式,从转录层面调控目标基因表达。
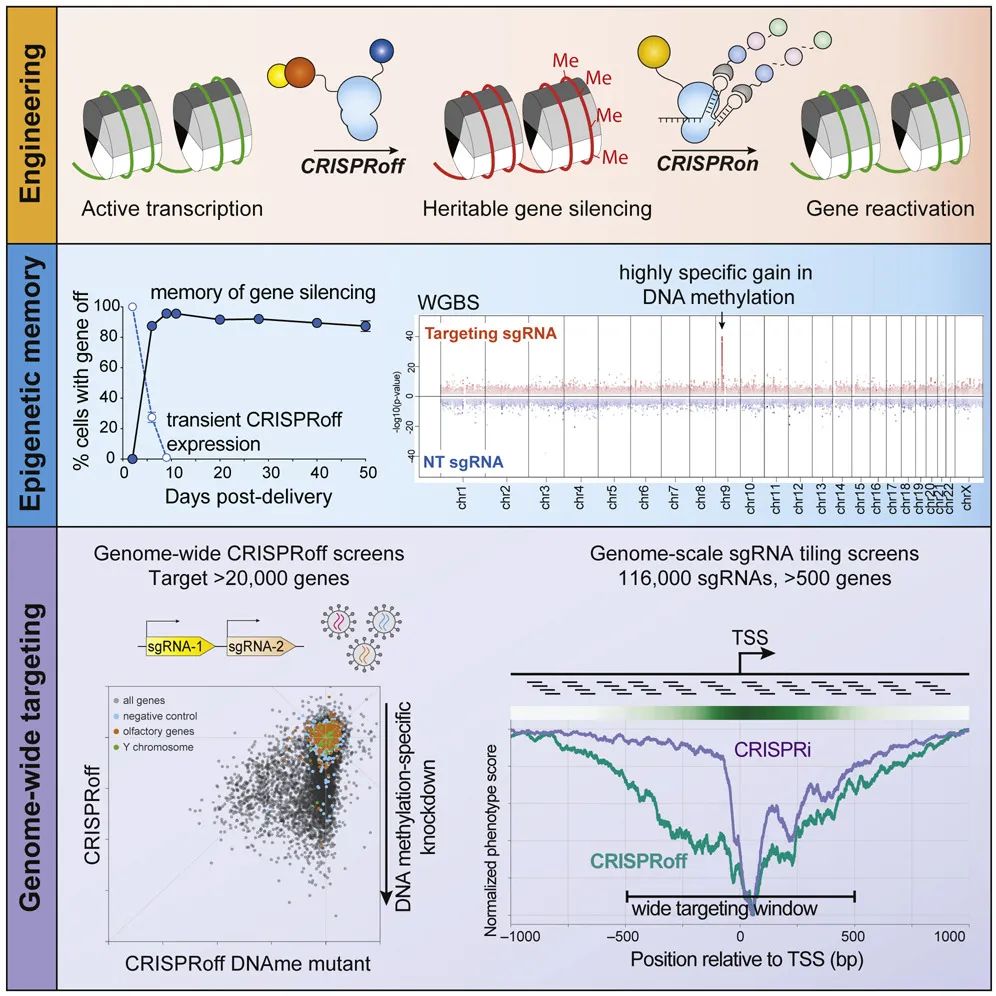
4月9日,一篇发表在《细胞》上的文章,报告了一项全新的基于CRISPR的表观遗传编辑技术[2]:CRISPRoff。
研究者们利用sgRNA能够把Cas9引导到目标位点的能力,但避开了Cas9对的DNA剪切能力,而是将失去酶活性的Cas9(dCas9)与DNA甲基转移酶Dnmt3A、3L以及锌指蛋白10的KRAB结构域相融合,从而达到目标位点DNA甲基化的效果,实现目标基因表达的降低。同时,研究者还开发了匹配的CRISPRon,能够对CRISPRoff的编辑进行逆转。
这项技术从表观遗传层面实现基因表达的抑制,其效果不仅精准高效、适用基因广泛,更是经得住多达450代的细胞分裂、以及干细胞的分化,可以说是表观基因编辑技术的大进步!
CRISPRoff并不是世上第一个特异性表观遗传编辑技术。从原理上来讲,特异性的表观遗传编辑技术,都需要借助某些蛋白的DNA结合域(如锌指蛋白,转录激活因子样效应物核酸酶(TALE),以及Cas9等),将它们与能够改写表观基因标记的酶结合在一起,产生目标位点的表观基因改写[3]。这些技术的有效性,则既取决于DNA结合域的特异性,也取决于所结合的酶的功效。
然而,目前的表观遗传编辑技术编辑效果还很有限,想要得到稳定的效果,需要在细胞内长期表达相关的功能性蛋白,如果需要针对多个基因,还需要引入多个功能性蛋白。这不仅使得该技术在实验室里用起来不便,更大大限制了它作为新型基因治疗手段的转化前景。
相比之下,CRISPRoff的表现非常优秀。
具体有多优秀呢?研究者们在对HEK293T细胞系转染了一次表达融合蛋白的质粒和sgRNA后,检测到目标基因编码的蛋白表达明显下降,相应地,目标基因转录的信使RNA减少,其CpG岛的DNA甲基化增加。
重点来了:50天后,细胞已经经过多代分裂,dCas9融合蛋白早在40天前就检测不到了,依然有超过90%的细胞保持了基因表达关闭的状态。这说明,仅仅一次dCas9融合蛋白的表达和sgRNA递送,就可以得到持久的表观基因编辑效果!
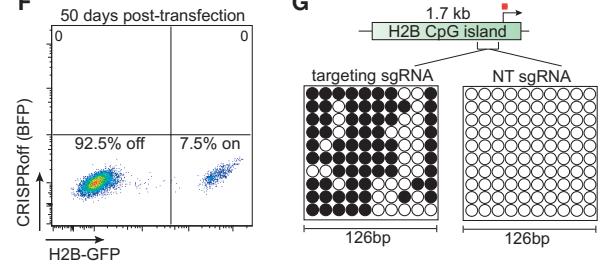
经过CRISPRoff处理后的细胞,50天后保持了基因表达沉默的状态(左),目标基因CGI甲基化显著增加(右,黑点代表检测到DNA甲基化)
CRISPRoff还具有优异的特异性以及适用广泛性。
全基因组亚硫酸盐测序结果显示,在目标基因前后55kb的范围内,只有目标基因的CpG岛DNA甲基化水平出现显著增加,说明了CRISPRoff并不会影响到目标位点邻近序列的表观基因状态。
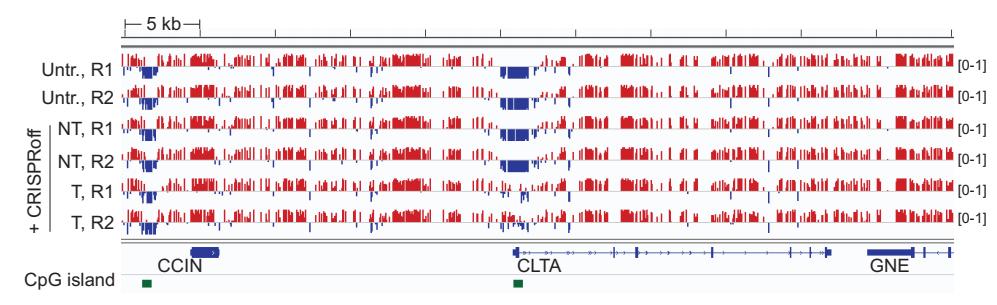
只有目标基因CLTA的CpG岛甲基化显著增加(蓝色为未甲基化)
为了探索CRISPRoff的适用广泛性,研究者们使用了一个针对超过20000个基因的sgRNA库,进行了一个drop-out screen。
简而言之,因为这些目标基因中有很多对细胞存活至关重要(essential genes),它们一旦被CRISPRoff沉默,就会导致细胞的死亡,相应的sgRNA也会随之消失。通过检测存活下来的细胞中的sgRNA,就可以知道哪些基因被有效地沉默了。
深度测序结果显示,在CRISPRoff处理过的细胞中,绝大多数影响细胞存活的基因都被有效沉默了,说明了CRISPRoff的广泛实用性。
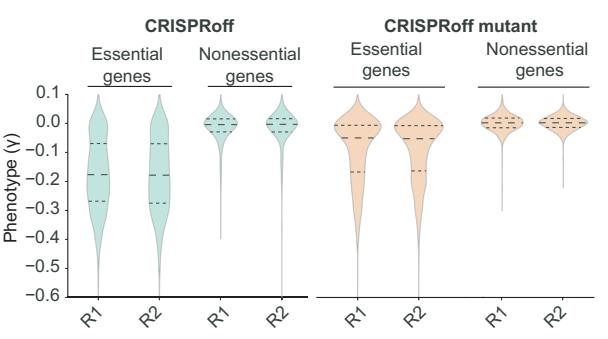
在经CRISPRoff处理后存活下来的细胞中,检测到与essential genes有关的sgRNA广泛减少
这些都还不够, CRISPRoff的优秀之处还体现在,它的表观遗传改写效果,居然在细胞分化后也可以保持。
在干细胞分化的过程中,表观遗传需要经过大量变化,以大范围调控许多基因的表达状态。研究者们发现,在诱导性多能干细胞中引入CRISPRoff,并诱导其分化为神经元细胞,分化后的细胞仍然保留了目标基因的表达水平降低效果。
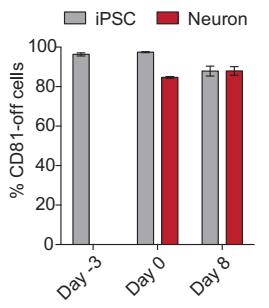
经过CRISPRoff处理的iPSC,经诱导分化为神经元细胞后,其基因沉默效果依然保持,与未经诱导的iPSC沉默水平相近
这么稳定且持久的表观基因改写效果,想反悔怎么办?没关系,该研究团队还针对性地开发了“后悔药”——CRISPRon技术,用于逆转CRISPRoff的编辑效果。
CRISPRon的原理与CRISPRoff类似,同样是利用了sgRNA和dCas9组合的定位能力,只是在dCas9上融合了DNA去甲基酶。在细胞系中的测试结果显示,CRISPRoff处理过的细胞,经过一次CRISPRon的处理后,有74%恢复了目标基因的表达,目标基因的CpG岛甲基化也基本消失。
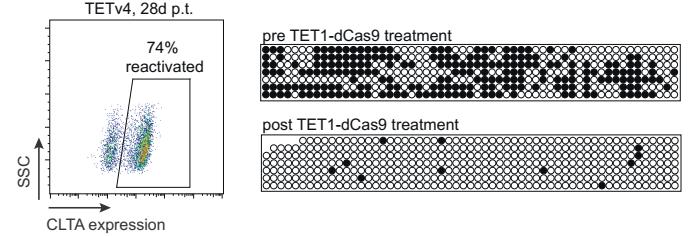
CRISPRon可以逆转CRISPRoff的表观基因编辑效果,包括基因表达的恢复(左)和DNA甲基化的恢复(右)
有趣的是,CRISPRoff的开发过程中还有“意外之喜”。
众所周知,DNA由A、T、C、G四种碱基编码而成,通常来说,只有与G相邻的C可以被甲基化。在人类基因组中,只有70%的基因具有CpG岛,也就是说,按照已知的表观基因调控机制来说,有30%的基因是无法被通过DNA甲基化来调控的。
但是,在对CRISPRoff的表征中,研究者们发现,一部分可以被CRISPRRoff改写的基因,并没有传统意义上CpG岛,说明现有的表观遗传学理解还远不是全部。鉴于科学界对表观遗传的“求知若渴”,以及表观遗传在一些疾病中的重要作用,CRISPRRoff作为一项潜在的表观基因研究工具,也是意义非凡。
总的来说,CRISPRoff使用灵活,效果稳定、可逆,适用基因广泛,且编辑效果耐细胞分裂与分化,可以说令人耳目一新!无论是在基础研究中,用来研究细胞自有的表观遗传调控机制、或者通过调控表达来研究一些重要基因在细胞分化过程中的作用,还是在细胞治疗和基因治疗中的转化前景,CRISPRoff都算得上是未来可期。

参考文献:
1.Yeh CD, Richardson CD, Corn JE. Advances in genome editing through control of DNA repair pathways. Nat Cell Biol. 2019 Dec;21(12):1468-1478. doi: 10.1038/s41556-019-0425-z. Epub 2019 Dec 2. PMID: 31792376.
2.Nuñez JK, Chen J, Pommier GC, Cogan JZ, Replogle JM, Adriaens C, Ramadoss GN, Shi Q, Hung KL, Samelson AJ, Pogson AN, Kim JYS, Chung A, Leonetti MD, Chang HY, Kampmann M, Bernstein BE, Hovestadt V, Gilbert LA, Weissman JS. Genome-wide programmable transcriptional memory by CRISPR-based epigenome editing. Cell. 2021 Apr 29;184(9):2503-2519.e17. doi: 10.1016/j.cell.2021.03.025. Epub 2021 Apr 9. PMID: 33838111.
3.Xu X, Qi LS. A CRISPR-dCas Toolbox for Genetic Engineering and Synthetic Biology. J Mol Biol. 2019 Jan 4;431(1):34-47. doi: 10.1016/j.jmb.2018.06.037. Epub 2018 Jun 26. PMID: 29958882
4.Holtzman L, Gersbach CA. Editing the Epigenome: Reshaping the Genomic Landscape. Annu Rev Genomics Hum Genet. 2018 Aug 31;19:43-71. doi: 10.1146/annurev-genom-083117-021632. Epub 2018 May 31. PMID: 29852072.
5.University of California - San Francisco. "New CRISPR technology offers unrivaled control of epigenetic inheritance." ScienceDaily. ScienceDaily, 16 April 2021..


本文作者 | 刘 一
原标题:《《细胞》:意义非凡!不修改DNA序列的表观遗传CRISPR来了,可逆、不脱靶,细胞分裂450代仍有效丨科学大发现》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




