- +1
【科技前沿】RNAi疗法成为可能,张辰宇团队开发下一代RNAi治疗技术
以下文章来源于生物世界 ,作者生物世界

生物世界
前沿科学进展,尽在生物世界

RNA干扰(RNAi)通过特异性靶向信使RNA(mRNA),实现对相应蛋白质表达的抑制,2006年,RNAi机制的发现者斯坦福大学的Andrew Fire和麻省大学的Craig Mello荣获诺贝尔生理学或医学奖。
RNAi能够调控与疾病相关的基因的表达,因此被认为可作为一种有前途的治疗工具,尤其是那些使用传统方法难以成药的基因。
但是,RNAi疗法遇到了许多问题,并且在临床转化过程中远远落后于预期。RNAi疗法经历了两个发展阶段:
第一阶段是合成裸露的小干扰RNA(siRNA)或化学修饰的稳定siRNA,并通过直接注射递送,但是这种方法难以有效通过生物屏障并到达靶基因。
第二阶段是通过各种递送载体(例如纳米脂质颗粒、阳离子聚合物、病毒载体等)提高siRNA的体内递送效率。
2018年,FDA批准了Alnylam制药公司多年研究开发的RNAi药物Patisiran。用于遗传性ATTR淀粉样变性成人患者第1阶段或第2阶段多发性神经病的治疗。这是全球第一个RNAi生物技术药物,标志着RNAi治疗时代的到来。

尽管有了一些成功的案例,但总体而言,siRNA的体内递送仍然是RNAi药物发展的主要障碍。当前递送策略的共同特征是在体外将siRNA与载体或配体预组装。然而,这些人工复合物经常受到诸如免疫相容性低、毒性高、循环稳定性不足和组织可及性受限的问题困扰。
因此,开发安全、精确和有效的siRNA递送平台,对于下一代RNAi疗法至关重要。
2021年3月29日,南京大学生科院张辰宇教授、陈熹教授、闫超教授、李菁副教授作为共同通讯作者,在 Cell Research 发表了题为:In vivo self-assembled small RNAs as a new generation of RNAi therapeutics 的研究论文。
研究团队设计了可组合和可编程的遗传电路,这些电路使用肝脏作为组织底盘,将外源siRNA的自我组装引导到分泌性外泌体中,并促进体内自组装siRNA的系统/靶向递送。

在这项研究中,研究团队设计了可组合和可编程的遗传电路,该遗传电路能够重编程宿主肝脏,以指导siRNA的合成和自组装成分泌性外泌体,并通过循环外泌体促进siRNA的体内递送。
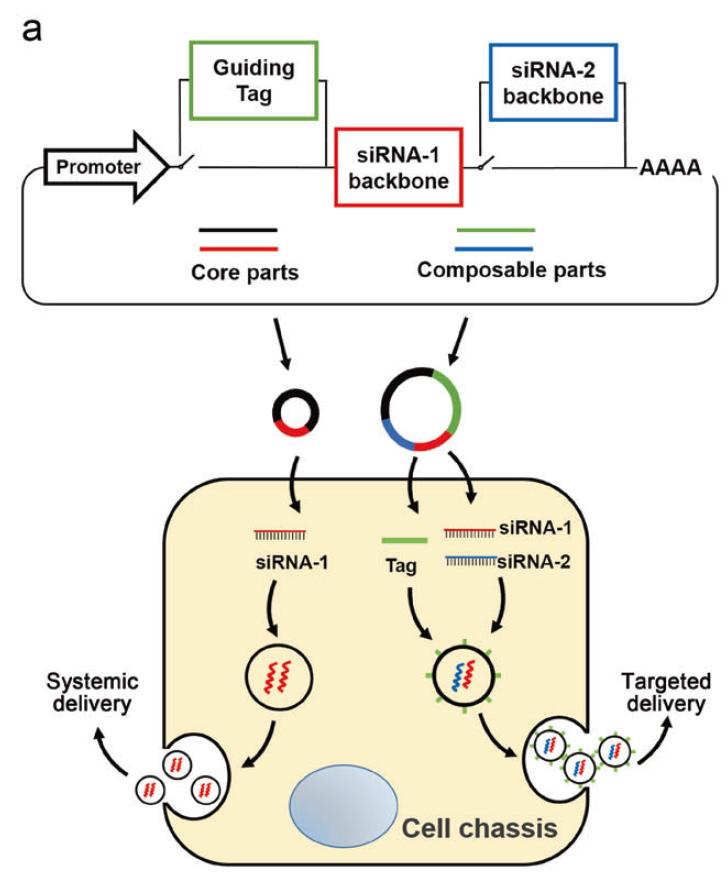
通过组合不同的遗传电路模块,体内组装的siRNA被系统地分布到多个组织或靶向特定组织(例如大脑),从而在这些组织中诱导有效的靶基因沉默。
为了证明该策略的治疗价值,研究团队在多种疾病相关的关键靶基因上进行验证,例如肺癌中的EGFR/KRAS基因,胶质母细胞瘤中的EGFR/TNC,以及肥胖症中的PTP1B。
静脉注射CMV-siR-EGFR能够显著减少原位肺癌模型中的肿瘤形成,延长小鼠寿命。静脉注射CMV-siR-KRAS同样。
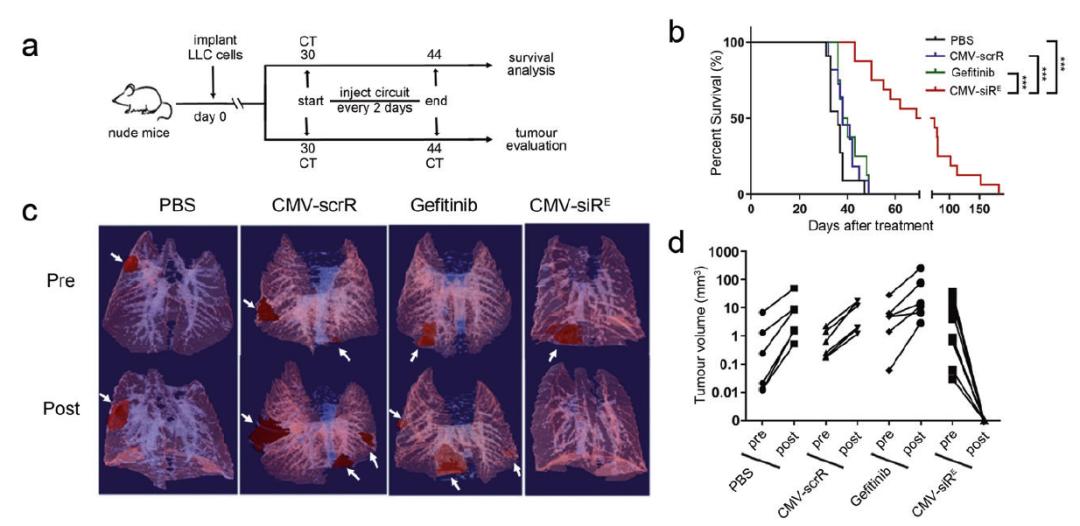
静脉注射CMV-RVG-siR-EGFR+TNC可将siRNA有效递送至小鼠大脑并抑制胶质母细胞瘤生长,并显著延长小鼠寿命。

静脉注射CMV-RVG-siR-PTP1B,能够恢复肥胖小鼠模型的瘦素和胰岛素敏感性,减少肥胖并增加能量消耗。
这些实验结果表明,该体内自组装siRNA策略能够有效沉默上述关键靶点,并对肺癌、胶质母细胞瘤、肥胖症等三种典型疾病产生显著治疗效果。
总而言之,这项研究在异质动态体内环境中诱导了可控和可预测的siRNA自组装和递送,并能够精确调控基因表达。
这项最新技术具有重大理论意义和转化价值,提供了一种可行的策略来克服RNAi体内治疗应用的最重要障碍,让RNAi疗法治疗从癌症到代谢疾病成为可能。
论文链接:
https://www.nature.com/articles/s41422-021-00491-z
作者:王聪
本文转载自公众号”Bio生物世界“(ibioworld)
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【科技前沿】RNAi疗法成为可能,张辰宇团队开发下一代RNAi治疗技术》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




