- +1
完美的“旁杀”癌细胞效应,深度揭秘宝藏ADC杀灭乳腺癌细胞的机制
原创 奇点糕 奇点网 收录于话题#众病之王癌症30#ADC5

在2019年12月中旬举办的第42届圣安东尼奥乳腺癌研讨会上,Ian Krop教授报告的DESTINY-Breast01研究数据引起了全球广泛关注。
当时的研究成果同步发表在《新英格兰医学期刊》上[1]。数天后,抗体偶联药物T-Dxd(DS-8201)获FDA加速审批[2],晚期乳腺癌患者迎来了一种全新的药物。
也正是T-Dxd的成功,让在抗癌药领域默默无闻的第一三共暗暗给自己定下了一个大目标:成长为全球第一的抗体偶联药物(ADC)研发公司[3]。
T-Dxd的诞生
2000年是人类新纪元的开端,也是ADC类药物诞生元年。
自1913年诺奖得主保罗·埃尔利希(Paul Ehrlich)提出“魔法子弹”概念以来[4],科学家经过87年的努力,才在2000年将第一发“魔法子弹”射向肿瘤。
不过,第一发“魔法子弹”的威力和安全性不足以对抗癌症并拯救人类。2011年,第二代ADC的获批,标志着ADC迎来了它的时代。
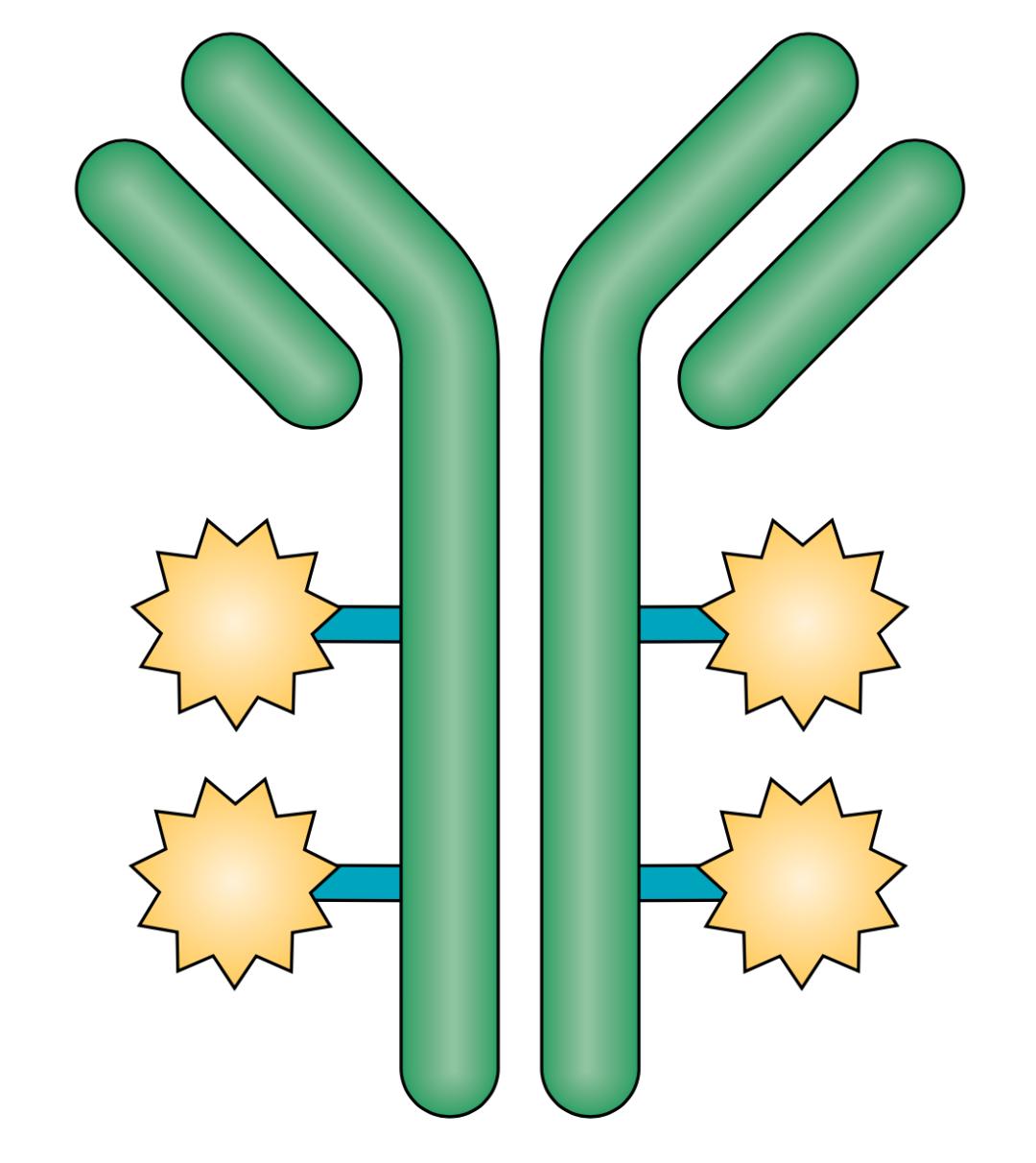
▲ ADC示意图
虽然从2000年至今,FDA已经批准9款ADC药物上市,且ADC的理论和技术也日渐成熟,但是ADC类药物的研发仍旧不易。
远的不说,就在今年年初,同样靶向HER2的ADC药物BAT8001的III期临床失败,相关临床研究随即终止。与此同时,靶向Trop2的ADC药物BAT8003的临床试验也被终止。
有困难的地方,就有机会。
由第一制药和三共在2007年合并组建的第一三共就瞅准了这里面的机会。
在合并之前,第一制药在抗癌化药方面有深厚的积累,盐酸依立替康就是它的产品;而三共则在发酵和人源化抗体领域实力雄厚。
第一三共的科学家很快就意识到,将第一制药和三共的优势结合起来,就是他们在抗肿瘤领域的机会,这个机会就是ADC。
“在分析当时的外部环境和本公司的技术时,发现已有的ADC技术尚不成熟。”第一三共肿瘤第一研究所所长、ADC工作团队的领导人我妻利纪表示,“虽然拥有抗体技术的企业很多,但做ADC的还不多;即使有一些制药企业在进行相关研究,投入的人力也不太多。”
认为ADC尚存机会的我妻利纪,在2009年底招募有志者并设立学习会。2010年6月,在经过多方论证之后,组建了ADC工作团。
现在回过头来看,第一制药和三共的合并似乎在冥冥之中顺应了时代的潮流。
▲ 乳腺癌细胞示意图
那么T-DXd是如何被第一三共做出来的呢?
与其他所有的ADC药物一样,T-Dxd也由抗体、连接子和毒素分子三部分组成,不过在三个组成部分各自的选择上,第一三共却有自己的独到之处。
接下来,咱们就围绕这三部分逐一展开。
先来看抗体。
我妻利纪给T-Dxd选择了与曲妥珠单抗序列完全一致的抗HER2单抗。
选择的原因很简单,作为EGFR跨膜受体家族的成员之一[5],HER2在多种癌症类型中过度表达,如膀胱癌、乳腺癌、宫颈癌、胆管癌、结直肠癌、子宫内膜癌、食管癌、胃癌、头颈癌、肝癌、肺癌、卵巢癌和唾液腺癌等[6,7]。特别是,HER2的扩增和过度表达发生在15%~20%的人类晚期乳腺癌病例中,并与不良预后有关[8,9]。
更重要的是,靶向HER2的抗体药物已经在HER2阳性乳腺癌上大获成功[10-13],证明了靶向HER2的可靠性。但是,曲妥珠单抗仍对一定比例的患者无效,有些患者最初有效后来无效,因此亟需开发新的抗HER药物。
说到这里,还有一个不得不提的小插曲。因为我妻利纪和他的同事对T-Dxd寄予厚望,希望它是抗HER2领域第一流的药物,而 “82”的日文发音恰好与“HER2”相似,所以DS-8201这一开发编号就顺势而生。
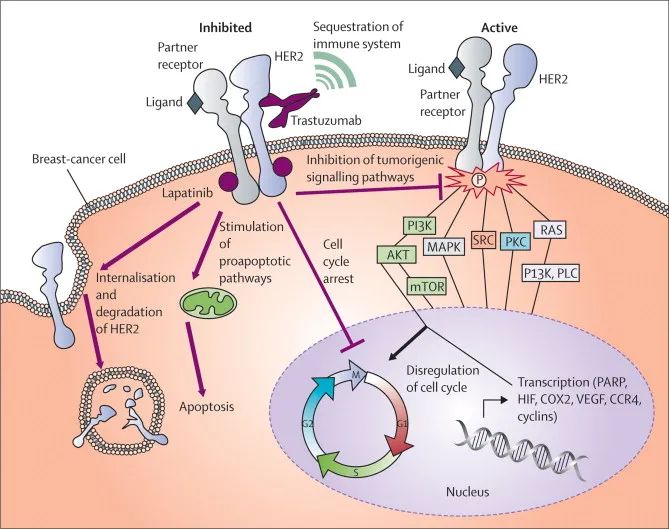
▲ 抗HER2作用机制:10.1016/S1470-2045(09)70315-8
再来看毒素分子。
关于毒素分子,在公司内部评价过去合成的各种化合物时,抑制拓扑异构酶I的抗癌药物依沙替康浮出水面。拓扑异构酶I是参与DNA断裂和结合的一种酶。第一制药曾参与开发了拓扑异构酶I抑制剂盐酸依立替康(CPT11),并于1994年上市销售。
其下一代产品是原第一制药独立研发的化合物依沙替康,开发编号DX-8951f。在DX-8951f的基础上,研究人员开发出了DXd。
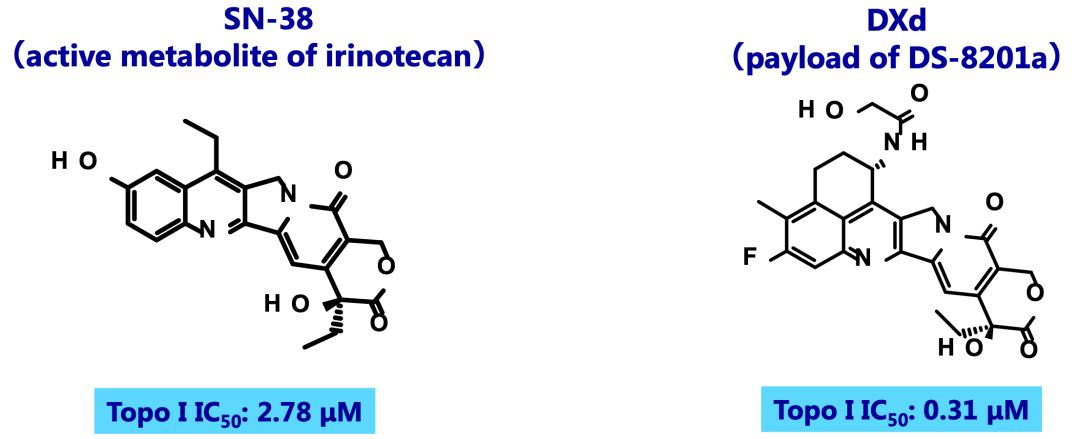
与依立替康一样,DXd是一种拓扑异构酶I抑制剂,它可以与拓扑异构酶I-DNA可裂解复合物结合,从而诱导双链DNA断裂,最终导致癌细胞凋亡[14]。
DXd作为依沙替康的衍生物,虽然和伊立替康具有相同的细胞毒作用机制,但是它的抗癌活性却是伊立替康的活性代谢产物(SN-38)的9倍[15]。此外,DXd还具有脂溶性[16],且在血液中的半衰期较短,动物实验显示,在循环系统中半衰期只有1.37小时[17]。
▲ 毒素分子Dxd
最后是将抗体和毒素分子连起来的连接子。
千万不要小看这个起到连接作用的连接子。一个优秀的连接子,一方面需要经受住血液循环的考验,在进入癌细胞前不提前释放药物;另一方面,一旦ADC进入癌细胞后,连接子能迅速断开,释放杀死癌细胞毒素分子;还有一方面,它不能影响抗体的作用。
我们甚至可以说,连接子的设计是ADC性能的关键所在,有很多ADC都倒在了连接子上。
为了寻找符合上述条件的连接子,第一三共的科学家合成并评价了100多种连接子[18],最终敲定了GGFG四肽连接子。GGFG是一种可酶解的肽,一旦进入肿瘤细胞即可被溶酶体蛋白酶裂解,从而确保了系统循环的稳定性并限制了系统毒性[15]。
找到合适的连接子之后,另一个重要问题是,一个抗体上究竟要连接几个毒素分子。肿瘤第二研究所所长阿部有生和他的同事注意到,当时的ADC大部分是1个抗体连接3-4个毒素分子。这在一定程度上是因为增加毒素分子导致ADC更容易凝聚在一起,影响药物效果。
但是为了生产更稳定的ADC,以及保证ADC有更强大的威力,第一三共的科学家打算通过还原抗体上的4对二硫键,给每个抗体的8个半胱氨酸残基(-SH基)上都连上毒素分子。如此一来,每个抗体就要连接8个毒素分子。
这个想法在当时看来是“打破常识”的,东京大学的津本浩平教授甚至认为,“恐怕业内谁都不会觉得能做到”。更让研究人员欣喜的是,抗体在连接8个有疏水性的毒素分子之后,没有出现凝聚现象,能很好的溶解。这就保证了T-DXd有强大的杀伤力。
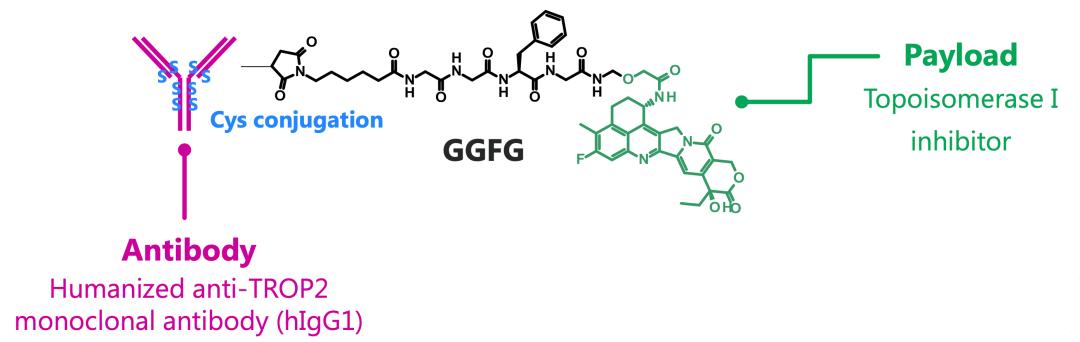
▲ T-Dxd示意图
那么T-Dxd杀死癌细胞的方式有什么特别之处呢?
T-Dxd杀死癌细胞的“三板斧”
从目前的已发表的研究结果来看,T-Dxd猎杀癌细胞有“三板斧”。
第一招是Dxd毒杀癌细胞。
如前文所言,Dxd是DNA拓扑异构酶I抑制剂,它在癌细胞中会诱导双链DNA断裂,最终导致癌细胞凋亡[14]。
第二招是曲妥珠单抗诱杀癌细胞。
我们都知道,抗HER2的曲妥珠单抗是IgG1抗体,它的Fab段与癌细胞表面的HER2结合之后,暴露在外的Fc段会与NK细胞、巨噬细胞等杀伤细胞表面的Fc受体结合,诱导杀伤细胞释放杀伤性物质,杀死癌细胞。这个作用机制就是鼎鼎大名的抗体依赖的细胞介导的细胞毒性作用(ADCC)。
需要指出的是,虽然T-Dxd的抗HER2抗体偶联了Dxd,但是在偶联了DXd之后,仍然保持了曲妥珠单抗的ADCC作用[15]。
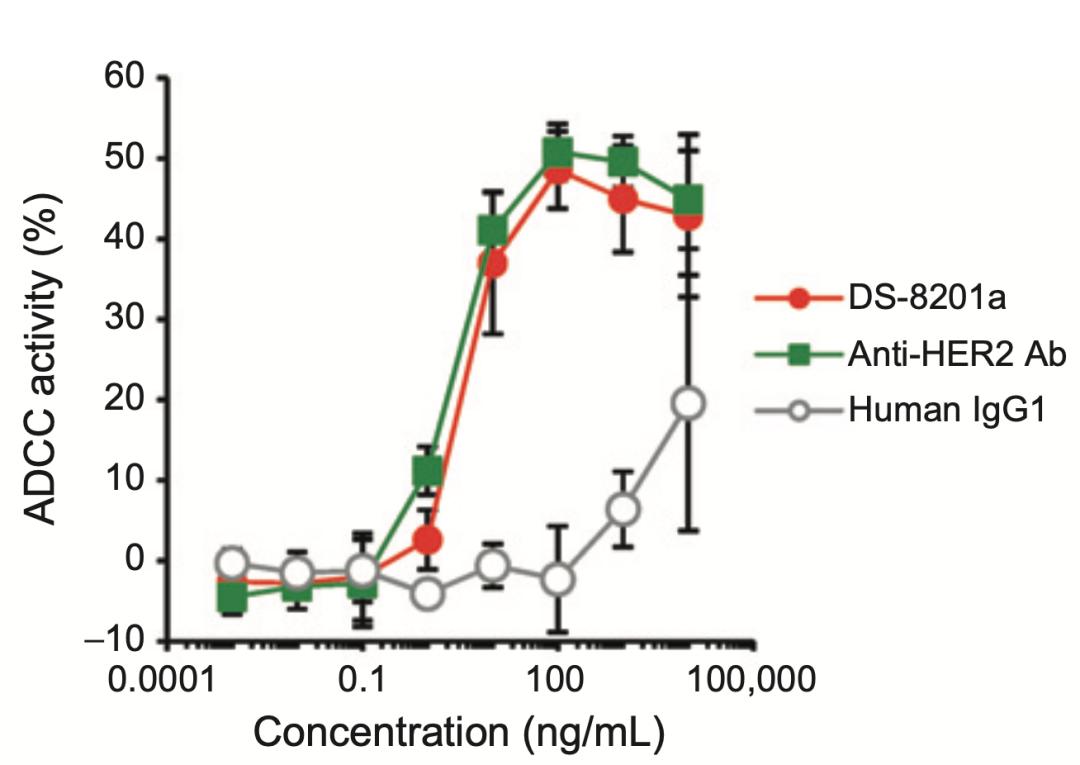
▲ ADCC作用
第三招是Dxd的“旁杀效应”。
这一招非常厉害。我们都知道肿瘤是个非常复杂的组织,它的异质性非常高,即使是HER2阳性的乳腺肿瘤,里面仍会有很多癌细胞HER2水平很低,甚至没有HER2。按照常理,非HER2阳性的癌细胞,ADC药物也是拿它没办法的。
但是T-Dxd是个例外。
由于T-Dxd的连接子是可剪切的,进入癌细胞之后,Dxd就会与抗体解耦连,各自单独行动。而具备脂溶性的DXd就可以自由穿透由脂质形成的细胞膜,跑到癌细胞外面[16]。如此一来HER2阳性癌细胞周围的HER2低表达癌细胞就要遭殃了。
因为DXd既然能从癌细胞出来,也就能自由进去,因此周边的HER2低表达的癌细胞,就会被Dxd一并击杀。这就是T-Dxd的“旁杀效应”。目前另一种用于乳腺癌治疗的ADC类药物T-DM1就不具备这种旁杀效应。
DXd高效的细胞膜穿透能力,以及强大的抗癌活性,再加上一个抗体搭载8个毒性分子的高偶联比例(drug-to-antibody ratio, DAR),让T-Dxd将针对HER2低表达癌细胞的旁杀效应发挥的淋漓尽致。
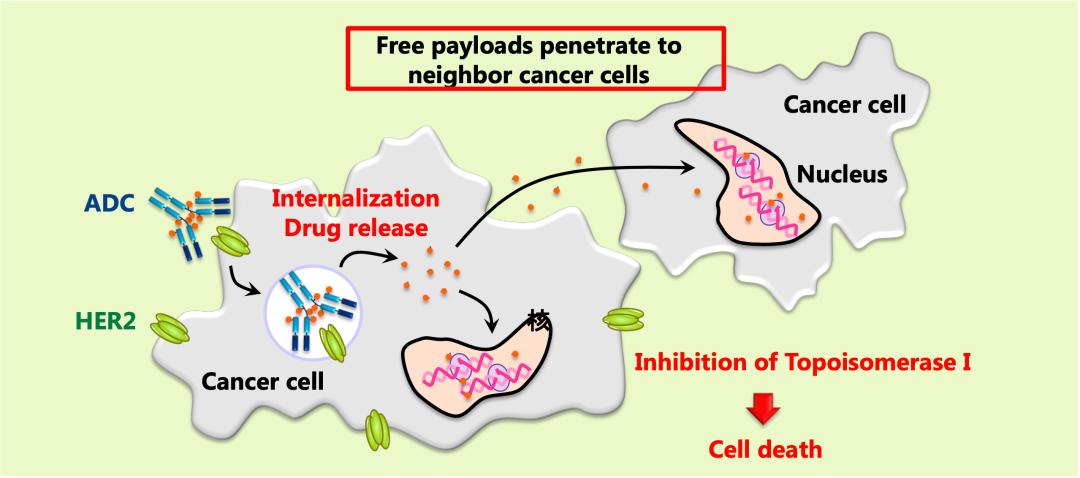
▲ 旁杀效应
看到这里,你可能就要担心了,从T-Dxd上释放下来的Dxd会不会“杀红了眼”,将肿瘤组织周边的健康细胞也杀了呢?甚至Dxd进入血液,随着血液循环危及其他的组织或器官,导致严重的毒副作用呢?
第一三共的研究人员肯定考虑到了这个问题,所以他们让Dxd的半衰期特别短,在循环中的半衰期只有1.37小时[17]。
正如研究人员所愿,研究数据也表明,T-Dxd对HER2阴性细胞的影响仅在HER2阳性细胞相邻的细胞中观察到,而远处的细胞不受Dxd影响;或者说是仅在肿瘤微环境中检测到Dxd的细胞毒性作用[16]。而且临床研究的毒副作用数据也支持这一研究结果[1]。
如何?这个对HER2低表达癌细胞的旁杀效应是不是堪称完美。
总的来说,T-Dxd在临床上的成功,是扎实的基础研究换来的,尤其是研究人员在连接子和毒素分子上投入的研发精力。
T-Dxd除了在晚期乳腺癌的治疗上大放异彩之外,目前HER2阳性乳腺癌的三线、二线和新辅助的治疗,以及HER2低表达接受过化疗或未化疗的乳腺癌患者的治疗正在紧锣密鼓地开展III期临床研究。
此外,T-Dxd单药或者联合免疫治疗等其他疗法在胃癌、肠癌、肺癌,甚至是泛癌种队列中开展临床研究。

▲ 几种ADC的临床研发状态
T-Dxd并不是第一三共在ADC领域的“独生子女”,鉴于T-Dxd的优异表现,基于同一毒素分子和连接子,第一三共还开发了很多ADC药物,例如靶向HER3分子的U3-1402,治疗肺癌、乳腺癌和肠癌的临床研究正在开展;而靶向于TROP2分子的DS-1062,治疗肺癌和乳腺癌的研究也在如火如荼的开展之中。
此外还有靶向B7-H3的DS-7300,靶向GPR20的DS-6157,靶向CDH6的DS-6000等也进入了临床研发阶段。
无论如何,本奇点糕期待更多的ADC类抗癌药物获得成功,让魔法子弹变得更精准更高效。
参考文献:
[1].Modi S, Saura C, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer[J]. New England Journal of Medicine, 2020, 382(7): 610-621.
[2].https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-fam-trastuzumab-deruxtecan-nxki-unresectable-or-metastatic-her2-positive-breast-cancer.
[3].https://www.irwebcasting.com/20191217/2/f23199187b/media/191217_daiichisankyo_en_02.pdf
[4].Strebhardt K, Ullrich A. Paul Ehrlich's magic bullet concept: 100 years of progress[J]. Nature Reviews Cancer, 2008, 8(6): 473.
[5].Coussens L, Yang-Feng T L, Liao Y C, et al. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene[J]. Science, 1985, 230(4730): 1132-1139.
[6].Yan M, Parker B A, Schwab R, et al. HER2 aberrations in cancer: implications for therapy[J]. Cancer treatment reviews, 2014, 40(6): 770-780.
[7].Yan M, Schwaederle M, Arguello D, et al. HER2 expression status in diverse cancers: review of results from 37,992 patients[J]. Cancer and Metastasis Reviews, 2015, 34(1): 157-164.
[8].Gonzalez-Angulo AM, Litton JK, Broglio KR, et al. High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2-positive, node-negative tumors 1 cm or smaller[J]. J Clin Oncol. 2009;27(34):5700-5706.
[9]. Onitilo AA, Engel JM, Greenlee RT, Mukesh BN. Breast cancer subtypes based on ER/PR and Her2 expression: comparison of clinicopathologic features and survival[J]. Clin Med Res. 2009;7(1-2):4-13.
[10].Slamon D J, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J]. New England journal of medicine, 2001, 344(11): 783-792.
[11].Bang Y J, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. The Lancet, 2010, 376(9742): 687-697.
[12].Baselga J, Cortés J, Kim S B, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer[J]. New England Journal of Medicine, 2012, 366(2): 109-119.
[13].Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer[J]. New England Journal of Medicine, 2012, 367(19): 1783-1791.
[14].Pommier Y. Topoisomerase I inhibitors: camptothecins and beyond[J]. Nature Reviews Cancer, 2006, 6(10): 789-802.
[15].Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with differentiation from T-DM1[J]. Clinical Cancer Research, 2016, 22(20): 5097-5108.
[16].Ogitani Y, Hagihara K, Oitate M, et al. Bystander killing effect of DS‐8201a, a novel anti‐human epidermal growth factor receptor 2 antibody–drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity[J]. Cancer science, 2016, 107(7): 1039-1046.
[17].Nagai Y, Oitate M, Shiozawa H, et al. Comprehensive preclinical pharmacokinetic evaluations of trastuzumab deruxtecan (DS-8201a), a HER2-targeting antibody-drug conjugate, in cynomolgus monkeys[J]. Xenobiotica, 2019, 49(9): 1086-1096.
[18].Ogitani Y, Abe Y, Iguchi T, et al. Wide application of a novel topoisomerase I inhibitor-based drug conjugation technology[J]. Bioorganic & medicinal chemistry letters, 2016, 26(20): 5069-5072.
本文作者 | BioTalker
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




